甲萘醌-7是维生素K2(又称甲萘醌,MK-n)中的一员,因甲基萘醌母环C-3位置上含有7个异戊二烯单元的异戊二烯侧链组成,因而称为MK-7(图 1)。MK-7具有较长的半衰期,可在血液中稳定存在,因而是哺乳动物中凝血因子Ⅱ、VⅡ、IX和X的一个重要的辅因子,参与血液凝固[1, 2]。在调节骨骼生长方面,因MK-7可以抑制成骨细胞的生长,从而刺激成骨细胞的分化,形成骨头。国外学者指出,补充一定量的MK-7能够提高骨头中的矿物质密度(BMD),降低髋骨骨折风险[3],还有利于提高骨钙蛋白的羧化作用[4]。此外,MK-7可降低血压[5],促进以神经生长因子为媒介的PC 12D细胞的轴突生长[6],通过调控Ca2+的利用和促进Gla蛋白质(matrix gla protein,MGP)的活性,防止钙质在血管中沉淀而造成的动脉硬化[7]等。MK-7具有多种生理功能,因此MK-7作为新一代的保健食品,其功能正在受到越来越多的关注。
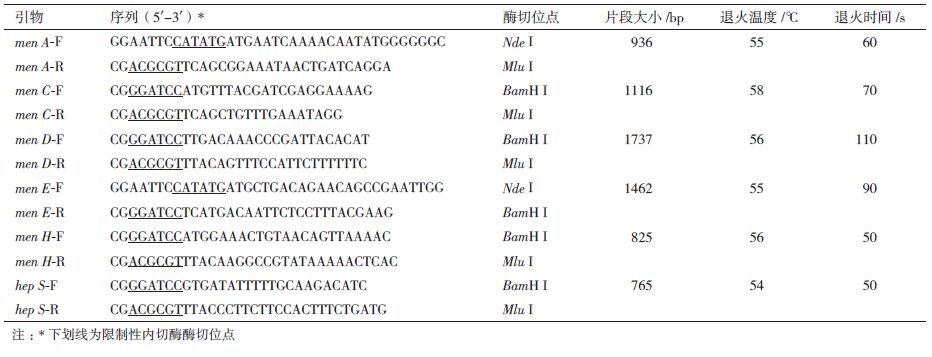
MK-7等维生素K2同系物都是由一个相同的甲萘醌母环和含有不同异戊二烯单元个数的侧链组成。其中甲萘醌母环是从赤藓糖-4-磷酸开始合成,经过莽草酸、分枝酸、异分枝酸、2-琥珀酰-6-羟基-2,4-环己二烯-1-羟酸(SHCHC)以及邻苯甲酸(OSB)等中间化合物,合成萘醌母环1,4-二羟基-2-萘甲酸DNHA。其中分枝酸又是合成酪氨酸、苯丙氨酸和色氨酸3种芳香族氨基酸的前体物质,因此甲萘醌母环的合成又会受到这3种氨基酸的反馈抑制。乙酰CoA是异戊二烯侧链合成的起始化合物,经过甲羟戊酸、异戊烯焦磷酸、牛儿基香叶基焦磷酸等中间物质,合成侧链聚异戊二烯焦磷酸。萘醌母环和侧链经酶催化合成后再经过一步甲基化反应就合成了最终的维生素K2。图 1是作者根据KEGG公布的代谢网络绘制的MK-7合成途径[8],在这个过程中,共有8个酶控制从异分枝酸开始的甲萘醌母环的合成以及从异戊烯焦磷酸开始的侧链的合成,共有9个基因参与这一过程,它们分别是men A、men B、men C、men D、men E、men G、men H、hep T和hep S,其中hep T和hep S控制同一个酶的两个亚基的合成。这些合成基因的公布对进一步研究维生素K2的代谢途径具有重要的意义。以此为研究背景,本研究考察MK-7合成途径中上述酶基因过表达后对MK-7合成的影响,旨为探讨MK-7合成途径中代谢调控机制和为后期采用代谢工程手段选育高产MK-7菌株提供理论参考和现实依据。
|
| 图 1 MK-7的合成途径 |
筛选获得的解淀粉芽孢杆菌Y-2(Bacillus amyloliquefaciens Y-2),保藏于武汉中国典型微生物保藏中心(CCTCC),保藏号:CCTCC M 2013493。大肠杆菌JM109(Escherichia coli JM109)、枯草芽孢杆菌168(Bacillus subtilis 168)、质粒pMA5保藏于本实验室。
1.1.2 培养基及培养方法种子培养基(g/L):葡萄糖15、蛋白胨15、KH2PO4 1、K2HPO4·3H2O 2.5、MgSO4·7H2O 2.5,pH7.0-7.2。发酵培养基(g/L):1 L 玉米粉液化液(玉米粉在100℃下经高温α-淀粉酶处理30 min)、豆粕粉41.52,大豆蛋白胨16.31、酵母膏15.51、K2HPO4·3H2O 0.13、NaCl 3.11,pH7.0-7.2。LB培养基(g/L):酵母提取物5、胰蛋白胨10、NaCl 10、pH7.0-7.2添加5 g/L葡萄糖即为LBG培养基,添加15 g/L琼脂即为相应的固体培养基,必要时补加终浓度为100 mg/L氨苄青霉素用于重组大肠杆菌的筛选或者50 mg/L卡那霉素用于重组芽孢杆菌的筛选。B. subtilis转化培养基:① SPI培养基(20 mL):9.8 mL SPI-A盐溶液(2 μL Na3C6H5O7·2H2O、4 g/L(NH4)2SO4、28 g/L K2HPO4·3H2O,12 g/L KH2PO4)、9.8 mL SPI-B溶液(0.4 g/L MgSO4·7H2O)、200 μL 100×CAYE溶液(20 g/L酪蛋白水解物,100 g/L酵母提取物)、200 μL 500 g/L葡萄糖溶液;② SPⅡ培养基(6 mL):5.88 mL SPI培养基,60 μL 50 mmol/L CaCl2溶液,60 μL 250 mmol/L MgCl2溶液。B. amyloliquefaciens转化培养基配方基本同上,只是在SPI-B盐溶液中加入终浓度为40 mL/L吐温-80,其他组分不变。除发酵培养基外,其他培养基在0.1 MPa下高压灭菌20 min,而发酵培养基在0.07 MPa下高压灭菌20 min。菌体培养温度为(37±1)℃,培养时间为8-12 h。非特殊说明,在摇瓶发酵培养时将对数生长期的种子液按2%(v/v)接种量转接于发酵培养基中,在(37±1)℃条件下的往复式摇床上培养。
1.2 方法 1.2.1 感受态细胞的制备与转化方法E. coli感受态细胞的制备与转化方法参照Green和Sambrook指出的方法,采用CaCl2溶液处理制备E. coli感受态细胞并采用冰浴热激的方法实现细胞转化[9]。采用李瑞芳等[10]的方法,完成对B. subtilis和B. amyloliquefaciens感受态细胞的制备与转化。
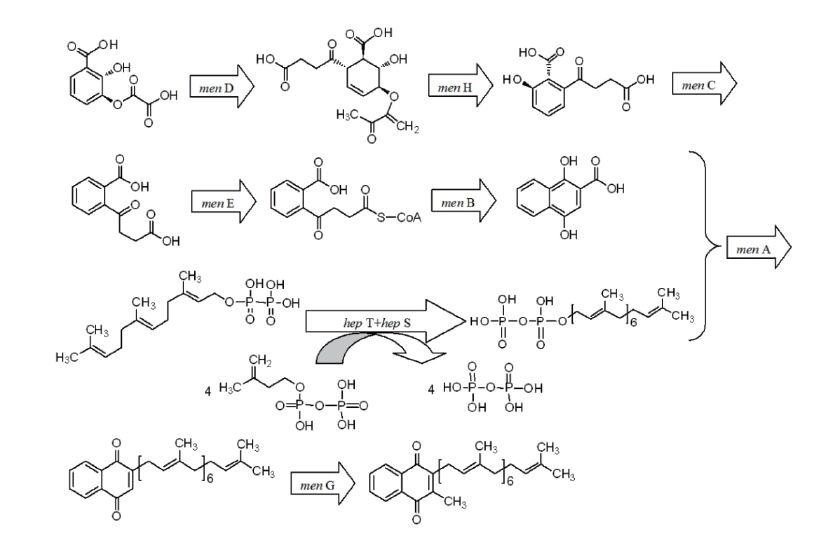
1.2.2 重组菌株的构建首先通过PCR扩增反应获得不同基因的片段,其中片段大小、所使用的引物及其PCR条件如表 1所示。随后,参照Sambrook和Russel建立的遗传改造方法,构建含有不同基因的重组表达质粒(图 2)。最后,参照经典的芽孢杆菌转化法(即spizizen转化法)[11],将上述构建好的重组质粒转化到B. subtilis 168或菌株Y-2,获得不同重组菌株。
|
| 图 2 携带不同基因的重组质粒的构建 X:目标基因,即men A、men C、men D、men E、men H或hep S |
参照Berenjian等[12]和严为留等[13]建立的方法对样品中MK-7进行提取,整个提取过程尽量避光,同时增加萃取次数以提高提取效率。利用高效液相色谱法(HLPC)检测MK-7时参照严为留等[13]建立的方法,MK-7浓缩液经上机液溶解后采用0.22 μm微孔滤膜过滤,然后进行HLPC分析。液相色谱条件及进样量参照严为留等[13]设定的参数。
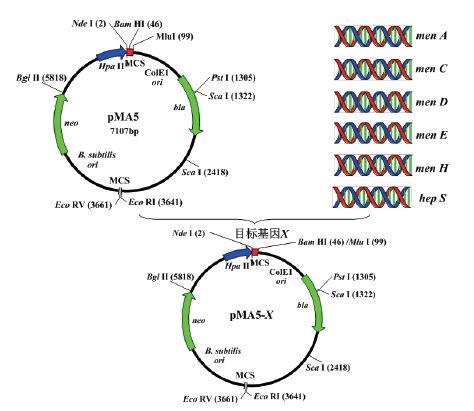
2 结果 2.1 重组质粒的构建前期对实验室保藏的一株高产MK-7的B. amyloliquefaciens Y-2和只有微弱MK-7合成能力的B. amyloliquefaciens W-21的同一基因进行测序对比,发现其中有6个基因序列差别较大,分别为men A、men C、men D、men E、men H和hep S,因此对这6个基因进行研究。根据测序和比对结果,设计这6个基因的开放阅读框(ORF)全长的扩增引物,并根据设计的引物分别扩增这6个基因,将得到的6个基因片段分别构建到大肠杆菌B. subtilis穿梭型质粒pMA5(简称P5)上,重组质粒构建过程见图 2。为判断获得的重组质粒的正确性,对构建好的重组质粒进行了单双酶切验证。从图 3中可以看出,酶切得到的基因片段大小和目的基因片段一致(表 1),因此可以推断所获质粒确实为目的重组质粒。与基因名称相对应,所构建的重组质粒分别命名为P5-A、P5-C、P5-D、P5-E、P5-H和P5-S。
|
| 图 3 重组质粒的双酶切验证 M:DNA Marker(15000 bp);1:质粒P5-A;2:质粒P5-C;3:质粒P5-E;4:质粒P5-D;5:质粒P5-H;6:质粒P5-S |
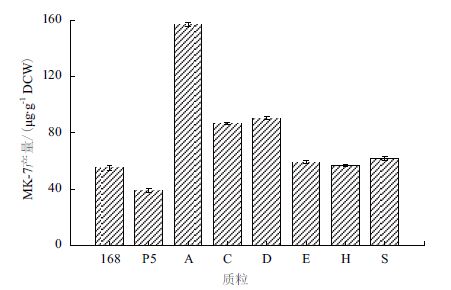
B. subtilis 168自首次被发现能够摄取外源DNA以来,国内外学者已经对其转化机制进行了透彻的研究,最经典的spizizen转化法对常见质粒转化都能获得较高的转化效率[11, 14]。此外,B. subtilis 168的表达系统比较完善,容易验证目的基因是否能够成功表达。因此,本研究考察了不同重组质粒在B. subtilis 168中过表达对MK-7合成的影响。利用spizizen转化法筛选B. subtilis 168的阳性转化子,分别命名为168/P5-A、168/P5-C、168/P5-D、168/P5-E、168/P5-H和168/P5-S。将上述重组B. subtilis分别接种到添加了50 mg/L卡那霉素的表达培养基中,在37℃,100 r/min的条件下培养24 h后,离心收集菌体,并利用有机溶剂萃取后检测MK-7含量。结果(图 4)显示,重组菌株的MK-7产量均高于对照菌株168(54.3±7.2 μg/g DCW),特别是菌株168/P5-A(155.1±5.5 μg/g DCW),MK-7产量提高了185.6%;其次是菌株168/P5-D(89.0±2.3 μg/g DCW)和菌株168/P5-C(85.6±3.2 μg/g DCW),产量分别提高了64.1%和57.5%;其他菌株168/P5-S(60.6±7.1 μg/g DCW)、168/P5-E(58.3±1.8 μg/g DCW)和168/P5-H(55.9±5.3 μg/g DCW),MK-7产量分别提高了11.6%、7.4%和2.9%。然而,需要注意的是,将空载质粒pMA5转化到菌株168后(即重组菌株168/P5),MK-7产量反而下降(38.7±4.6 μg/g DCW)。以上结果表明,目的基因在B. subtilis 168中均成功实现了表达,且过表达的基因对MK-7的合成起到促进作用。
|
| 图 4 出发菌株168和重组菌株的MK-7产量 168:B.subtilis 168;P5:168/P5;A:168/P5-A;C:168/P5-C;D:168/P5-D;E:168/P5-E;H:168/P5-H;S:168/P5-S |
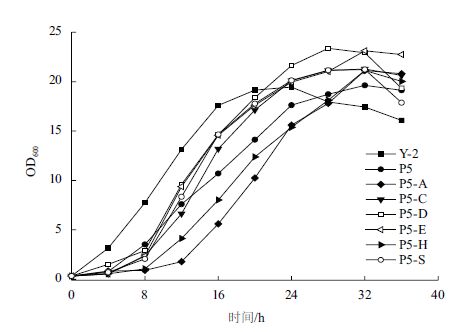
虽然B. amyloliquefaciens和B. subtilis的亲缘关系较近,但将来源于B. subtilis 168的重组质粒用spizizen转化法转化B. amyloliquefaciens Y-2时,仍不能获得有效的转化子。这就说明菌株Y-2的细胞膜通透性较一般的野生型芽孢杆菌要低,要想成功转化质粒,则必须要增强Y-2的细胞膜通透性。因此,本研究首先考察了吐温-80的添加量对菌株Y-2转化率的影响。以spizizen转化法为基础,在SPⅡ培养基中添加不同体积比的吐温-80发现,添加40 mL/L的吐温-80能获得15-25个转化子,因此在接下来的实验中就以改进后的spizizen转化法转化菌株Y-2,重组质粒还是来源于B. subtilis 168。通过采用改进的spizizen转化法,成功将6个重组质粒分别转化野生型B. amyloliquefaciens Y-2,获得重组菌株Y-2/P5、Y-2/P5-A、Y-2/P5-C、Y-2/P5-D、Y-2/P5-E、Y-2/P5-H和Y-2/P5-S。随后考察了出发菌株和重组菌株在表达培养基中菌体生长情况。结果(图 5)表明,重组菌的生长速率均要慢于野生菌,但是最大菌体量都比野生菌高。
|
| 图 5 重组Y-2的生长曲线 |
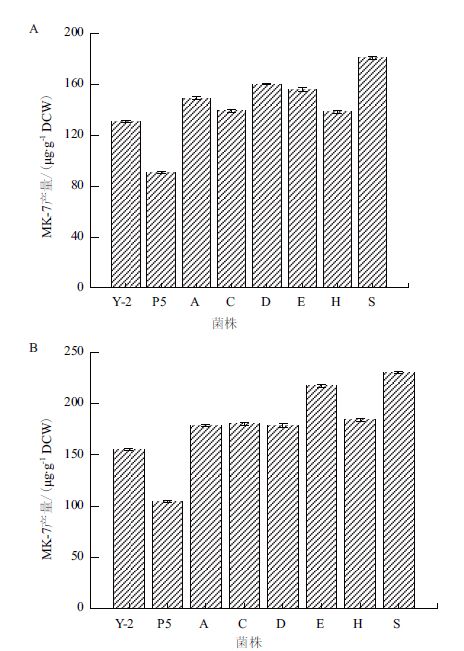
由于野生型Y-2在摇瓶培养和静置培养的条件下均能够合成MK-7,其中摇瓶培养条件下产(138.4±8.5)μg/g DCW MK-7,而静置培养MK-7产量达(154.7±13.1)μg/g DCW。虽然菌体在静置培养的条件下能够合成更多的MK-7,但是在摇瓶培养下质粒能够得到更多的复制和表达,进而也能够促进MK-7的合成。因此作者对各重组菌在这两种培养条件下的MK-7产量均进行了研究,结果见图 6所示。
|
| 图 6 重组Y-2在摇瓶培养(A)和静置培养(B)条件下的MK-7产量 Y-2:B.amyloliquefaciens Y-2;P5:Y-2/P5;A:Y-2/P5-A;C:Y-2/P5-C;D:Y-2/P5-D;E:Y-2/P5-E;H:Y-2/P5-H;S:Y-2/P5-S |
从图 6中可以看出,分别过量表达上述6个基因均能提高MK-7的产量,其中过表达基因hep S对MK-7产量的影响最大,如摇瓶组产量提高了38%(191.0±12.7 μg/g DCW),静置培养组产量提高了48%(228.9±7.6 μg/g DCW),其余几个基因的表达对MK-7合成的影响则根据培养方式的不同而各有差异。此外,与将空载质粒pMA5转化到菌株168类似,携带有空载质粒pMA5的重组菌株Y-2/P5的MK-7生产能力要低于菌株Y-2。
3 讨论MK-7生物合成途径中共有8个酶控制从异分枝酸开始的甲萘醌母环的合成以及从异戊烯焦磷酸开始的侧链的合成,有9个基因参与这一过程,它们分别是men A、men B、men C、men D、men E、men G、men H、hep T和hep S[8]。然而,我们前期研究发现不同MK-7生物合成水平的菌株中,6个基因(即men A、men C、men D、men E、men H和hep S)的基因序列差别较大(实验结果未指出),因此本研究重点考察了这6个基因过表达对MK-7合成的影响。
与孙娟娟等[15]在研究过程中相同,从大肠杆菌中提取的重组质粒直接转化B. amyloliquefaciens Y-2的转化率非常低,基本无法转化。其原因可能是在B. amyloliquefaciens中存在着一种由限制性内切酶和甲基化酶组成的限制修饰系统,从而使得B. amyloliquefaciens对外源DNA具有较强的降解能力[16, 17]。从进化距离来看,B. amyloliquefaciens和B. subtilis有着较近的亲缘关系。Akamatsu和Taguchi[11]指出,从大肠杆菌中提取的重组质粒能以较高的转化率直接转化到B. subtilis 168。因此,我们前期研究考察了将构建好的质粒先转化到B. subtilis 168中,再从重组B. subtilis 168中提取可能经过修饰的质粒转化野生型B. amyloliquefaciens Y-2,以期实现提高转化的成功率。然而,实验结果表明转化的成功率并未得到提高,可能的原因是菌株Y-2的细胞膜通透性低。表面活性剂,如吐温-80等,能够降低目的蛋白与细胞膜之间的相互作用,促进目的蛋白在芽孢杆菌中的分泌表达[18]。魏艳等[19]比较了表面活性剂吐温-80与DMSO等有机溶剂对野生型B. subtilis NX-2的转化效率的影响,结果表明,添加吐温-80的转化率较为稳定,而有机溶剂的促转化作用则不太稳定。因此,本研究以spizizen转化法为基础,在SPⅡ培养基中添加40 mL/L的吐温-80,从而实现了将外源重组质粒转化到菌株Y-2。
在考察了不同重组质粒在B. subtilis 168中过表达对MK-7合成的影响时发现,目的基因在B. subtilis 168中均成功实现了表达,且MK-7的合成起到促进作用(图 4)。其中,过表达基因men A对B. subtilis 168合成MK-7具有显著的促进作用。该结果与Kong等[20]研究结果相似,他们在研究了大肠杆菌中甲萘醌-8(MK-8)的合成途径时发现,过表达基因men A可使大肠杆菌合成MK-8含量提高2倍。此外,将不同重组表达质粒在B. amyloliquefaciens Y-2中过表达,对菌体生长和MK-7的合成也具有不同的影响。图 5显示,重组菌的生长速率均要慢于野生菌,但是最大菌体量都比野生菌高。这可能是因为在菌体生长前期,质粒的复制加重了菌体的负担,但是当质粒表达后,增强了菌体呼吸链中的电子传递效率,提高了菌体的呼吸强度,从而增加了最大菌体量。与在B. subtilis 168过表达不同,虽然6个目的基因的过表达对B. amyloliquefaciens合成MK-7具有促进作用,但是起关键作用的基因是hep S。基因hep S和基因hep T一起,控制MK-7侧链合成酶--七异戊烯焦磷酸合成酶(EC:2.5.1.30)两个亚基的合成[20]。此外,需要指出的是在不同培养条件下,除基因hep S外,其他基因对MK-7合成的影响存在差别,特别是基因men E(图 6)。因此作者推断,在MK-7的合成途径中,不同培养条件下基因的表达水平存在差异,培养条件的改变可能也会导致酶的调控方式发生改变。非常有趣的是,将空载质粒pMA5转化到B. subtilis 168或菌株Y-2会导致出发菌株合成MK-7的能力下降(图 4和图 6)。具体的调节机制还不明了,因此我们推断是由于质粒pMA5转入可能会影响细胞内基因表达水平的改变,从而影响MK-7的产量,具体原因还需做进一步研究。
4 结论本研究对一株产MK-7的菌株B. amyloliquefa-ciens Y-2维生素K2合成途径中的6个主要酶基因分别进行克隆和表达,指出了过量表达菌株Y-2维生素K2合成途径中6个基因的任何一个均能提高MK-7的产量,其中过表达基因hep S对菌株Y-2合成MK-7影响最大,特别是在静置培养时可使MK-7产量提高48%。其余几个基因过表达后对MK-7产量的影响则根据培养方式的不同而各有差异。
| [1] | Wu WJ, Ahn BY. Isolation and identification of Bacillus amyloliquefaciens BY01 with high productivity of menaquinone for cheonggukjang production. J Korean Soc Appl Biol Chem , 2011, 54 (5) : 783–789. DOI:10.1007/BF03253160 |
| [2] | Ebrahiminezhad A, Varma V, Yang S, et al. Magnetic immobilization of Bacillus subtilis natto cells for menaquinone-7 fermentation. Appl Microbiol Biotechnol , 2016, 100 : 173–180. DOI:10.1007/s00253-015-6977-3 |
| [3] | Forli L, Bollerslev J, Simonsen S, et al. Dietary vitamin K2 supplement improves bone status after lung and heart transplantation. Transplantation , 2010, 89 (4) : 458–464. |
| [4] | Berenjian A, Chan NLC, Mahanama R, et al. Effect of biofilm formation by Bacillus subtilis natto on Menaquinone-7 biosynthesis. Mol Biotechnol , 2013, 54 : 371–378. DOI:10.1007/s12033-012-9576-x |
| [5] | Kim YK, Kim SM, Kim JY, et al. The culture filtrates from Bacillus subtilis natto lowers blood pressure via rennin-angiotersin system in spontaneously hypertensive rats fed with a high-cholesterol diet. J Korean Soc Appl Biol Chem , 2011, 54 (6) : 959–965. DOI:10.1007/BF03253186 |
| [6] | Tsang CK, Kamei Y. Novel effect of vitamin K, (phylloquinone)and vitamin K2(menaquinone)on promoting nerve growth factor-mediated neurite outgrowth from PC 12D cells. Neurosci Lett , 2002, 323 : 9–12. DOI:10.1016/S0304-3940(01)02550-2 |
| [7] | Kresimir P, Henrik R, Tom P. Safety and toxicological evaluation of a synthetic vitamin K2, menaquinone-7. Toxicol Mech Methods , 2011, 21 (7) : 520–532. DOI:10.3109/15376516.2011.568983 |
| [8] | KEGG PATHWAY[DB/OL]. Http://www.genome.jp/kegg-bin/show_pathway?map=map00130&show_description=show, 2013-05-28. |
| [9] | 萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 第3版. 黄培堂, 译. 北京:科学出版社, 2008. |
| [10] | 李瑞芳, 薛雯雯, 黄亮. 枯草芽孢杆菌感受态细胞的制备与质粒转化方法研究. 生物技术通报 , 2011, 5 : 227–230. |
| [11] | Akamatsu T, Taguchi H. Plasmid transformation of competent Bacillus subtilis by lysed protoplast DNA. J Biosci Bioeng , 2012, 114 : 138e. DOI:10.1016/j.jbiosc.2012.03.002 |
| [12] | Berenjian A, Mahanama R, Talbot A, et al. Efficient media for high menaquinone-7 production:response surface methodology approach. New Biotechnol , 2011, 28 : 665–672. DOI:10.1016/j.nbt.2011.07.007 |
| [13] | 严为留, 张伟国, 钱和, 等. 纳豆芽孢杆菌发酵生产MK-7的产物提取与检测. 食品与生物技术学报 , 2013, 32 (8) : 891–895. |
| [14] | Spizizen J. Transformation of biochemically deficient strains of Bacillus subtilis by deoxyribonucleate. Proc Nat Acad Sci USA , 1958, 44 : 304–310. |
| [15] | 孙娟娟. 普鲁兰酶在解淀粉芽孢杆菌中表达方法的探索[D]. 无锡:江南大学, 2011. |
| [16] | 刘洋, 沈微, 石贵阳, 等. 解淀粉芽孢杆菌Bam HI甲基转移酶基因克隆、功能鉴定与序列分析. 生物技术通报 , 2009 (11) : 65–68. |
| [17] | Connaughton JF, Vanek PG, Lee LQ, et al. Cloning of the Bam HI methyl transferase gene from Bacillus amyloliquefaciens. Gene Anal Tech , 1988, 5 (6) : 116–124. DOI:10.1016/0735-0651(88)90011-8 |
| [18] | 傅明亮, 董亚晨, 刘晓杰, 等. 表面活性剂与氧载体对地衣芽孢杆菌ZJUEL31410发酵产弹性蛋白酶的影响. 中国食品学报 , 2011, 2 : 17–23. |
| [19] | 魏艳, 张丹, 蔡恒, 等. 适用于野生型枯草芽孢杆菌转化有机溶剂方法的建立和优化. 生物学通报 , 2011, 46 (12) : 42–45. |
| [20] | Kong MK, Lee PC. Metabolic engineering of menaquinone-8 pathway of Escherichia coli as a microbial platform for vitamin K production. Biotechnol Bioeng , 2011, 108 (8) : 1997–2002. DOI:10.1002/bit.23142 |