2. 湛江市食品药品检验所,湛江 524088
2. Zhanjiang Food and Drug Institute,Zhanjiang 524088
鱼类加工生产过程产生较多内脏下脚料,尤其淡水鱼内脏器所占比例较大,如淡水罗非鱼的内脏高达总重量的38%左右。鱼内脏包括鱼腮、肝、胃、胆以及肠道等,肠道内有未消化的食料,适合用于制作生物有机肥。纳豆菌即纳豆芽孢杆菌(Bacillus naato),革兰氏阳性好氧菌,最初在纳豆食品中发现,其次生代谢产物具有广谱的抑菌作用[1-3]。纳豆菌被广泛用于制作饲料添加剂及微生态抗菌剂[4],该菌能在5-55℃条件下生长繁殖,芽孢状态的纳豆菌耐高温能力和持久力很强,在生长繁殖过程产生大量的蛋白质分解酶、脂肪分解酶以及纳豆激酶等,因此能快速分解鱼内脏中的蛋白质、脂肪以及肌纤维,并且在发酵过程不会产生臭味。许多芽孢杆菌都是土壤和植物根系重要的细菌群[5],能产生具有抑菌作用的脂肽类化合物,目前已发现芽孢杆菌产生的脂肽类化合物有surfacin[6, 7]、fengycin[8, 9]、iturin[10]、bacillomycin[11]、mycosubtilin[12]和plips-tatin[13]等,这些脂肽类物质部分已用于制作绿色无害的农药。王东和王帅等[14, 15]发现纳豆菌产生的抗菌脂肽主要是fengycin、surfacin和iturin,其中fengycin具有较强的表面活性和抗真菌特别是抗丝状真菌的活性[16, 17]。立枯丝核菌(Rhizoctonia solani)又称茎基腐病菌,是严重危害农作物的土传病原菌,其危害作用是通过引起作物茎基腐烂,最后导致死苗[18, 19],目前主要依靠农药减少其病害,但尚未从根本上解决该病菌的危害问题。
基于以上原因,本研究拟以纳豆菌为发酵菌兼功能菌制作鱼内脏生物有机肥,将成品有机肥进行正常种植试验和染立枯丝核菌种植试验,并将纳豆菌与立枯丝核菌进行对峙培养试验,以期探明纳豆菌鱼内脏有机肥对立枯丝核菌的抗性应用效果。
1 材料与方法 1.1 材料 1.1.1 实验材料纳豆芽孢杆菌(Bacillus naato)NT-6:广东海洋大学食品科技学院CAMT学术团队实验室保藏菌种;立枯丝核菌(Rhizoctonia solani Kühn)SK215:广东海洋大学农学院实验室保藏菌种;鱼内脏:湛江市国联水产有限公司提供;NT-6液态种子培养基:牛肉膏0.5%、大豆粉2%、蔗糖1%、磷酸二氢钾0.3%、磷酸氢二钾0.6%、硫酸镁0.02%、NaCl 0.5%、自然pH;NT-6扩大培养培养基:大豆粉0.9%、玉米粉0.2%、鱼内脏2%,自然pH;试剂:水合茚三酮,三氯乙酸(TCA),乙醇(95%体积),乙醚,石油醚(30-60℃沸腾),盐酸;固态种子培养基:BPY培养基、PDA培养基。以上试剂及培养基均购买于北京陆桥生物技术有限公司。
1.1.2 主要仪器离心机(Sigma 2-16KL):德国Sigma公司;旋涡混合器(XW-80A):上海表浦沪西仪器厂;振荡培养箱(HZQ-QX):上海百典仪器设备有限公司;数显鼓风干燥箱(GZX-9140MBE):上海博迅实业有限公司医疗设备厂;pH计(PB-10):广州市授科仪器科技有限公司。
1.2 方法 1.2.1 NT-6发酵鱼内脏生物有机肥的制作 1.2.1.1 NT-6发酵剂制备将纳豆芽孢杆菌NT-6划线接种于BPY斜面试管培养基,置于37℃培养20-24 h,加入无菌生理盐水将试管的菌苔刮脱制成菌悬液,将菌悬液用旋涡混合器振荡1 min后按体积10%的接种量接种于液态种子培养基,于37℃、振荡频率为200 r/min的培养箱培养1 d后,以1∶10的比例接入液态扩大培养基中培养至细胞总数为1×1010以上,即为待用发酵剂。
1.2.1.2 NT-6发酵过程加入与鱼内脏等重量的花生壳(花生壳粉碎,过30目),使发酵基料疏松通气,同时使水分含量适当降低,然后加入发酵基料重量6%的玉米粉,翻拌均匀后置于105℃蒸汽中灭菌15 min,冷却至室温后接种5%的NT-6发酵剂,混拌均匀后装入透气编织袋,每袋装10 kg,置于恒温箱37℃发酵。由于在发酵腐熟过程微生物分解有机质并产生CO2和热量[20],因此,随着物料中有机质的消耗,发酵过程物料中心温度会发生变化,温度在初期升高较快,然后逐渐变慢直至下降,物料中心温度是判断有机肥腐熟度的表观标志[21],因此在袋装的发酵物料中插入一支温度计,实时观察发酵物料中心温度的变化,并检测物料中蛋白质及脂肪的降解情况。当发酵物料中心温度超过65℃时必须取出袋中物料翻拌散热,然后再重新装袋发酵,以免温度过高影响纳豆菌细胞的活性。当物料中心温度不再升高而接近环境温度(恒温箱温度37℃)时,即可判断为发酵终点,然后取出发酵物料平摊为层厚10 cm,置于55℃鼓风干燥、包装即为成品。
1.2.2 物料发酵过程蛋白质及脂肪的降解情况检测 1.2.2.1 发酵过程蛋白质降解率检测蛋白质降解率:按发酵后蛋白质态氮的减少量所占原蛋白质氮的百分率进行计算;蛋白质态氮=总氮-氨基酸态氮-非蛋白氮;总氮含量检测:微量凯氏定氮法[22];氨基酸态氮含量检测:水合茚三酮比色法[23];非蛋白氮含量检测:用15% TCA沉淀去除蛋白后,用微量凯氏定氮法检测。
1.2.2.2 发酵过程脂肪降解率检测用酸水解法:称取有机肥10 g于500 mL具塞量筒,加入8 mL蒸馏水混匀,再加入50 mL盐酸混匀,之后于80℃水浴加热45 min,期间不断搅拌使脂肪充分游离出来,然后取出冷却至室温,依次加入50 mL乙醇和125 mL乙醚,加塞盖后用旋涡混合器振荡1 min,开塞泄气后再盖好静置至上部液体澄清,吸出上层清液于已恒重的锥形瓶,再加25 mL乙醚于量筒振荡,静置后再将上层澄清液体吸出,合并澄清液于恒重的锥形瓶,将锥形瓶置于水浴蒸干后,再置于100℃干燥2 h,取出锥形瓶置于干燥器中冷却至室温后称重,称得的重量减去锥形瓶的恒重即是脂肪重量。计算发酵前后的脂肪重量差值占原基质脂肪的百分含量即是脂肪降解率。
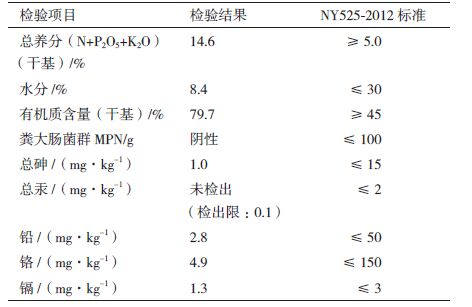
1.2.3 成品有机肥质量检验 1.2.3.1 有机肥质量项目检测委托湛江市质量计量监督检测所根据《中华人民共和国农业行业标准》NY525-2012中的有机肥肥质量指标进行检测。
1.2.3.2 有机肥NT-6细胞存活能力检测每隔一个月用稀释平板计数法检测NT-6菌落总数和芽孢数量;细胞总数用稀释平板计数法检测,芽孢数量用灭活法检测,具体方法:称取有机肥25 g加入225 mL无菌水,搅拌后置于80℃恒温水浴15 min,然后取上清液用稀释平板计数法检测菌落总数,此菌落总数表示芽孢数量。
1.2.4 成品有机肥的应用试验 1.2.4.1 制作染立枯丝核菌园土将立枯丝核菌接种斜面PDA培养基试管,培养3 d后加入无菌水,添加无菌水的量为刚好浸没试管菌丝为止,使菌丝液具有一定的含菌量,用接种环将菌丝刮脱制成菌丝液,取出菌丝液用旋涡混合器振荡2 min使菌丝分散均匀,按菌丝液200 mL与2 kg园土的比例混合翻拌均匀。
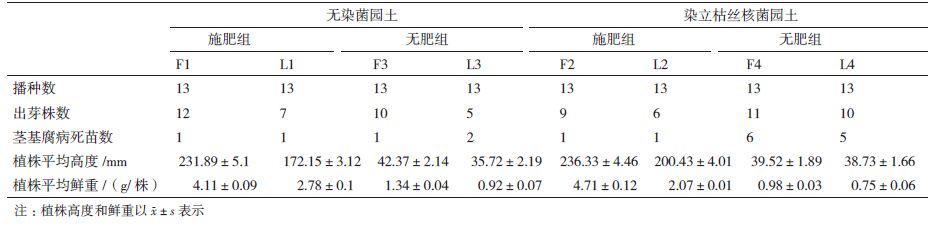
1.2.4.2 作物播种发芽及生长试验将染立枯丝核菌的园土、原园土分别加入有机肥,参考作物施肥用量[24],按25 g/kg园土混合并翻拌混匀,取8个直径为25 cm的塑料花盆分别装染菌有肥园土、无染菌有肥园土、染菌无肥园土、无染菌无肥园土各2盆,相同园土的2盆分别播种番茄和辣椒种子,即每种作物种子4盆,种植番茄的盆分别命名为F1、F2、F3和F4,种植辣椒的盆分别命名为L1、L2、L3和L4,分别是有肥无染菌园土盆(F1、L1)、有肥染菌园土(F2、L2)、无肥无染菌园土(F3、L3)、无肥染菌园土(F4、L4)各1 kg,番茄和辣椒种子每盆播种13粒,用无菌水浇灌,观察各试验盆的种子发芽情况、病苗情况,生长至45 d时用游标卡尺测量各盆植株生长高度,对比各盆植株根系情况,并用天平称量植株鲜重。
1.2.5 NT-6与立枯丝核菌的对峙培养试验用PDA培养基和BPY培养基以1∶1混合制作培养基,倒置平皿冷却至常温后在平皿中央相隔2 cm处各接种SK215和NT-6,置于30℃恒温培养3 d后,观察菌落的生长状况,并镜检立枯丝核菌细胞。
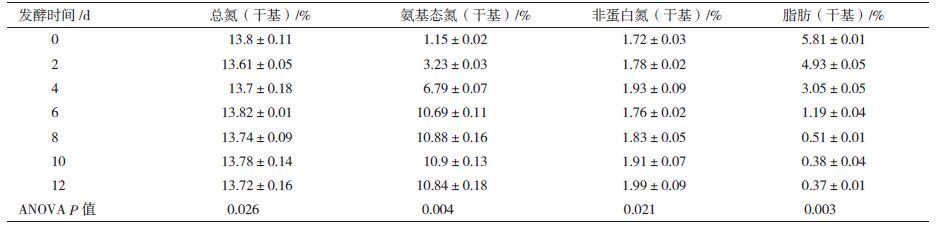
2 结果 2.1 有机肥发酵过程中心温度、蛋白质及脂肪的降解变化发酵过程物料中氨基酸态氮、非蛋白氮、总氮含量和脂肪含量的检测结果(以x±s表示)及数据方差分析,见表 1。数据显示,总氮和非蛋白氮在发酵过程的变化不显著,而氨基酸态氮含量变化及脂肪变化都显著,由表 1数据计算蛋白质及脂肪降解率,并将结果与发酵过程物料中心温度的变化作柱形图,如图 1所示,发酵第8天蛋白质和脂肪降解率分别达到90.6%和91.2%,很显然,物料中心温度的变化与蛋白质和脂肪降解率结果相一致,由此可知发酵至第8天可以结束发酵。

|
| 图 1 物料发酵过程蛋白质、脂肪降解及中心温度的变化 |
成品有机肥质量检测结果(表 2)显示,检测的各项结果均符合标准NY525-2012要求。
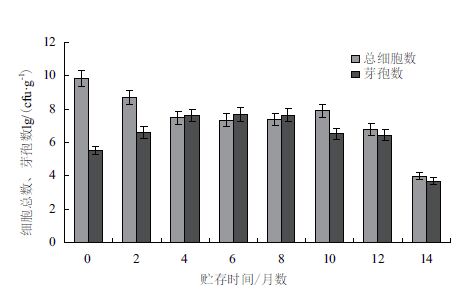
每隔两个月对成品有机肥所含的NT-6细胞总数及芽孢数量的检测结果取对数值,并作柱形图分析。结果(图 2)显示,NT-6的总细胞数在4个月之前比芽孢数量多,并呈现总细胞数逐渐减少、芽孢数量逐渐增多的趋势,贮存4个月细胞总数与芽孢数接近,说明此时NT-6细胞基本全是芽孢状态,直至12个月细胞数量比较稳定,到第14个月时出现细胞数量骤减的现象,由此可知,在室温条件下12个月内成品有机肥可维持NT-6细胞相对稳定。
|
| 图 2 室温下保存的有机肥中NT-6总细胞及芽孢数量的变化 |
8个试验组中番茄和辣椒发芽与生长状况(表 3)显示,出芽率与SK215和有机肥的作用影响不大,但添加有机肥的植株生长速度较快,无论是染菌园土或是原园土中,添加有机肥的番茄(F1、F2)和辣椒(L1、L2)平均生长量是不加有机肥(F3、F4和L3、L4)的3倍左右;在染菌园土中不添加肥料的番茄(F4)和辣椒(L4)死苗率相当于添加肥料的(F1和L1)7倍和3倍以上,而在原园土中有肥与无肥组茎基腐病死苗相差较小(图 3)。图 4显示番茄种子和辣椒种子生长45 d的状态,用有机肥的试验组F1、F2、L1、L2比不用有机肥的试验组F3、F4、L3、L4幼苗长势旺盛,根系较粗较多,如图 5所示,无论在染菌园土(A1,A2)或在原园土中(B1、B2)用有机肥组植株的根系都比较多而粗,而不用有机肥的试验组植株根系较少较细。

|
| 图 3 番茄(A)与辣椒(B)的正常苗与茎基腐病苗 A:番茄茎基腐病苗(左)与正常苗(右);B:辣椒正常苗(左)与茎基腐病苗(右) |

|
| 图 4 添加及不加有机肥的番茄苗(F1-F4)和辣椒苗(L1-L4)生长45 d的状况 F1、L1:有肥无染菌盆;F2、L2:有肥染菌盆;F3、L3:无肥无染菌盆;F4、L4:无肥染菌盆 |

|
| 图 5 染立枯丝菌园土及原园土种植番茄和辣椒苗根系比较 A1,A2:分别是染菌园土种植的番茄和辣椒苗根系,左侧根系均是不用有机肥的植根,右侧是用有机肥的植根;B1,B2:分别是原园土种植的番茄和辣椒苗根系,左侧根系均是用有机肥的植根,右侧均是不用有机肥的植根 |
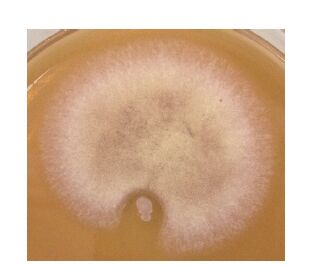
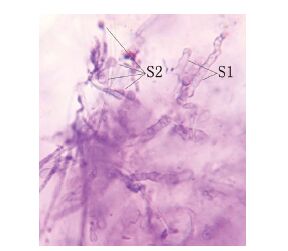
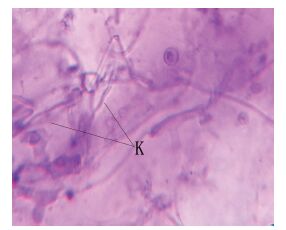
NT-6与SK215对抗生长培养试验的结果(图 6)显示,NT-6菌落周围出现明显的抑菌区,用解剖针分别挑取SK215菌落被NT-6抑制而局限生长的菌丝及其它位置正常生长的菌丝,用25%酒精的番红染液水浸片镜检观察,结果发现正常生长区的SK215菌丝较粗大,成熟菌丝具有串状桶形细胞(图 7中S1),同时具有担子及担孢子(图 7中S2),而抑菌圈边缘的SK215菌丝生长较细小(图 8中K),而且菌丝内没有串状桶形细胞,也没有形成担子及担孢子,这说明NT-6抑制了SK215菌丝的正常生长和繁殖,因此出现平皿中对抗生长的抑菌区。
|
| 图 6 NT-6与SK215对抗生长 |
|
| 图 7 正常生长的SK215菌丝 菌丝S1粗,有串状桶形细胞;S2是担子及担孢子 |
|
| 图 8 畸形生长的SK215菌丝 菌丝K较细且无正常的串状桶形细胞 |
立枯丝核菌是土传病原菌,试验结果出现不加成品有机肥的试验组茎基腐病率明显比添加有机肥试验组高的现象,说明有机肥的使用能降低病死苗的数量。另外,纳豆菌NT-6发酵制得的鱼内脏有机肥含纳豆菌细胞可以达到109个/g 以上,并且在室温条件下存放12个月内细胞数保持相对稳定;在NT-6与SK215的对峙生长试验中NT-6对SK215具有明显的抑制作用,同时镜检发现受抑制的立枯丝核菌菌丝生长畸形,应该是由于纳豆菌产生的抗菌脂肽使立枯丝核菌不能形成担孢子,并导致菌丝生长畸形的缘故。纳豆菌对立枯丝核菌的抑制现象与龚庆伟[25]及王帅[15]对芽孢杆菌抗菌脂肽抑制真菌的研究结论相类似,NT-6对SK215的抑制作用应该是成品有机肥降低番茄和辣椒茎基腐病苗率的原因。
土壤的营养作用对作物种子出芽率影响较小,种子出芽率主要取决于种子本身的质量,以及环境的氧气、温度和水分等[26-28],因此本实验结果出现用有机肥与不用有机肥的试验组种子发芽率相接近的现象;在植株生长方面,有机肥明显促进番茄和辣椒根系生长,并且根系数量较多,生长速度较快,这是因为有机肥不仅增加了土壤的有机养分,还改善了土壤的结构,提高了土壤的透气性,增加土壤溶氧量,有利于根系吸收水分和矿物质离子的运输,促使根系快速增殖和生长,从而增大根系吸收面积及活跃面积,提高植株的生长速度和抗病害能力[29]。
4 结论以鱼内脏为主要基质,以纳豆菌NT-6作为发酵菌和功能菌制作的有机肥发酵周期约为8 d,成品肥料中纳豆菌的菌落总数达到1×109 CFU/g,并且在12个月内细胞数相对较稳定,纳豆菌对立枯丝核菌有抑制作用,纳豆菌发酵的鱼内脏有机肥不但促进作物快速生长,而且减少茎基腐病苗的发生几率。
| [1] | 王继伟, 葛英亮, 于晋, 等. 纳豆芽孢杆菌次生代谢产物抑菌功能有研究. 食品与机械 , 2013, 29 (3) : 94–100. |
| [2] | 邓建良, 刘红彦, 王鹏涛, 等. 生防芽孢杆菌脂肽抗生素研究进展. 植物保护 , 2010, 36 (3) : 20–25. |
| [3] | 李仲兴, 王秀华, 强翠欣, 等. 纳豆菌对光滑念珠菌的抗菌活性研究. 中国病原生物学杂志 , 2015, 10 (5) : 410–413. |
| [4] | 单丽君, 郑晓冬, 管惠东, 等. 纳豆菌发酵动力学研究初探. 中国食品学报 , 2005, 5 (2) : 39–42. |
| [5] | 尹聪, 许啸. 纳豆菌微生态制剂的研究进展. 北方牧业 , 2012 (1) : 38–42. |
| [6] | Marikawa M, Ito M, Imanaka T. Isolation of a new surfactin producer Bacillus pumilus A-1, andcloning and nucleotide sequence of the regulator gene, psf-1. Journal of Fermentation and Bioengineering , 1992, 74 (5) : 255–261. DOI:10.1016/0922-338X(92)90055-Y |
| [7] | Mannanov RN, Sattarova RK. Antibiotic produced by Bacillus bacteria. Chemistry of Natural Compounds , 2001, 37 (2) : 117–123. DOI:10.1023/A:1012314516354 |
| [8] | Stein T. Bacillus subtilis antibiotics:structure, syntheses and specific functions. Mol Microbiol , 2005, 56 (4) : 845–857. DOI:10.1111/j.1365-2958.2005.04587.x |
| [9] | 刘向阳, 杨世忠, 牟伯中. 微生物脂肽结构. 生物技术通报 , 2005 (4) : 18–25. |
| [10] | Leenders F, Stein TH, Kablitz B, et al. Rapid typing of Bacillus subtilis strains by their secondary metabolites using matrix-assisted laser desorption ionisation mass spectrometry of intact cells. Rapid Commun Mass Spectrom , 1999, 13 (10) : 943–949. DOI:10.1002/(ISSN)1097-0231 |
| [11] | Baker CJ. Biocontrol of bean rust by Bacillus subtilis under field conditions. Plant Disease , 1985, 69 (9) : 770–775. |
| [12] | Berrocal-Lobo M, Molina A, Solano R. Constitutive expression of ethylene response-factor in Arabidopsis confers resistance to several necrotrophic fungi. The Plant Journal , 2002, 29 (1) : 23–32. DOI:10.1046/j.1365-313x.2002.01191.x |
| [13] | Bleecker AB. Ethylene perception and signaling:an evolutionary perspective. Trends Plant Sci , 1999, 4 (7) : 269–274. DOI:10.1016/S1360-1385(99)01427-2 |
| [14] | 王东, 孙力军, 王雅玲, 等. 纳豆菌抗菌肽APNT-6对凡纳滨对虾的保鲜效果. 水产学报 , 2012, 36 (7) : 1133–1139. |
| [15] | 王帅. 芽孢杆菌及其脂肽类化合物防治植物病害和促进植物生长的研究[D]. 南京:南京农业大学, 2009. |
| [16] | Vanittanakom N, Loeffler W. Fengycin-a novel antifugal lipopeptide antibiotics produced by Bacillus subtilis F-29-3. The Journal of Antibiotics(Tokyo) , 1986, 39 (7) : 888–901. DOI:10.7164/antibiotics.39.888 |
| [17] | Koumoutsi A. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42. Journal of Bacteriology , 2004, 186 (4) : 1084–1096. DOI:10.1128/JB.186.4.1084-1096.2004 |
| [18] | 于冰, 申屠旭萍, 俞晓平. 丰加霉素对黄瓜立枯丝核菌的拮抗作用. 中国生物防治学报 , 2011, 27 (3) : 373–377. |
| [19] | 张靖宜, 张倩如, 项文化, 等. 一株拮抗立枯丝核菌的放线菌筛选、鉴定及生理特性. 生物学杂志 , 2014, 33 (2) : 394–399. |
| [20] | 匡石滋, 刘传和, 田世尧, 等. 香蕉与菠萝叶资源肥料化利用模式及技术. 现代农业科技 , 2013 (15) : 253–255. |
| [21] | 周美红. 利用生活垃圾与污泥堆肥生产生物有机肥工艺研究[D]. 西安:西北大学, 2007. |
| [22] | 万建荣, 奚印慈. 水产食品化学分析手册[M]. 上海: 上海科学技术出版社, 1993. |
| [23] | 韩雅珊. 食品化学实验指导[M]. 北京: 北京农业大学出版社, 1992. |
| [24] | 王学军, 王艳丽. 有机肥用量对大白菜品质的影响. 安徽农业科学 , 2009, 37 (13) : 5923–5924. |
| [25] | 龚庆伟. 芽孢杆菌抗菌脂肽的分离纯化及Bacillomycin D抑制黄曲霉作用的研究[D]. 南京:南京农业大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10307-1013285850.htm |
| [26] | 关柱芳. 浅谈影响种子发芽试验结果的因素及调控措施. 农业科技通讯 , 2013 (1) : 77–137. |
| [27] | 卢杰, 郑维列, 张建新. 温度对长鞭红景天种子发芽的影响. 西北林学院学报 , 2010, 25 (3) : 101–106. |
| [28] | 马树龙. 林业育苗中影响种子发芽因素探讨. 现代农业科技 , 2013 (18) : 167. |
| [29] | 金慧, 吴景贵, 李江楠, 等. 施用有机肥对作物生长性状影响的研究进展. 现代农业科技 , 2010 (12) : 261–271. |