2. 黑龙江省科学院高技术研究院,哈尔滨 150010
2. Institute of Advanced Technology,Heilongjiang Academy of Sciences,Harbin 150010
黏质沙雷氏菌(Serratia marcescens)亦称灵杆菌,是革兰氏阴性兼性厌氧杆菌,属于肠杆菌科克白雷氏菌族中的沙雷氏菌属。在培养过程中,能产生红色非扩散性色素-灵菌红素(Prodigiosin)和几丁质酶(Chitinase EC.3.2.14)[1],几丁质酶专一性水解几丁质中的β-1,4糖苷键,转化、产生菌体蛋白和氨基寡糖等产物,具有降解几丁质的功能。到目前为止,已在细菌、放线菌、真菌中检测到几丁质酶,并且应用在食品、医药、化妆和动物饲料等行业,在害虫防治中具有增效作用[2]。已有研究表明黏质沙雷氏菌是一类几丁质酶产生能力较强的细菌,是几丁质酶最好的来源之一。但由于几丁质酶的多样性,调控机理的复杂性,以及菌株产酶能力低下、发酵工艺不成熟等原因,真正应用于生产实际的并不多见。因此,获得其最佳产酶条件是微生物产几丁质酶研究的重要任务。
本研究是基于对本实验室自有菌株黏质沙雷氏菌S68诱变基础上,获得产酶量高的新菌株S68-CM5的后续研究,利用Plackett-Burman设计和响应面法对培养基和培养条件进行实验,对几丁质酶的最佳培养条件进行优化,旨为黏质沙雷氏菌液深层发酵和生产几丁质酶新型植物保护剂奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种黑龙江省科学院微生物研究所生物工程重点实验诱变黏质沙雷氏菌株S68-CM5。
1.1.2 培养基 1.1.2.1 斜面培养基葡萄糖5 g/L,牛肉膏1.5 g/L,蛋白胨5 g/L,酵母膏3 g/L,NaCl 3.5 g/L,K2HPO4 3.65 g/L,琼脂15 g/L,初始pH为7.0-7.5。
1.1.2.2 种子培养基葡萄糖5 g/L,牛肉膏1.5 g/L,蛋白胨5 g/L,酵母膏3 g/L,NaCl 3.5 g/L,K2HPO4 3.65 g/L,初始pH为7.0-7.5。
1.1.2.3 基础发酵培养基葡萄糖5 g/L,牛肉膏1.5 g/L,蛋白胨5 g/L,酵母膏3 g/L,NaCl 3.5 g/L,K2HPO4 3.65 g/L,1%质量百分比胶体几丁质以10%浓度加入培养基中,初始pH为7.0-7.5。
培养基灭菌条件均为湿热灭菌121℃,20 min。
1.2 方法 1.2.1 种子培养 1.2.1.1 种子活化将黏质沙雷氏菌种S68-CM5转接到斜面培养基上,30℃培养24 h。
1.2.1.2 种子培养挑一环斜面培养基上的菌株接种于5 mL试管种子培养基中,30℃培养 150 r/min培养16 h。
1.2.1.3 发酵培养将种子液以1%接种量接种于250 mL装三角瓶基础发酵培养基中,三角瓶装液量为50 mL,30℃培养150 r/min培养60 h。
1.2.2 酶活力测定将培养60 h的菌液离心(7 000 r/min,-4℃,30 min)取上清液,以35%浓度使用硫酸铵进行蛋白沉淀,24 h后离心(7 000 r/min,-4℃,30 min)留取上清液,再以75%浓度硫酸铵沉淀蛋白,24 h后离心(8 000 r/min,-4℃,30 min),取沉淀物使用半透膜(MW7000)用流动水除盐8 h;使用聚乙二醇6000浓缩至1 mL左右;取0.4 mL样品,0.4 mL蒸馏水空白对照,分别加入0.4 mL浓度为0.05 mol/L醋酸液,0.4 mL 1%胶体几丁质37℃水浴(2 h)降解几丁质成单糖;离心(4 000 r/min,4℃,10 min)取0.4 mL上清液加入40 µL质量百分比为1%蜗牛酶水浴(37℃,30 min),加入0.2 mL饱和硼砂缓冲;干式恒温器100℃,7 min,冷却再加入2 mL冰醋酸和1 mL浓度1% DMAB水浴(37℃,15 min)进行显色反应,585 nm测吸光度。根据N-乙酰-D-氨基葡萄糖(NAG)标准曲线计算酶活力[3]。酶活力单位(U)表示在上述反应条件下,每1 min时间内产生1 μmol NAG所需要的酶量。
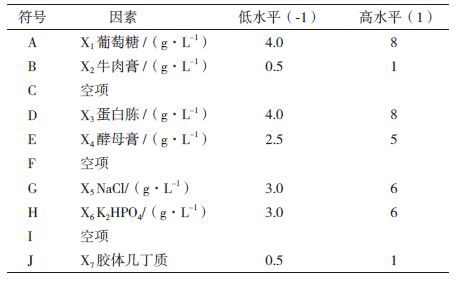
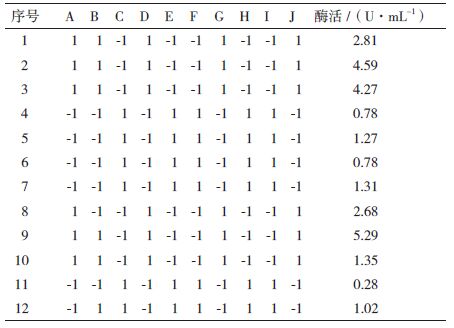
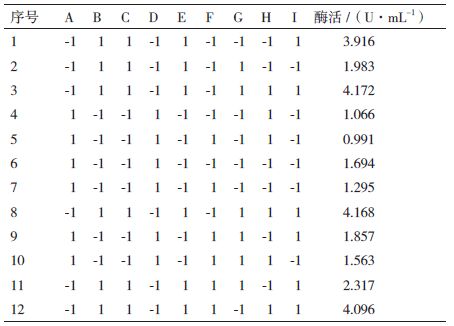
1.2.3 基础发酵培养基中的显著因子筛选 1.2.3.1 试验设计采用Plackett-Burman进行试验设计,筛选7个组分:葡萄糖(A)、牛肉膏(B)、蛋白胨(D)、酵母膏(E)、NaCl(G)、K2HPO4(H)和胶体几丁质(J),选用10因子2水平的试验设计,增加3个空白项C、F、I来估计试验误差,每个因子取高低2个水平,且高水平是低水平的2倍(表 1)。
通过对Plackett-Burman设计的试验结果进行分析,确定主要因子,根据回归方程各因子的系数来确定主要因子的爬坡路径和步长[4]。改变各主要因子在基础发酵培养基中的质量浓度,使其成梯度变化,检测各个梯度下菌株的酶活,快速确定最大响应值的区域。
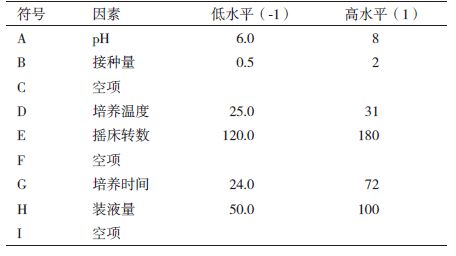
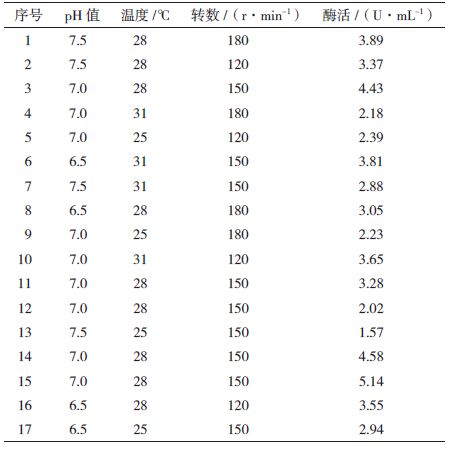
1.2.4 响应面方法对培养条件试验 1.2.4.1 培养条件各因素筛选采用Plackett-Burman进行试验设计,筛选的6个因素分别是pH值、接种量、培养温度、摇床转数、培养时间和装液量,选用10因子2水平的试验设计,增加3个空白项C、F、I来估计试验误差,每个因子取高低两个水平(表 2)。
确定影响SM68-CM5菌株产酶条件的3个主要因素,爬坡试验确定3个主要因子响应区域,采用Box-Behnken的中心组合设计原理在主要因子的响应区各取3个水平,设计3因素3水平的响应面分析试验。
1.2.5 数据分析每个处理包含3个平行试验,取值为3个平行试验的均值。Plackett-Burman设计采用Minitab 16软件完成,Box-Behnken设计的响应面分析由Design-Expert8.0.6.1完成。
2 结果 2.1 黏质沙雷氏菌S68-CM5产几丁质酶培养基组成的优化 2.1.1 Plackett-Burman设计筛选培养基碳氮源显著因子采用Plackett-Burman 设计对胶体几丁质、葡萄糖、牛肉膏、蛋白胨、酵母膏、NaCl和K2HPO4 7个因素每个组分取高水平(+1)和低水平(-1),各因子所代表的高低水平和方差分析结果,见表 3。
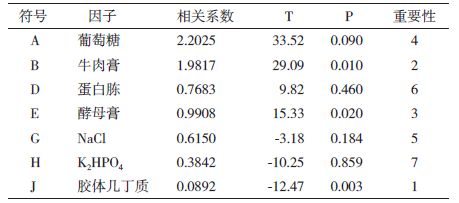
由表 4中P值的大小可以判定,培养基中各因子对S68-CM5菌株酶活影响,胶体几丁质P值为0.003,J>B>E>A>G>D>H,即胶体几丁质>牛肉膏>酵母膏>葡萄糖>氯化钠>蛋白胨>磷酸氢二钾。效应关系用方程式表示为:W=4.25+X1+0.87X3+2.4X4,方程R2=0.9021,表明该回归方程拟合良好。从方程中还可以看出,要提高菌体数量,应提高胶体几丁质、葡萄糖和牛肉膏添加量。
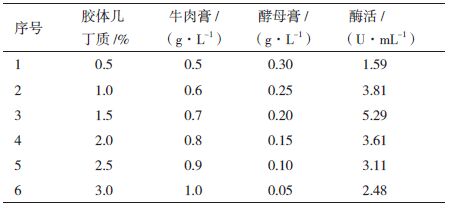
根据Plackett-Burman 试验设计法筛选出的主要组分的效应大小设计它们的步长,进行最陡爬坡试验设计,寻找产酶量最高的浓度。试验设计及结果如表 5所示,最佳菌体数量在试验号3附近。
确定了显著因子的最适浓度区域之后,即以1.5%胶体几丁质,牛肉膏7 g/L,酵母膏2 g/L,各因素代码和水平设计,见表 5。
2.2 黏质沙雷氏菌S68-CM5产几丁质酶培养条件优化 2.2.1 Plackett-Burman筛选显著因子采用Plackett-Burman设计对主要6个培养因素进行分析。每个因素取高水平(+1)和低水平(-1),各因子所代表的高低水平和方差分析结果,见表 6。
由表 7中P值的大小可以判定,培养条件各因子对S68-UM5菌株酶活影响,pH0.011,摇床转速 0.015,培养温度0.021,A>D>E>G>B>H,即pH>摇床转数>培养温度>培养时间>接种量>装液量。显然,pH、摇床转数和培养温度的影响较为突出。
Box-Behnken试验结果见表 8,确定了影响酶活最显著3个因子为pH值、温度和摇床转数。以pH7.0,温度28℃,摇床转数150 r/min为中心点,设计3因素3水平的响应面实验,每个处理设定3个重复试验,以酶活为响应值。
方差分析结果表明,该模型的一次项和二次项对酶活的影响均显著,而交互作用酶活的影响不显著,回归模型的P值0.037 2,表明模型是显著的,而失拟项的P值为0.159 1,失拟不显著;模型的决定系数R2=0.910 7,说明模型达到较好的拟合程序,经分析软件回归拟合得到该模型的回归方程:酶活=0.65-0.14A-0.24B+0.17C+7.500E-003AB-0.075AC+0.40BC-0.34A2-0.37B2-0.25C2。
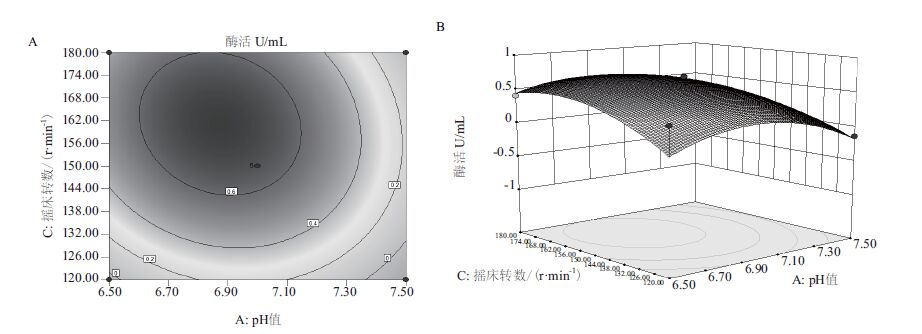
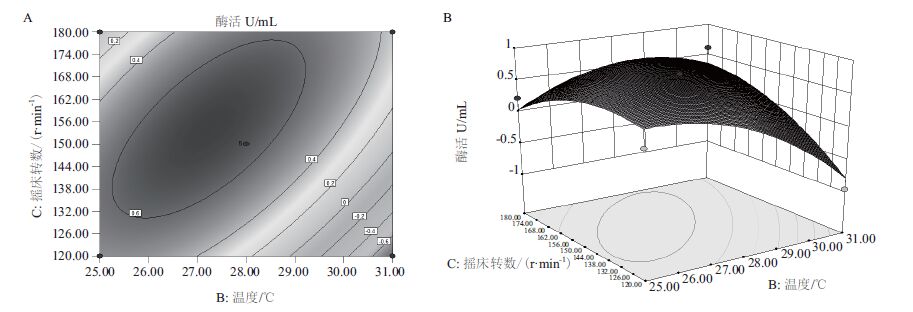
为解得该同回归方程的极值点,对其各自变量分别求一阶偏导,得到三元一次方程组,解出该模型的极值点,从而计算出对应因素的取值:pH6.88,温度27.32℃,摇床转数155.82 r/min,此时模型的理论最高酶活为7.092 U/mL。
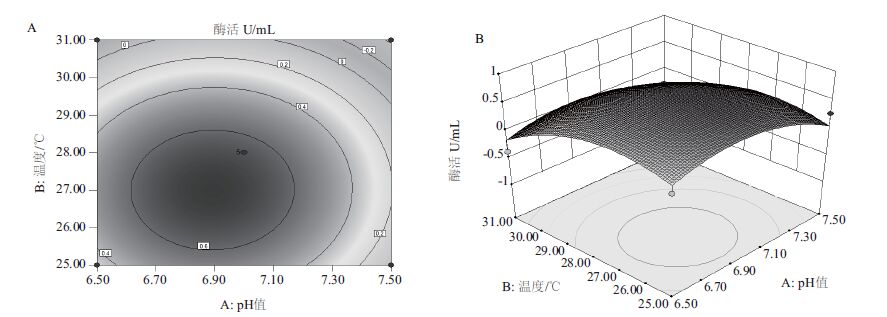
根据拟合回归方程采用Design-Expert8.0.6.1分析,绘出主要因素相应的等高线和响应面分析图(图 1-图 3)。每个响应面可反映出两个主要因素之间的相互作用,3个因素固定在最优值不变的情况下,随着另外2个因素的逐渐增加,酶活呈先增后减的趋势,而曲面的顶点即为酶活的最大值点[5]。
|
| 图 1 pH值和温度交互作用对酶活影响的等高线(A)和响应面(B) |
|
| 图 2 pH值和摇床转数交互作用对酶活影响的等高线(A)和响应面(B) |
|
| 图 3 温度和摇床转数交互作用对酶活影响的等高线(A)和响应面(B) |
根据分析(表 5和表 8)结果,鉴于实验室条件,实际设定值为:pH7,温度28℃,摇床转数155 r/min,培养时间60 h,接种量1%,装液量50 mL/250 mL。为了验证这一结果的有效性,按照上述分析结果进行重复试验,检测结果为7.131 U/mL,与预测值相近,说明该模型拟合的有效性。
3 讨论Plackett-Burman设计是一种以不完全平衡块(Balanced incomplete blocks)为原理的部分因子设计法[6, 7],具有试验次数少效率高的特点,Wu和陈宁等[8, 9]都利用PB设计通过12次试验,从10种成分中快速筛选出主要影响发酵产酸的成分。目前国内外许多研究都采用响应面设计法对不同微生物培养基进行优化,均获得较为理想的结果[10, 11]。
碳源是影响微生物发酵的最主要因素之一,本研究发现胶体几丁质是诱导S68-CM5产几丁质酶主要的碳源,这与大多数几丁质酶为诱导酶有关[12],几丁质浓度在1.5%时酶活5.29 U/mL,胶体几体质浓度高的情况下酶活反而下降,可能是由于几丁质浓度高,黏稠度低利于酶产生。葡萄糖作为碳源时不利于几丁质酶分泌,与王海东[13]研究的SWCH-6菌株及杨绍青[14]研究的一株高温紫链霉菌结果相似。常用氮源中牛肉膏和酵母膏对产酶有影响。
通过PB从7个因素筛选出3个影响产酶的主要因素,利用响应面分析法Box-Behnken设计确定显著因子最优配比:pH6.88,温度27.32℃,摇床转数155.82 r/min。几丁质酶最适催化pH范围较广,一般在3.0-11.0之间,大多数微生物几丁质酶最适催化在pH4.0-6.0的偏酸环境,在已有的研究中SWCH-6的最适pH值为5.0,本研究菌株S68-CM5的最佳pH值6.88,具有一般几丁质酶的特点。从产酶的历程看,S68-CM5从48 h开始分泌几丁质酶,在60 h时达到产酶高峰,与以往文献报道几丁质酶活力高峰一般出现在4-8 d相比[14, 15],产酶时间提前,提高了产酶效率。
目前,多种统计优化方法已被成功地运用于微生物培养基和培养条件优化工作中,本实验优化确定了诱变菌株S68-CM5培养基碳、氮源和最佳产酶条件,寻找合适的发酵工艺、探索使酶活稳定的方法,从而推动几丁质研究及相关产业的发展。下一步打算在此研究的基础上对S68-CM5菌株进行中试研究,利用20 L自控罐研究黏质沙雷氏菌诱变菌株S68-CM5发酵条件,探讨诱导底物、底物浓度及添加时间对产酶量的影响;优化几丁质酶的提取和纯化工艺,提高酶的收率。
4 结论得到黏质沙雷氏菌S68-CM5最佳产酶培养基:胶体几丁质1.5%,牛肉膏7 g/L,酵母膏2 g/L,葡萄糖8 g/L,氯化钠 3.5 g/L,蛋白胨2 g/L,磷酸氢二钾3.5 g/L;最佳产酶培养条件:pH6.88,温度27.32℃,摇床转数155.82 r/min,培养时间60 h,接种量1%,装液量50 mL/250 mL,优化后产酶量达到7.131 U/mL。
| [1] | 郑爱萍, 李平. 细菌几丁质酶研究进展. 中国生物工程杂志 , 2002, 22 (4) : 74–79. |
| [2] | Dahiva N. Biotechnological aspects of chitinolytic enzymes:a review. Appl Microbiol Biotechnol , 2006, 71 (6) : 773–782. DOI:10.1007/s00253-005-0183-7 |
| [3] | 胡基华, 陈静宇, 曹旭, 等. 高产几丁质酶的黏质沙雷氏菌株的诱变选育. 东北林业大学学报 , 2016, 44 (3) : 106–109. |
| [4] | 褚以文. 微生物培养基优化方法及其OPTI优化软件. 国外医药(抗生素分册) , 1999 (2) : 58–60. |
| [5] | 刘志祥, 曾超珍. 响应面法在发酵培养基优化中的应用. 北方园艺 , 2009 (2) : 127–129. |
| [6] | 张广臣, 雷虹, 何欣, 等. 微生物发酵培养基优化中的现代数学统计学方法. 食品与发酵工业 , 2010 (5) : 110–113. |
| [7] | 李勇昊, 周长海, 丁雷, 等. 发酵培养基优化策略. 北京联合大学学报:自然科学版 , 2011 (2) : 53–59. |
| [8] | Wu QL, Chen T, Gan Y, et al. Optimization of riboflavin production by recombinant Bacillus subtilis RH44 using statistical designs. App Microbiol Biotechnology , 2007, 76 (4) : 783–794. DOI:10.1007/s00253-007-1049-y |
| [9] | 陈宁, 常高峰, 张克旭. L-异亮氨酸发酵培养基的响应面法优化. 食品与发酵工业 , 2004, 30 (2) : 33–37. |
| [10] | 李志华. 基于PB试验和响应面分析法对谷氨酸棒杆菌CN1021发酵培养基优化. 中国酿造 , 2014, 2 : 23–27. |
| [12] | Muthu M, Lejla P, Vijayaraghavan K. Optimization of growth media for obtaining high-cell density cultures of halophilic archaca(family Halobacteriaceae)by response surface methodology. Journal of Biochemical Technology , 2009, 100 (12) : 3107–3112. |
| [13] | 王海东, 陈飚, 伦镜盛, 等. 产几丁质酶菌株SWCH-6的筛选、鉴定及其产酶条件的优化研究. 微生物学通报 , 2008, 35 (5) : 705–711. |
| [14] | 杨绍青, 张舒平, 闫巧娟. 高产几丁质酶高温紫链霉菌的筛选和发酵条件优化. 中国农业大学 , 2013, 18 : 167–173. |
| [15] | 尹璐, 祖国仁, 孙浩, 等. 一株海洋细菌产几丁质酶培养条件研究. 中国酿造 , 2010 (9) : 101–105. |