我国的磷矿资源丰富,但是绝大部分都是中低品位磷矿。面临磷矿资源逐渐贫化和短缺的危机,要实现磷化工产业的可持续发展,积极开展环境友好的中低品位磷矿资源利用无疑是必由之路[1]。然而,使用传统的矿物加工或化学方法来处理中低品位磷矿非常困难而且会造成环境污染。微生物溶磷技术由于具有反应温和、环境友好、能耗低、成本廉、流程短、操作简单等优点[2],为充分利用我国优质而廉价的磷矿资源开辟了一条新的途径。
高效的溶磷菌是决定中低品位磷矿的生物溶磷效果的关键。脂环酸芽孢杆菌(Alicyclobacillus)又称嗜酸耐热菌,营养类型为异养型或兼性异养型,广泛分布于热泉、火山口附近土壤等地热环境和矿山的酸性矿坑水、果园土壤、酸性果汁饮料等酸性环境中[3]。现在,对于Alicyclobacillus属细菌的研究工作主要围绕在食品科学领域。随着发现该属细菌不仅可以辅助其他浸矿菌浸出硫化矿,而且可作为主要的浸矿菌进行硫化矿和非硫化矿的浸出[3-5],Alicyclobacillus属细菌在生物冶金领域中的作用逐渐凸显出来,尤其是该属细菌嗜酸耐热且可利用多种有机碳源底物生成有机酸,因此,在非硫化矿的浸出方面的应用潜力不容小觑。但是,目前这方面的研究工作仍只处于起步阶段,相关的研究报道很少。
本研究从酸性矿坑水中分离鉴定一株兼性异养型脂环酸芽孢杆菌A1,首次将此菌株应用于中低品位磷矿的溶解,探寻适合此菌株溶解磷矿的培养基,初步分析此菌株溶解磷矿的机理,旨在筛选出针对中低品位磷矿的高效溶磷菌。
1 材料与方法 1.1 材料 1.1.1 酶和化学试剂TaKaRa LA TaqTM polymerase、pMD18-T载体连接试剂盒均为TaKaRa公司产品;DNA Marker、loading buffer、dNTP mixture、溶菌酶、蛋白酶K、RNaseA、大肠杆菌DH5α感受态细胞、DNA纯化试剂盒及质粒小提中量试剂盒为天根生化科技(北京)有限公司产品;引物合成和测序工作由武汉鼎国生物技术有限公司完成。
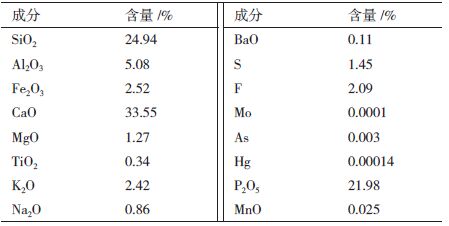
1.1.2 矿样实验用磷矿和黄铁矿均由西部矿业集团湖北宜昌磷矿提供。矿石经过粗破碎、细磨过筛后,取200目的粒度。磷矿石和黄铁矿的矿物组成分别见表 1和表 2。
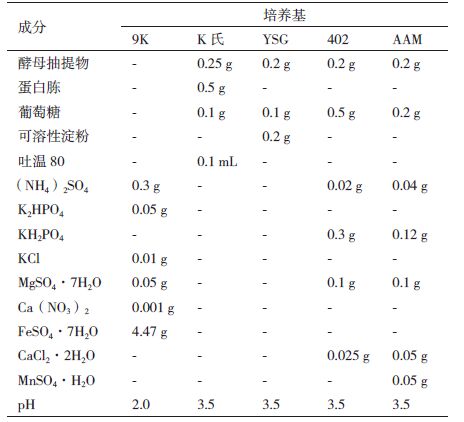
用于培养A1菌的9K培养基[6]、K氏培养基[3, 7, 8]、YSG培养基[3, 7, 8]、402培养基[7]及AAM培养基[9]成分见表 3。用于A1菌溶解磷矿的培养基为加入10.0 g/L的磷矿粉的YSG培养基、K氏培养基、AAM培养基或无KH2PO4的402培养基。
取湖北省宜昌磷矿的酸性矿坑水1.0 mL接种到含10.0 g/L黄铁矿和10.0 g/L磷矿的100 mL无磷无铁9K液体培养基中(即不加入K2HPO4及FeSO4·7H2O的9K培养基),30℃培养,接着每隔2周按10%的接种量转接培养液到黄铁矿和磷矿的量逐渐加大的(依次为15.0、20.0、25.0、30.0和35.0 g/L)无磷无铁9K液体培养基中进行驯化。取最后驯化的菌液1.0 mL接种于100 mL异养型9K液体培养基(即添加0.02%酵母抽提物的9K培养基)[10],反复培养几代后,涂布于异养型9K固体培养基上,待培养2-3 d后划线纯化,直至在显微镜下看到的细菌形态大小基本一致,最终得到纯菌株,命名为A1。
1.2.2 菌种鉴定菌株的个体形态观察:革兰氏染色及芽孢染色参照袁亚宏[11]等方法。菌株的生理生化特征:各项生理生化指标的测定参考Guo等[12]进行操作。菌株的生长条件分析:为了研究温度和培养基的pH对菌株生长的影响,培养在AAM培养基中的对数期菌株A1以10%的接种量接种到一组液体AAM培养基(pH3.5)中,分别置于20、25、30、35、40和45℃下培养24 h,检测培养液的OD600值。另外,分别配制一组液体AAM培养基,其中pH值分别为1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、6.0、7.0和8.0,再以10%的接种量转接培养在AAM培养基中的对数期菌株A1于上述培养基中,置于30℃下培养24 h,观测培养液的OD600值。16S rDNA的扩增测序和系统发育树的构建:菌株A1的基因组DNA提取参照李凌凌等[13]方法。以菌株A1的基因组DNA为模板,利用正向引物Pf:5'-GAGAGTTTGATCCTGGCTCAG-3'和反向引物Pr:5'-AAGGAGGTGATCCAGCC-3'(这两个引物分别对应于大肠杆菌的16S rDNA的7-27位和1525-1542位碱基),来进行PCR扩增。PCR反应体系为:菌体A1的基因组DNA 2 μL,10×Taq DNA聚合酶缓冲液5 μL,引物Pf(2.5 μmmol/L)10 μL,引物Pr(2.5 μmmol/L)10 μL,4×dNTP混合物(2.5 mmol/L)5 μL,Taq聚合酶(2 U/μL)0.5 μL,无菌水补至50 μL。A1菌的16S rDNA的PCR扩增条件为:95℃预变性5 min;95℃变性1 min,55℃退火1 min,72℃延伸90 s,30个循环;72℃延伸10 min[14]。根据pMD18-T载体连接试剂盒说明书,将A1菌的16S rDNA的PCR扩增产物连接到pMD18-T载体上,构建重组载体pMD18-A1,由武汉鼎国生物技术有限公司完成该质粒上的16S rDNA的测序。根据A1菌及其相近种属的16S rDNA基因序列,采用Mega 6软件构建系统发育树,进行系统发育分析[14]。
1.2.3 中低品位磷矿的微生物浸出以10%的接种量接种对数期的菌株A1到100 mL的4种浸矿培养基(250 mL锥形瓶)中,置于30℃、150 r/min的恒温摇床中振荡。空白对照为接种10%的无菌水的浸矿培养基,以分析浸矿培养基的化学浸出作用。每4 d取1 mL浸出液,采用磷钼黄比色法测定其中可溶性磷的含量,由此计算磷的浸出率[14],取样损失的浸出液用相同体积的浸矿培养基补充,并采用称重法定期补充挥发水分,实验重复3次,取平均值。浸矿实验完成后,过滤浸出液,从中收集磷矿矿渣,用无菌水洗涤矿渣2-3次并烘干,再分别利用X射线衍射仪(Philips X' Pert Pro MPD)、元素分析仪(Elementar Vario EL Ⅲ)、扫描式电子显微镜(Philips Nova400NanoSEM)及能谱仪(Bruker Nano xFlash Detector 410-M)分析矿渣的物相、化学组成和表面形貌。另外,上述浸出液经离心收集的上清液(10 000 r/min,离心15 min),利用高效液相色谱仪(安捷伦1100)分析其中的有机酸成分,采用的色谱柱是SB-C18反相柱(4.6×150 mm,填料为粒径5 μm的烷基化硅胶)。操作条件为:柱温30℃,检测波长215 nm,进样体积5 μL,流速0.5 mL/min,流动相为3%甲醇-0.01 moL/L K2HPO4(用磷酸调节pH至2.86)。
2 结果 2.1 菌株A1的鉴定 2.1.1 菌株A1的个体形态特征在光学显微镜下,菌株A1呈杆状,可游动、旋转,革兰氏染色呈阳性,芽孢染色为绿色,呈阳性。在扫描电镜下,菌体呈长杆状,大小约为(2.0-6.0)μm×(0.8-1.0)μm,如图 1所示。

|
| 图 1 菌株A1的电镜照片(10 000×) |
A1菌在K氏琼脂培养基上培养2 d后,形成直径为0.5-1.0 mm的圆形的黄褐色菌落,中心凸起,边缘规则,光滑,湿润且与培养基结合较为紧密。而A1菌在AAM固体培养基上培养2 d后形成的菌落为:直径为1.0-2.0 mm的圆形、不透明、乳白色、扁平、边缘呈规则圆形、光滑、湿润且易于挑取。A1菌在AAM半固体培养基的穿刺试验结果显示,菌体仅在培养基表面生长,且在穿刺部位的四周呈云雾状生长,由此可知A1菌专性好氧,可运动。
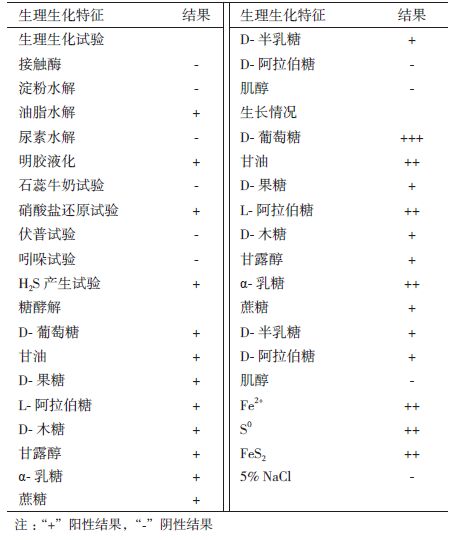
2.1.3 菌株A1的生理生化特征如表 4所示,菌株A1的接触酶为阴性。菌株A1能产生胞外的脂肪酶、明胶酶,但不能产生胞外的淀粉酶及尿素酶,不能水解酪素。A1菌可以还原硝酸盐生成亚硝酸盐,可以水解培养基中的含硫氨基酸(胱氨酸、甲硫氨酸或半胱氨酸)生成H2S,但是不能发酵葡萄糖生成乙酰甲基甲醇,也不能产生色氨酸酶分解色氨酸为吲哚。除了不能利用肌醇外,菌株A1能够利用葡萄糖、甘油、甘露醇、蔗糖、D-果糖、D-半乳糖、乳糖、D/L-阿拉伯糖、D-木糖等有机物作为唯一碳源进行异养生长,而且除D-阿拉伯糖、肌醇之外,菌株A1还可以发酵葡萄糖、甘油、甘露醇、蔗糖、D-果糖、D-半乳糖、乳糖、L-阿拉伯糖及D-木糖产酸。另外,A1菌还可以氧化亚铁、硫粉或黄铁矿进行自养生长,说明A1菌是一种兼性异养菌。在添加了5% NaCl的AAM培养基上,可观察到A1菌的生长明显受到了抑制。
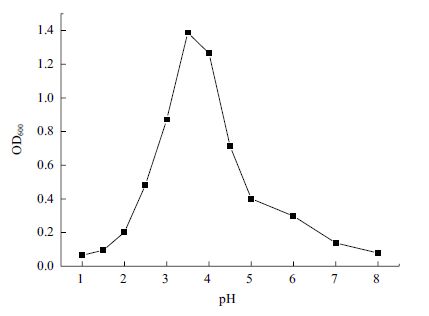
当菌株A1培养在AAM液体培养基中时,在25-40℃的温度范围内都可以较好地生长,其中在30℃下生长得最好(图 2),在低于25℃,高于40℃的条件下,光学显微镜下未观察到菌体A1生长的迹象。菌体A1在pH值为2.0-6.0的AAM液体培养基中均可生长,最适生长的pH值为3.5(图 3),当pH<2.0和pH>6.0时,菌体A1未见生长。

|
| 图 2 温度对菌株A1生长的影响 |
|
| 图 3 pH对菌株A1生长的影响 |
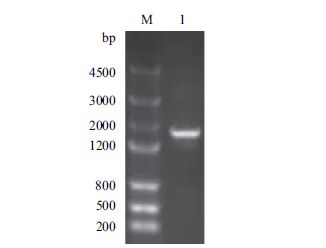
以菌株A1提取出的基因组DNA为模板,进行16S rDNA的PCR扩增,获得的PCR产物进行1.0%的琼脂糖凝胶电泳,结果(图 4)显示,PCR产物位于1 200-2 000 bp之间,此点与目标序列长度约1 500 bp相符。将PCR扩增产物切胶回收后,连接到pMD18-T质粒上,构建重组载体pMD18-A1。将重组载体送交武汉鼎国生物技术有限公司进行测序,获得一段长1 622 bp的核苷酸序列,利用NCBI数据库中的VecScreen功能去除测序结果中的载体序列后,得到长度为1 522 bp的菌株A1的16S rDNA序列,将此序列提交到EMBL bank中,获登录号为LT158297。利用NCBI数据库提供的BlastN功能进行核苷酸比对,结果(图 5)显示菌株A1与铜矿脂环酸芽孢杆菌(Alicycloba-cillus aeris)的亲缘关系最接近,菌株A1的16S rDNA基因与A. aeris ZJ-6和NBRC104953的一致性都达到99%。根据16S rDNA序列的相似性,利用Clustal Omega和Mega 6软件构建系统发育树,可见菌株A1在系统发育上也最接近于A. aeris,相似性为99%。
|
| 图 4 A1菌16S rDNA基因的PCR琼脂糖凝胶电泳图 |

|
| 图 5 根据16S rDNA序列同源性构建的系统发育树 利用Mega 6计算得出的进化距离,Method:Neighbor-joining距离矩阵;Model:Maximum Composite Likelihood;Bootstrap:500 replicates |
综合上述的形态学特性、生理生化特征和分子遗传学结果,得出:从湖北宜昌磷矿的酸性矿坑水中分离得到的A1菌为可以产生芽孢的可游动的专性好氧的长杆状革兰氏阳性菌,能够利用多种有机碳源并产酸,也可以氧化无机物Fe2+、S0、FeS2生长,营养类型为兼性异养型。该菌适宜生长的温度为25-40℃,最适温度为30℃,适于生长的pH值范围为2.0-6.0,最适pH值为3.5。16S rDNA序列的分子遗传学分析结果显示A1菌与铜矿脂环酸芽孢杆菌(A. aeris)的相似性达到99%。根据菌株A1的形态特征、生理生化特性和16S rDNA系统发育分析结果,推断菌株A1属于A. aeris,命名为A. aeris A1。
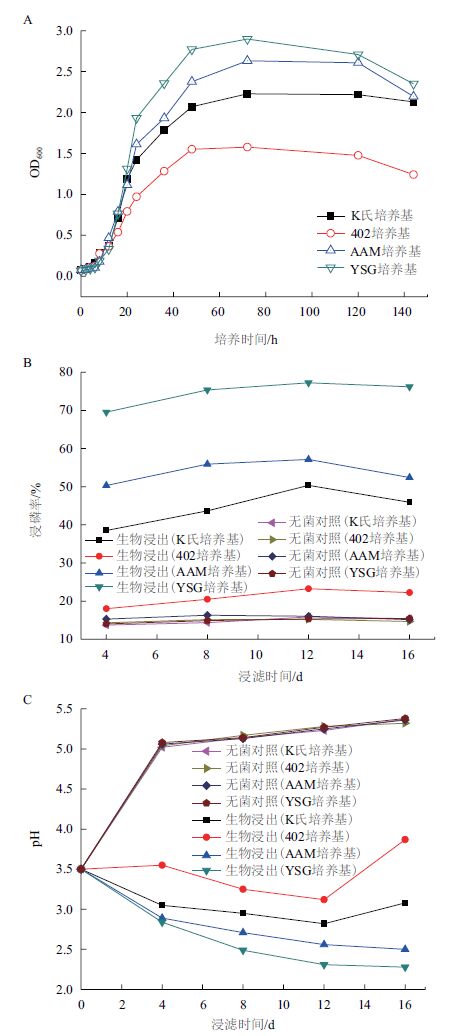
2.2 A1菌在不同培养基中的生长及溶磷情况将生长在AAM液体培养基中处于对数期的菌株A1接种至4种pH为3.5的培养基(YSG、K氏、AAM及402培养基),在30℃下培养,每隔一段时间检测培养液的OD600。以培养时间为横坐标,OD600为纵坐标,绘制菌株A1在这4种培养基中的生长曲线,如图 6-A所示,菌株A1在这4种培养基中,都经过12 h的延滞期后进入到对数期,在48 h进入到稳定期,大约到72 h,生长达到最高峰。另外,比较A1菌在4种培养基中可以达到的最大菌体浓度的大小,排序结果为:YSG培养基>AAM培养基>K氏培养基>402培养基。
|
| 图 6 A1菌在不同培养基中的生长及溶磷情况 A:生长曲线;B:浸磷率的变化曲线;C:pH 变化曲线 |
图 6-B显示了菌株A1在4种pH为3.5的培养基(YSG、K氏、AAM及402培养基)中溶解中低品位磷矿时磷的浸出率的变化趋势。从图中可见,菌株A1在4种培养基中可以达到最高的磷的浸出率有排序为:YSG培养基>AAM培养基>K氏培养基>402培养基。其中,菌株A1在YSG培养基中溶解中低品位磷矿12 d后,磷的浸出率可以高达77.22%。然而,A1菌在402培养基中的浸磷率却很低,浸出12 d的浸出率仅为23.27%。另外,对比生物浸出和化学浸出的浸磷率,可见无菌对照的浸出率很低,经过12 d的浸出仅仅约为15%,生物浸出的浸磷率要比无菌对照高得多,说明中低品位磷矿的溶解绝不仅仅是一个化学过程,其中菌体的活动在整个溶解过程中起到了决定性的作用。
从浸矿液的pH值随着溶解过程的变化趋势(图 6-C)可以看出,A1 菌在不同培养基中溶解磷矿形成的浸矿液pH值的排序为:YSG培养基<AAM培养基<K氏培养基<402培养基。结合图 6-B分析可知,磷的浸出率与浸矿液的pH值呈负相关关系。例如,磷的浸出率较高的YSG培养基和AAM培养基,其pH值较低;磷的浸出率较低的402培养基,其pH值相对较高,说明pH值越低的培养基的溶磷效果越好,也就是说磷矿的溶解依赖于浸出体系中的质子浓度,是一个耗酸的过程。
另外,通过血细胞计数板测量A1菌在不同培养基中溶解4 d的浸矿液中的细胞浓度并比较大小,结果如下:YSG培养基(5.67×108个/mL)> AAM培养基(1.14×108个/mL)>K氏培养基(7.52×107个/mL)>402培养基(3.09×106个/mL),由此可知:磷的浸出率与A1菌在培养液中的细胞浓度呈正相关性,这是因为在菌体生长较好的培养基中,菌体发酵有机物产生的有机酸浓度相应较高,观测到的pH值较低,由于磷矿的溶解是一个消耗质子的过程,浸出液的pH决定了磷矿中磷的浸出率,因此,菌体浓度越大的培养基中浸磷率较高。
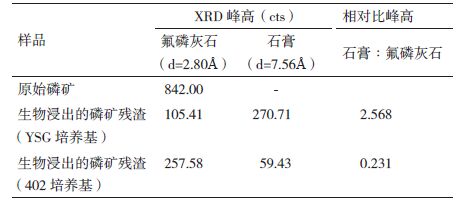
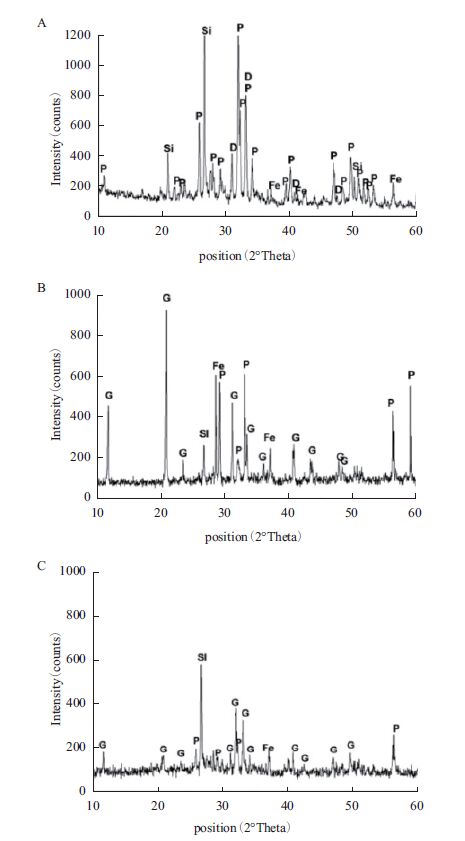
2.3 A1菌溶解中低品位磷矿的机理 2.3.1 A1菌溶解磷矿的残渣分析通过比较标准(International Center for Diffraction Data Powder Diffrac-tion files,简称ICDD)文件15-0876[氟磷灰石,Ca5(PO4)3F]、21-0141[碳氟磷灰石,Ca10(PO4)5CO3F1.5(OH0.5)]、11-0078[白云石,CaMg(CO3)5]、01-0649(石英,SiO2)、24-0076(黄铁矿,FeS2)和磷矿的XRD 图谱(图 7-A)发现,原始的磷矿主要由氟磷灰石和碳氟磷灰石组成,其中还含有白云石、石英和黄铁矿等矿物。这点与王树林等[15]所述“宜昌磷矿的主要工业矿物为隐晶质胶磷矿、脉石矿物主要为碳酸盐类矿物、石英、粘土类矿物和铁-碳质矿矿物等”相一致。观察在YSG培养基和402培养基中菌株A1溶解的磷矿滤渣样品的XRD检测图(图 7-B和C)发现,与原始磷矿的XRD分析图不同,生物浸出的矿渣的XRD图中出现了一些新的衍射峰,其既不同于氟磷灰石、碳氟磷灰石,也不同于白云石、石英和黄铁矿。根据ICDD文件06-0047,这些衍射峰是石膏(CaSO4·2H2O),也就是说在菌株A1溶解磷矿的过程中有石膏晶体生成,这点也被SEM-EDS分析证实:A1菌在YSG培养基中溶解磷矿的残渣中存在一些交联度很低的棱镜状的晶体,该晶体的主要组成元素为Ca、S和O,其中Ca/S比约为1.0(图 8-B3和B4)。经过扫描电镜下的观察,发现A1菌在402培养基溶解的矿渣中,没有明显针状或棱镜状的石膏晶体。此矿渣的XRD分析图中石膏晶体的峰也相对较弱。利用这些矿渣的XRD分析图谱中石膏与氟磷灰石的比峰高来表示矿渣中的石膏的相对丰度[16],如表 5所示,可见菌体A1 在YSG培养基中溶解磷矿时形成的石膏的比峰高要远高于402培养基。
|
| 图 7 原始磷矿和生物浸出的磷矿残渣的XRD检测图 A:原始磷矿;B:生物浸出的磷矿残渣(YSG 培养基);C:生物浸出的磷矿残渣(402培养基)。G:石膏(gypsum);P:氟磷灰石(fluorapatite);Fe:黄铁矿(Pyrite);Si:石英(quartz) |
另外,EDS分析原始磷矿和经A1菌溶解的磷矿矿渣中的磷灰石成分的结果显示:生物浸出后的磷矿渣中的Ca/P比原始磷矿提高了,而且YSG培养基中生物浸出的残渣的Ca/P要比402培养基中的要高(图 8-A2、B2和C2)。根据矿渣的元素分析结果,磷矿经A1菌的溶解后,P元素含量(9.6%)有所下降,其中YSG培养基中生物浸出的残渣中的P元素含量(2.765%)比402培养基中(7.134%)低得多,也进一步说明:与YSG培养基相比,菌体A1在402培养基中溶解中低品位磷矿的效果要差。

|
| 图 8 原始磷矿和生物浸出的磷矿残渣的SEM-EDS分析图 A1:原始磷矿的SEM图;A2:原始磷矿的EDS 分析结果;B1:生物浸出的磷矿残渣中的氟磷灰石成分的SEM检测图(YSG 培养基);B2:生物浸出的磷矿残渣中的氟磷灰石成分的EDS 分析结果(YSG 培养基);B3:生物浸出的磷矿残渣中的石膏成分的SEM检测图(YSG 培养基);B4. 生物浸出的磷矿残渣中的石膏成分的EDS 分析结果(YSG 培养基);C1:生物浸出的磷矿残渣中的氟磷灰石成分的SEM检测图(402培养基);C2:生物浸出的磷矿残渣中的氟磷灰石成分的EDS 分析结果(402培养基) |
微生物的溶磷作用被普遍认为主要是由于微生物的生长过程中分泌的有机酸不仅能够将磷酸三钙、磷酸铝、磷酸铁等难溶性磷酸盐溶解,而且有机酸中的羟基、羧基能够对难溶性磷酸盐中的金属离子进行螯合而释放出磷酸根离子[17]。因此,分析A1菌的浸出液中的有机酸成分,有利于理解该菌溶解磷矿的机理。图 9显示,A1菌在YSG培养基中溶解磷矿的浸出液中含有5种有机酸,分别为草酸、酒石酸、苹果酸、乙酸和柠檬酸。然而,A1菌在402培养基中浸矿形成的浸出液仅有4种有机酸,未检出柠檬酸。将系列浓度梯度的有机酸标准溶液进样后,绘制出液相色谱峰面积与各种有机酸浓度的线性标准曲线,据此计算出两种浸矿液中各种有机酸的浓度(表 6),可知YSG培养基浸出液中的有机酸以草酸和柠檬酸为主,其中浓度最高的为柠檬酸(122.68 mg/L)。对比YSG和402培养基的浸出液中的有机酸含量,YSG培养基的浸出液中所有的有机酸浓度都远高于402培养基的浸出液,这点解释了A1菌在这两种培养基中磷的浸出率存在较大的差异的原因,说明中低品位磷矿的生物浸出是一个依赖于酸的溶解过程。
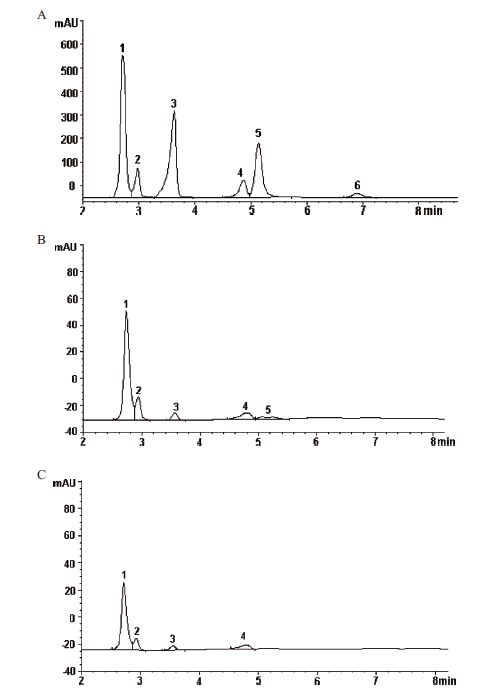
|
| 图 9 有机酸标准品和A1菌的浸矿液的高效液相色谱图 A:有机酸的标准品;B:A1菌的浸矿液(YSG 培养基);C:A1菌的浸矿液(402 培养基);1:草酸;2:酒石酸;3:苹果酸;4:乙酸;5:柠檬酸;6:琥珀酸 |
综合A1菌在YSG培养基中溶解的矿渣的物相分析和相应浸矿液的高效液相色谱检测结果,推测菌株A1溶解中低品位磷矿生成石膏的过程为[18-20]:
(1)菌株A1发酵有机物(如葡萄糖、酵母抽提物或可溶性淀粉等),代谢产酸,其中以草酸和柠檬酸为主。
(2)磷矿石中的磷酸盐矿物(氟磷灰石和碳氟磷灰石)被酸溶解生成可溶性磷H2PO4-和Ca2+(公式1和2),另外,磷矿中的脉石矿物白云石也被酸溶解产生Ca2+(公式3)。
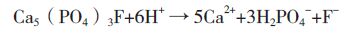 (公式1)
(公式1)
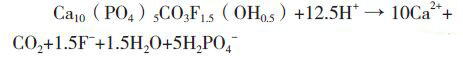 (公式2)
(公式2)
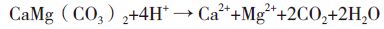 (公式3)
(公式3)
(3)溶出的Ca2+与浸出液中的硫酸盐反应生成石膏,如公式4所示。
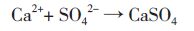 (公式4)
(公式4)
脂环酸芽孢杆菌(Alicyclobacillus)又称嗜酸耐热菌,具有广泛的底物利用特性,营养类型为异养型或兼性异养型,广泛分布于热泉、火山口附近土壤等地热环境和矿山的酸性矿坑水、果园土壤、酸性果汁饮料等酸性环境中。由于Alicyclobacillus属中的一些细菌(如酸土芽孢杆菌)会引起果汁的腐败,且采用传统的巴氏杀菌难以将其彻底去除。因此,目前对于该菌的研究主要集中于食品科学领域。但是,近年来,随着很多学者发现该菌可以氧化Fe2+、元素硫以及硫化矿,它在生物冶金中的潜力被不断挖掘出来:(1)Alicyclobacillus属细菌可以用于硫化矿的浸出,如:2008年,Yahya等[5]发现Alicyclobacillus GSM菌处理2%的黄铁矿24 d后,浸出的铁浓度可以达到5 g/L。(2)Alicyclobacillus属细菌还可以协同其他浸矿菌浸出硫化矿,如:2008年,吴学玲等[4]报道从云南腾冲酸性热泉中分离获得的Alicyclobacillus TC-2菌本身对黄铜矿没有浸矿能力,但是能够对Acidianus manzaensis、Sulfolobus metallicus和Metallosphaera sedula等高温浸矿菌浸出黄铜矿有显著的促进作用。(3)Alicyclobacillus属细菌还可以作为主要的浸矿菌进行非硫化矿的浸出。如:张小霞等[3]利用Alicyclobacillus BM菌以黄铁矿为能源物质浸出软锰矿1 d后,锰和镍的浸出率可以分别达到97.7%和95.8%。尽管很多学者意识到Alicyclobacillus属细菌的研究工作对于构建高效协同的浸矿菌群、提高浸矿效率等有着极其深远的意义,但是该菌在硫化矿及非硫化矿上的浸出研究现在仍处于初步阶段,尤其是目前国内外未见脂环酸芽孢杆菌溶解磷矿的研究报道。Alicyclobacillus属细菌具有嗜酸耐热的特性,能够利用多种有机碳源底物生成有机酸,利用Alicyclobacillus属细菌进行中低品位磷矿的浸出具有不容忽视的应用潜力。
本研究从湖北宜昌磷矿的酸性矿坑水中分离获得了一株铜矿脂环酸芽孢杆菌A1(Alicyclobacillus aeris)。脂环酸芽孢杆菌属(Alicyclobacillus)于1922年建立,至今共有21种[21]。A. aeris这一种脂环酸芽孢杆菌在2009年由Guo等[12]首次分离获得,目前,还未见其他关于这类细菌的分离鉴定的报道。A1菌与Guo等获得的ZJ-6菌在最适生长温度、最适pH、接触酶、Vp反应、吲哚产生、明胶液化、淀粉水解、硝酸盐还原、糖酵解、碳源利用、以硫粉与亚铁为能源自养生长等生理生化特征上是基本一致的,但是A1菌也有自己独特的生理生化特征,例如,能够以黄铁矿为能源进行自养生长等,这种特质显示了该菌具有以黄铁矿为能源进行非硫化矿浸出的应用潜质。
本研究将A. aeris A1菌首次应用于中低品位磷矿的溶解,并对比了4种培养基中菌体的生长及浸矿情况,发现培养基的pH和浸磷率有着显著的负相关性,另外,菌体数量与浸磷率之间存在正相关性。银婷婷[17]、赵小蓉[22]、Chen[23]的研究也证明pH和菌数在溶磷过程中发挥着重要的作用。根据磷矿溶解的残渣及浸矿液的组成分析,本研究提出了A1菌溶解磷矿的过程为:A1菌能够代谢培养基中的有机碳源(如葡萄糖、酵母抽提物或可溶性淀粉等)产生有机酸(以草酸和柠檬酸为主)。接着,磷矿石中的磷酸盐矿物(氟磷灰石和碳氟磷灰石)被有机酸溶解生成可溶性磷H2PO4-和Ca2+,另外,磷矿中的脉石矿物白云石也能被有机酸溶解产生Ca2+,最后,溶出的Ca2+会与浸出液中的硫酸盐反应生成石膏[18],说明磷矿的溶解是一个依赖于浸出体系中的质子浓度的耗酸过程,而质子浓度与菌体的代谢活动密切相关,这点解释了浸矿体系的酸度和菌体数量在磷矿的生物浸出过程中发挥着重要的作用。
4 结论本研究从湖北宜昌磷矿的酸性矿坑水中分离出一株兼性嗜酸异养菌A1。根据形态学特征、生理生化特性和16S rDNA序列分析结果显示A1菌归属于铜矿脂环酸芽孢杆菌(Alicyclobacillus aeris)。本研究首次将分离获得的A. aeris A1菌应用于中低品位磷矿的浸出,从4种培养基中选择出最适合菌体生长及浸矿的YSG培养基,发现在YSG培养基中,该菌对中低品位磷矿有着较强的溶解能力,浸磷率最高达到了77.22%,比起无菌对照的化学浸出,提高了约62%。初步探索了此菌浸出磷矿的机理,根据浸出磷矿后的残渣及浸矿液的组成分析,提出了A1菌溶解磷矿生成石膏的化学过程。
| [1] | 樊蕾, 方晓峰. 我国中低品位磷矿利用技术现状及前景展望. 化学矿物及加工 , 2015, 8 : 42–46. |
| [2] | 张琛, 郑红艾, 周笑绿, 等. 生物浸出技术的发展及其电化学研究现状. 金属矿山 , 2014, 12 : 122–128. |
| [3] | 孟春瑜, 刘文彦, 刘兴宇, 等. Alicyclobacillus属细菌及其在生物冶金中的研究进展. 矿冶 , 2015, 24 (4) : 43–48. |
| [4] | 吴学玲, 朱若林, 丁建南, 等. 嗜酸热异养菌TC-2的分离鉴定及其对微生物浸矿的影响. 中国有色金属学报 , 2008, 18 (12) : 2259–2264. |
| [5] | Yahya A, Hallberg KB, Johnson DB. Iron and carbon metabolism by a mineral-oxidizing Alicyclobacillus-like bacterium. Archives of Microbiology , 2008, 189 (4) : 305–312. DOI:10.1007/s00203-007-0319-5 |
| [6] | Wu X, Zhang Z, Liu L, et al. Metal resistance-related genes are differently expressed in response to copper and zinc ion in six Acidithiobacillus ferrooxidans strains. Current Microbiology , 2014, 69 (6) : 775–784. DOI:10.1007/s00284-014-0652-2 |
| [7] | 朱小翠, 樊明涛. 陕西省苹果汁中脂环酸芽孢杆菌的分离与鉴定. 西北农林科技大学学报:自然科学版 , 2008, 36 (6) : 189–194. |
| [8] | 白淼, 张灿, 郑文杰, 等. 脂环酸芽孢杆菌的分离鉴定与控制技术研究进展. 环境与健康杂志 , 2015, 32 (7) : 650–654. |
| [9] | 胡贻椿, 岳田利, 袁亚宏, 等. 浓缩苹果汁车间空气中嗜酸耐热菌的分离鉴定研究. 农产品加工(学刊) , 2007, 3 : 11–13. |
| [10] | Joe SJ, Suto K, Inoie C, et al. Isolation and characterization of acidophilic heterotrophic iron-oxidizing bacterium from enrichment culture obtained from acid mine drainage treatment plant. J Biosci Bioeng , 2007, 104 (2) : 117–123. DOI:10.1263/jbb.104.117 |
| [11] | 袁亚宏, 刘晓珂, 岳田利, 等. 一株源于果园Alicyclobacillus的分离、鉴定及其生物学特性. 食品科学 , 2012, 33 (17) : 129–135. |
| [12] | Guo X, You XY, Liu LJ, et al. Alicyclobacillusaerissp. nov. a novel ferrous- and sulfur-oxidizing bacterium isolated from a copper mine. International Journal of Systematic and Evolutionary Microbiology , 2009, 59 (Pt10) : 2415–2420. |
| [13] | 李凌凌, 吕早生, 吴敏, 等. 重组的葡萄糖脱氢酶催化辅酶的再生性质. 华中科技大学学报:自然科学版 , 2010, 38 (3) : 112–115. |
| [14] | Li L, Lv Z, Yuan X, et al. Effect of L-glycine on bioleaching of collophanite by Acidithiobacillus ferrooxidans. International Biodeterioration & Biodegradation , 2013, 85 (7) : 156–165. |
| [15] | 王树林, 黄志良, 罗欣, 等. 宜昌磷矿工艺矿相学研究. 武汉工程大学学报 , 2012, 34 (2) : 55–59. |
| [16] | Tuovinen OH, Bhatti TM, Bigham JM, et al. Oxidative dissolution of arsenopyrite by mesophilic and moderately thermophilic acidophiles. Appl Environ Microbiol , 1994, 60 (9) : 3268–3274. |
| [17] | 银婷婷, 王敬敬, 柳影, 等. 高效解磷菌的筛选及其促生机制的初步研究. 生物技术通报 , 2015, 31 (12) : 234–242. |
| [18] | Bhatti TM, Yawar W. Bacterial solubilization of phosphorus from phosphate rock containing sulfur-mud. Hydrometallurgy , 2010, 103 (1-4) : 54–59. DOI:10.1016/j.hydromet.2010.02.019 |
| [19] | Dorozhkin SV. Dissolutionmechanism ofcalciumapatitesin acids:Areviewof literature. World Journal of Methodology , 2012, 2 (1) : 1–17. DOI:10.5662/wjm.v2.i1.1 |
| [20] | Delvasto P, Valverde A, Ballester A, et al. Characterization of brushite as a recrystallization product formed during bacterial solubilization of hydroxyapatite in batch cultures. Soil Biology & Biochemistry , 2006, 38 : 2645–2654. |
| [21] | 刘波, 王阶平, 陶天申, 等. 芽孢杆菌属及其近缘属种名目录. 福建农业学报 , 2015, 30 (1) : 38–59. |
| [22] | 赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系. 微生物学杂志 , 2003, 23 (3) : 5–7. |
| [23] | Chen Z, Ma S, Liu LL. Studies on phosphorous solubilizing activity of a strain of phosphobacteria isolated from chestnut type oil in China. Bioresource Technol , 2008, 99 (14) : 6702–6707. DOI:10.1016/j.biortech.2007.03.064 |