2. 江西省科学院鄱阳湖重点实验室,南昌330029;
3. 鲁东大学生命科学学院,烟台 264025;
4. 江西省农业科学院农业应用微生物研究所,南昌 330200
2. Key laboratory of Poyang Lake,Jiangxi Academy of Sciences,Nanchang 330029;
3. College of Life Science,Ludong University,Yantai 264025;
4. Institute of Agricultural Applied Microbiology,Jiangxi Agricultural Academy of Sciences,Nanchang 330200
质型多角体病毒(Cytoplasmic polyhedrosis virus)属于呼肠孤病毒科质型多角体病毒属。根据第九次国际病毒分类会议制定质型多角体病毒的分类[1],马尾松毛虫质型多角体病毒(Dendrolimus punctatus cytoplasmic polyhedrosis virus,DpCPV)归为CPV-Ⅰ型,基因组由10条分段的dsRNA组成。松毛虫是我国森林虫害的主要害虫,DpCPV为我国重大森林害虫--松毛虫的致病原,对松毛虫具有良好的控制效果,在我国已经登记为商品杀虫剂[2]。DpCPV 主要感染昆虫中肠上皮细胞,感染周期较长,但宿主范围一般较宽,可以使10科36种鳞翅目昆虫感染发病[3]。采用冰冻电镜和计算机三维重构技术研究表明,CPV的蛋白质外壳为单层衣壳,主要有3段序列编码的结构蛋白组成,分别是由S1片段编码的衣壳蛋白CSP(Capsid shell protein)、S4片段编码的塔式突起蛋白TP(Turret protein)及S7片段编码的大突起蛋白LPP(Large protrusion protein)[4]。Cheng等[5]通过低温电子显微镜研究发现,CPV的五聚体塔状蛋白TP的酶区域是拓扑结构高度保守并且有5个连接着鸟苷酰基转移酶和甲基转移酶区域的独特的通道;通过氨基酸序列推理发现,CPV的大突起蛋白LPP是由S7片段编码P50蛋白修饰后得到的。Yang等[6]研究发现,当CPV病毒粒子进行转录时,衣壳蛋白VP1A、VP1B和塔状蛋白VP3构象发生变化,衣壳空间扩大和塔状蛋白周围通道的加宽,使得基因组RNA从紧凑的病毒粒子衣壳更加灵活的转录和输出。Yang等[7]最新研究发现,通过对Helicoverpa armigera cypovirus-5(HaCPV-5)结构蛋白VP5具有RNA分子伴侣活性,能够促进RNA解旋并加速链的退火,并且促进逆转录酶的起始转录。
相对于CPV的结构蛋白的深入研究,CPV非结构蛋白的研究相对较慢。文力[8]、张万菊[9]等对DpCPV 1基因组中的第九片段(S9)的编码序列进行了cDNA克隆和序列测定,并对NS5蛋白的表达和功能进行了初步分析。Chen等[10]研究发现由DpCPV基因组第9片段编码的非结构蛋白NS5蛋白在感染昆虫细胞时,定位在昆虫细胞的细胞膜上。段兵[11]和胡建芳等[12]对马尾松毛虫CPV基因组第8片段进行序列分析和原核表达。凝胶迁移阻抑分析(EMSA)显示,由CPV基因组第8片段编码的p44蛋白具有序列非特异性的ssRNA结合活性,不与dsRNA、ssDNA、dsDNA结合;进一步研究发现p44氨基酸序列116-197 aa之间的区域(富含谷氨酸区域)为单一的RNA结合区域[13]。
Hagiwara等[14]通过原核表达BmCPV S5片段发现S5片段序列与口蹄疫2A蛋白的编码序列同源性高达93%。Cheng等[15]通过酵母双杂交的方法研究发现,DpCPV S5片段编码的NS 1蛋白能够与多角体蛋白(Polyhedrin)发生相互作用。
目前还未有对NSP1蛋白在中肠细胞的合成过程、真核表达和细胞定位的研究。本研究通过构建DpCPV 1基因组S5片段的原核表达体系,表达纯化蛋白后免疫家兔制备多克隆抗体。将稀释后的病毒液感染甜菜夜蛾幼虫,分时段提取中肠细胞样品,进行Western blot检测,判断该蛋白合成过程。通过构建bac-to-bac系统,将DpCPV 1非结构蛋白NSP1-GFP的融合表达,判断该蛋白在昆虫细胞Sf9上的定位,以期为理解该蛋白在病毒复制转录过程中的作用奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 昆虫,质粒及菌种甜菜夜蛾卵由中国科学院武汉病毒所昆虫病毒基因工程学科组提供,于27℃培养。大肠杆菌(Escherichia coli)DH5α、BL21和DH10B菌株均为本实验室保存;载体pMD18-T vector系统、T4 DNA Ligase及其buffer购自宝生物工程(大连)有限公司,载体pET-28a、DpCPV 1基因序列S5片段为本实验室保存。
1.1.2 主要试剂M-MLV逆转录酶、RNA 酶抑制剂购自Promega公司;rTaq DNA聚合酶、限制性内切酶以及Buffer购自宝生物工程(大连)有限公司;DM2000 DNA Marker 购自康为世纪生物科技有限公司;预染蛋白Marker购自南京生兴生物技术公司;异丙基-β-D硫代半乳糖苷(IPTG)购自武汉贝特生物公司;Ni-NTA His.BindTM Resins购自Novagen公司;转染试剂lipofectin 购自Invitrogen公司(美国);荧光染料 Hoechst 33258 购自BIOSHARP公司(美国);PVDF膜购自Millipore公司(美国);PCR纯化试剂盒购自PROMEGA公司(上海);质粒提取试剂盒购自PROMEGA公司(上海);其余药品均为国产分析纯。
1.1.3 引物合成根据DpCPV 1基因组S5-1片段的核苷酸序列的抗原区(核酸序列1-600 bp),设计引物;除通用引物M13F 和M13R(Cat. No. N530-02,Invitrogen公司,美国)外,其余引物均由上海生工生物工程技术服务有限公司合成。引物列表详见表 1。
DpCPV基因组通过SDS热酚法进行抽提[16]。以DpCPV病毒基因组中回收得到的S5-1片段为模板,以S5-1为引物,利用两步法进行RT-PCR扩增[17]。PCR扩增的片段通过相应的酶切位点酶切,连接到原核表达载体pET28a(pET28a-S5-1)。将阳性重组质粒转化大肠杆菌感受态细胞BL21,1 mmol/L的IPTG于37℃诱导表达4 h。收集菌体,经超声破碎后离心,获得包涵体蛋白。经8 mol/L的尿素溶液溶解包涵体蛋白,然后通过Ni-NTA树脂柱进行蛋白纯化并为下一步制备抗体做准备。
1.2.2 抗体制备纯化的目的蛋白用常规方法(淋巴加皮下注射)免疫家兔,制备抗血清。实验兔饲养,抗原注射及最终采血均委托武汉爱博泰克生物科技有限公司进行。
1.2.3 DpCPV感染甜菜夜蛾幼虫肖宇宙等[17]通过将DpCPV病毒液感染甜菜夜蛾幼虫后,出现典型的CPV感染症状,成功获得DpCPV多角体病毒,证明甜菜夜蛾幼虫也是DpCPV 的易感宿主。将病毒原液稀释成5×104 PIB/mL,将饲料块分成1 mm的正方形,每个小饲料块上滴10 µL的病毒稀释液。取100头2-3龄甜菜夜蛾幼虫,放到六孔板中,每个孔中一头幼虫和一块饲料,放入27℃恒温箱培养,每隔24 h取9头活虫,每3头为一组,取中肠放入1.5 mL的离心管中,连取5 d。
1.2.4 甜菜夜蛾幼虫中肠样品SDS-PAGE电泳检测分别配制12% Tris-甘氨酸SDS-PAGE电泳分离胶和5%的Tris-甘氨酸SDS-PAGE电泳积层胶,插入1.0 mm的梳子。然后进行样品处理,上述1-5 d的中肠样品分别取出20 µL,加入上样Buffer搅匀,沸水浴5 min,冰浴3 min,离心将杂质沉淀。将处理好的样品每胶孔上样15 µL,Protein Marker加10 µL,外加电压80 V约1 h后待样品液面相平时加压至120 V。样品跑到胶板底部即可停止。考马斯亮蓝染色过夜,脱色液脱色5 h。
1.2.5 间接酶联免疫吸附实验(ELISA)检测抗血清的效价抗原为各基因片段纯化后的原核表达产物或经蔗糖密度梯度离心纯化得到的病毒粒子。先用包被液稀释抗原,加入酶标板中,4℃包被过夜。第2天用含0.05% Tween-20的PBS(pH7.4)洗涤液清洗3次,甩干。用0.5%封闭液(PBS + 0.5% BSA + 0.05% Tween-20,pH7.4)37℃封闭30 min,然后用洗涤液清洗3次。一抗血清用洗涤液稀释1 000倍后,再依次2倍稀释,加入酶标板中。37℃孵育30 min,用洗涤液清洗3次,甩干。二抗(HRP标记的羊抗兔二抗)按试剂盒说明,稀释5 000倍后,加入酶标板中,37℃孵育30 min,用洗涤液清洗3次。显色步骤按照试剂盒说明,加入相应底物,37℃避光10 min左右显色完成后,加入终止液终止反应。最后在酶标仪上读取450 nm波长时的吸光值。
1.2.6 抗血清的Westernblot检测诱导表达和纯化的各蛋白及昆虫中肠细胞经SDS-PAGE电泳后,电转移到PVDF膜上,封闭液(TBS + 5%脱脂奶粉)4℃封闭过夜。TBS-T缓冲液(50 mmol/L Tris-Cl,200 mmol/L NaCl,0.1% Tween-20,pH7.5)室温洗膜5 min。抗血清用0.5%封闭液(TBS + 0.5%脱脂奶粉)稀释1 000倍,将膜分浸入抗血清稀释液中,37℃温浴1 h。TBS-T缓冲液洗膜3次,每次10 min。二抗分别为碱性磷酸酶标记的羊抗鼠IgG和羊抗兔IgG,用0.5%封闭液稀释3 000倍。将膜浸入二抗稀释液中,37℃温浴1 h。TBS-T缓冲液洗膜4次,每次10 min。显色操作参照说明书进行。
1.2.7 NSP1的亚细胞定位马永平等[18]研究了文山松毛虫质型多角体病毒(DpCPV2W)在昆虫细胞中的离体增殖行为,并进行了空斑试验,结果显示DpCPV2W 毒株在Sf9和Sf21 细胞中均能增殖,并能产生形态正常的病毒多角体。用P2病毒贮液感染贴壁生长24 h的Sf9细胞(覆盖玻底培养皿50%),27℃培养24 h,移除细胞培养基,用PBS(pH7.4)将细胞洗1遍,加入4%多聚甲醛(过滤除菌)室温静置固定15 min,再用PBS(pH7.4)将细胞洗1遍;加入透化液(0.25% triton×100),室温静置10 min;用PBS(pH7.4)洗涤细胞,加荧光染料hoechst 33258染核5-10 min,然后用PBS洗3遍,再加入1 mL PBS。激光共聚焦显微镜(TCS SP2,Leica,德国)观察绿色荧光分布情况。
1.2.8 序列统计分析与系统发育树构建将DpCPV 1基因组S5片段,放入NCBI上进行Blast序列比对(http://www.ncbi.nlm.nih.gov/BLAST/)。利用Mega4.0分析软件进行聚类分析,并采用软件 ClustalW和PHYLIP3.67的邻近法构建系统发育树。
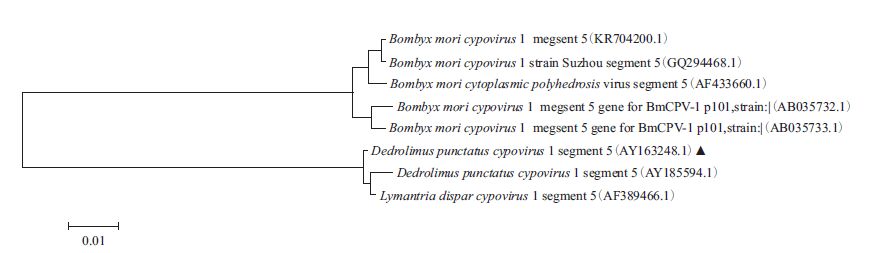
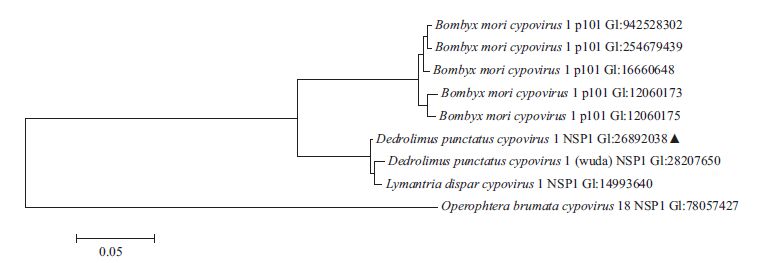
2 结果 2.1 DpCPV 1基因组S5片段和其编码非结构蛋白NSP1的系统发育分析通过系统发育树分析,DpCPV 1 基因组S5片段与舞毒蛾质型多角体病毒(LdCPV 1)基因组S5片段(AF 389466.1)和DpCPV(武大株)的S5片段(AY 185594.1)具有最高的序列同源性(99%),分别与5株家蚕质型多角体病毒(BmCPV 1)Strain H、Strain I、Strain suzhou、BmCPV S5(KR704200.1)和BmCPV S5(AF433660.1)对应片段的同源性为80%、80%、80%、80%和79%(图 1)。DpCPV 1 S5片段编码非结构蛋白NSP1的系统发育树分析显示:NSP1蛋白与DpCPV(武大株)和LdCPV 1的同源性为99%,与BmCPV 1 p101(GI:16660648)同源性88%,与另外4种BmCPV同源性为87%,与冬尺蠖蛾质型多角体病毒(Operophtera brumata cypovi-rus 18)的相应非结构蛋白氨基酸序列同源性为61%(图 2)。另外,我们检测到了NSP1蛋白与手足口病毒(Foot-and-mouth disease virus-type O)的VP1蛋白的部分序列有89%的氨基酸序列同源性。
|
| 图 1 DpCPV1基因组S5片段的核酸系统发育树 |
|
| 图 2 DPCPV 1 NS1蛋白的系统发育树 |
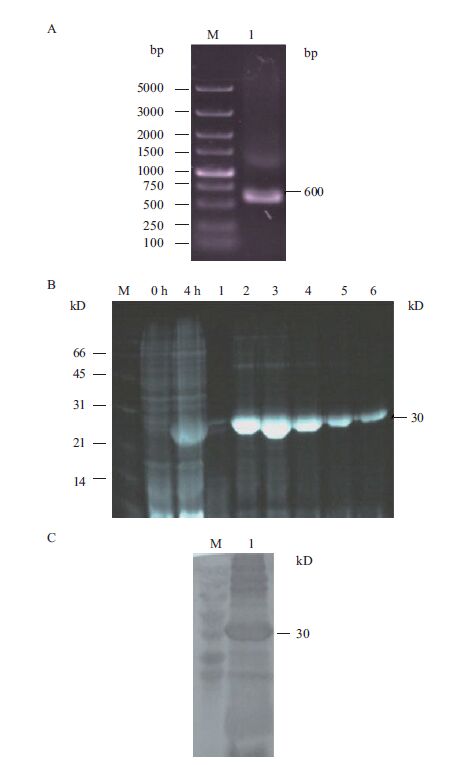
以S5-1为正反向引物,以DpCPV 1基因组S5截短片段(S5-1)为模板进行RT-PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,扩增片段大小600 bp。将S5-1连接至pET28a载体上,构建表达质粒。用BamHⅠ和Hind Ⅲ双酶切验证正确后,命名为pET28a-S5-1。经测序,将鉴定正确的克隆质粒pET28a-S5-1转化大肠杆菌BL21,加IPTG诱导后离心收集菌体,进行SDS-PAGE分析。如图 3所示,检测到插入的S5-1片段的载体有相应蛋白的表达,蛋白大小约为30 kD。因插入的S5-1片段后面携带了一个His纯化标签(大小约7 kD),所以实际插入S5-1片段表达的蛋白大小为23 kD,与S5-1片段表达蛋白大小相符。通过His纯化标签经Ni-NTA纯化树脂纯化包涵体的目的蛋白后,所得纯化蛋白免疫家兔,制备NSP1蛋白的多克隆抗体anti-S5-1。
|
| 图 3 DpCPV 1的S5-1的PCR和原核表达纯化SDS-PAGE图 A: S5-1片段的RT-PCR电泳图谱,M:DL5000 DNA Marker;1:S51PCR产物。B: S5-1片段的原核纯化蛋白:M:蛋白Marker;0 h:诱导0 h;4 h:诱导4 h;1-6:分管收集的S5-1的纯化蛋白。C:S5-1片段Western blotting;1:Western blotting产物;M:预染蛋白Marker |
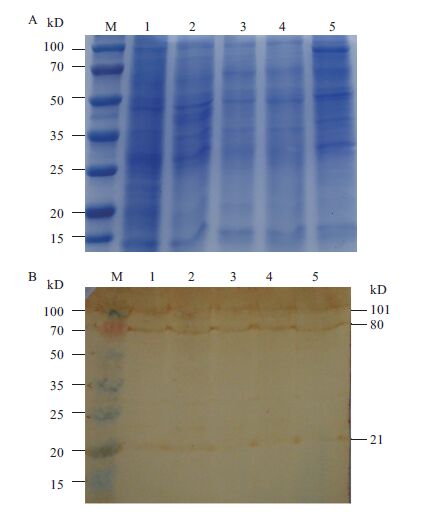
采用间接ELISA方法检测S5-1抗体的效价,在450 nm波长下读取吸光度值。结果显示,以原核表达产物为抗原,抗体效价在1∶3 000左右;以经过蔗糖密度梯度离心纯化得到的病毒粒子为抗原,抗体效价在1∶200左右。因此对S5-1抗体稀释1 000倍后用于检测。将感染病毒的中肠细胞离心取上清经SDS-聚丙烯酰氨凝胶电泳,转膜后经过Western blot检测DpCPV 1 S5片段编码蛋白NSP1在昆虫中肠细胞内的表达情况。如图 4-B显示,病毒感染的昆虫中肠细胞(第1-5泳道)在100、80和23 kD处有明显条带,条带是S5片段编码蛋白的真核表达蛋白。结果显示,在感染病毒的第1天S5片段编码的蛋白即已表达,属于早期表达蛋白,而且发生了切割。
|
| 图 4 昆虫中肠细胞中S5编码蛋白的动态曲线图谱 A:甜菜夜蛾中肠蛋白;M:蛋白Marker;1-5:分别于1-5 d收集的甜菜夜蛾中肠蛋白;B:S5编码蛋白的Western blot图谱;M:蛋白Marker;1-5:分别于1-5 d S5编码蛋白表达曲线 |
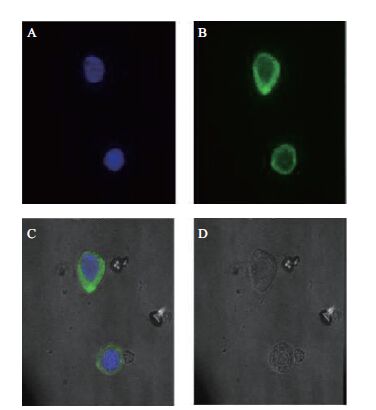
用P3代病毒感染昆虫细胞Sf9后24 h,用激光共聚焦显微镜观察蛋白的亚细胞定位情况。结果表明,昆虫细胞Sf9被杆状病毒感染后,细胞核明显增大,经荧光染料 Hoechst 33258染洗后,紫色部位为细胞核。而融合了NSP1的eGFP的蛋白则主要聚集在细胞质中(图 5-A),而没有融合NSP1的EGFP均匀地分布于整个细胞中(图 5-C),说明S5片段编码的非结构蛋白NSP1主要定位细胞质中。
|
| 图 5 融合了EGFP的NSP1在昆虫细胞中的定位 A:Hoechst 33258染洗后,紫色部分为细胞核;B:NSP1-GFP融合蛋白定位情况;C:绿光和蓝光的叠加效果图;D:白光下,被感染细胞的形态 |
本研究通过克隆 DpCPV 1基因组S5-1片段插入到原核表达载体BL21内,原核表达NSP1蛋白的抗原区部分。经SDS-PAGE电泳检测到诱导表达的蛋白大小约32 kD,这是因为在构建表达S5-1片段的后面添加了一个His纯化标签,纯化标签的蛋白大小约7 kD。所以DpCPV 1基因组S5-1片段原核表达蛋白的大小约25 kD,与NSP1的蛋白大小相符。将DpCPV 1 S5-1片段原核表达蛋白免疫家兔,制备了NSP1的多克隆抗体。
将DpCPV1感染甜菜夜蛾幼虫,取中肠样品进行Western blot检测,Western blot检测结果显示,DpCPV 1 S5片段编码的非结构蛋白从第1天就出现,并发现产生了切割修饰为早期表达蛋白,表达的蛋白大小分别为101、80 和21 kD,随时间增加并未递减。这种蛋白切割现象此前也在DpCPV 1的其它片段表达的蛋白中发现过。如Jin等[18]将DpCPV 1感染甜菜夜蛾幼虫,取中肠样品经Western blot检测发现,DpCPV 1 S7片段编码的蛋白p50在感染的第3天表达的蛋白大小为50 kD,在感染的第5天发现该蛋白发生切割修饰,修饰后的蛋白大小为31 kD,上述数据证实了DpCPV S7片段在真核细胞内表达的蛋白发生了切割。因此,我们推测NSP1蛋白在真核细胞内发生了降解或者被昆虫细胞的某些酶切割或修饰。用激光共聚焦显微镜观察Bac-S5-eGFP的融合蛋白的亚细胞定位发现,融合NSP1的绿色荧光蛋白(eGFP)主要聚集在细胞质中,没有融合eGFP的分布于整个细胞,说明 DpCPV 1的非结构蛋白NSP1定位于细胞质中。
4 结论对马尾松毛虫质型多角体病毒基因组S5片段编码NSP1蛋白的表达时相进行检测发现,该蛋白为早期表达蛋白,且在合成过程中发生了切割;对NSP1蛋白进行昆虫细胞定位,结果显示该蛋白定位于Sf9细胞的细胞质。
| [1] | King AMQ, Adams MJ. International committee on taxonomy of viruses[C]// Virus Taxonomy:Classification and Nomenclature of Viruses:Ninth Report of the International Committee on Taxonomy of Viruses, Elsevier, 2012. |
| [2] | 农业部农药检定所. 农药登记公告汇编[M]. 北京: 中国农业大学出版社, 2008. |
| [3] | 赵同海, 陈昌洁, 徐静, 张青文. 松毛虫质型多角体病毒的宿主域与交叉感染. 昆虫学报 , 2004, 47 (1) : 117–123. |
| [4] | Graham RI, Rao S, Possee RD, et al. Detection and characterisation of three novel species of reovirus(Reoviridae), isolated from geographically separate populations of the winter moth Operophtera brumata(Lepidoptera:Geometridae)on Orkney. J Invertebr Pathol , 2006, 91 (2) : 79–87. DOI:10.1016/j.jip.2005.11.003 |
| [5] | Cheng L, Sun JC, Zhang K, et al. Atomic model of a cypovirus built from cryo-EM structure provides insight into the mechanism of mRNA capping. PNAS , 2011, 108 : 1373–1378. DOI:10.1073/pnas.1014995108 |
| [6] | Yang CW, Gang J, Liu HR, et al. Cryo-EM structure of a transcribing cypovirus. PNAS , 2012, 109 (16) : 6118–6123. DOI:10.1073/pnas.1200206109 |
| [7] | Yang J, Cheng ZY, Zhang SL, et al. A cypovirus VP5 displays the RNA chaperone-like activity that destabilizes RNA helices and accelerates strand annealing. Nucleic Acids Res , 2014, 42 (4) : 2538–2554. DOI:10.1093/nar/gkt1256 |
| [8] | 文力, 张珈敏. 马尾松毛虫质型多角体病毒NS5蛋白基因的cDNA克隆及序列分析. 中国病毒学 , 2003, 18 (1) : 49–53. |
| [9] | 张万菊, 赵淑玲, 张小霞, 等. 马尾松毛虫质多角体病毒NS5蛋白的表达和功能初步分析. 中国病毒学 , 2006, 21 (4) : 401–404. |
| [10] | 汪洋, 张珈敏, 李杨, 等. 马尾松毛虫CPV基因组第7片段的cDNA克隆及序列分析. 武汉大学学报:理学版 , 2004, 50 (2) : 216–222. |
| [11] | 段兵, 赵淑玲, 张海元, 等. 文山松毛虫质型多角体病毒S8片段cDNA克隆与原核表达. 中国病毒学 , 2004, 19 (6) : 627–631. |
| [12] | 胡建芳, 张珈敏, 杨娟, 等. 单引物法扩增马尾松毛虫CPV基因组第8片段及其序列分析. 中国病毒学 , 2003, 18 (1) : 39–43. |
| [13] | Zhao SL, Liang CY, Zhang WJ, et al. Characterization of the RNA-binding domain in the Dendrolimus punctatus cytoplasmic polyhedrosis virus nonstructural protein p44. Virus Research , 2005, 114 (1) : 80–88. |
| [14] | Hagiwara K, Kobayashi J, Tomita M, et al. Nucleotide sequence of genome segment 5 from Bombyx mori cypovirus 1. Archives of Virology , 2001, 146 : 181–187. DOI:10.1007/s007050170202 |
| [15] | Cheng CG, Shao YP, Su L, et al. Interactions among Dendrolimus punctatus cypovirus proteins and identification of the genomic segment encoding its A-spike. Journal of General Virology , 2014, 95 : 1532–1538. DOI:10.1099/vir.0.064022-0 |
| [16] | 刘润忠, 谢天恩, 彭辉银. 文山松毛虫质型多角体病毒形态结构及理化性质的研究. 中国病毒学 , 1992, 7 (1) : 69–79. |
| [17] | 肖宇宙, 孙修炼, 汤显春, 等. 甜菜夜蛾增值马尾松毛虫质型多角体病毒研究. 应用与环境生物学报 , 2010, 16 (1) : 84–90. |
| [18] | 马永平, 孟小林, 徐进平. 文山松毛虫质型多角体病毒在Sf21细胞中离体增值实验. 中国病毒学 , 2002, 17 (2) : 137–141. |
| [19] | Jin L, Dai CW, Qin TC, et al. Molecular characterization of protein p50 of Dendrolimus punctatus cytoplasmic polyhedrosis virus. Journal of Basic Microbiology , 2013, 53 (1) : 37–44. DOI:10.1002/jobm.v53.1 |




