神经生长因子(Nerve growth factor,NGF)是最早被发现的神经营养因子,是具有神经元营养和促突起生长双重生物学功能的一种神经细胞生长调节因子,其对多种细胞特别是中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用[1]。NGF具有重要的临床价值,目前已被广泛用于中枢以及周围神经系统疾病的治疗中,还具有抗病毒、抗炎、调节人免疫系统、促进伤口修复等非神经系统方面的作用[2, 3]。NGF包含α、β、γ三个亚基,其中β亚基具有完整的NGF生物学活性,目前临床使用的NGF主要来源于小鼠颌下腺提取的鼠βNGF(mβNGF)[4]。与mβNGF相比,重组人βNGF(rhβNGF)具有易获得、高产率、高活性、成本低廉与无免疫原性等特点,建立高效、稳定的hβNGF重组表达系统具有重要的临床意义和商业价值[5]。
大肠杆菌是最广泛应用于表达各种外源基因的表达系统,其重组表达NGF多以包涵体形式获得,获得具有活性的NGF需要进行复杂的变性、复性操作,且活性较低,不利于大规模工业化过程[6-9]。麦芽糖结合蛋白(Maletose-binding protein,MBP)是大肠杆菌中麦芽糖积累途径中的一种关键蛋白质,MBP具有强助溶作用,将其与外源蛋白融合表达可显著提高外源蛋白的可溶表达,从而简化技术步骤,提高外源蛋白活性[10, 11]。但目前,尚未有成功利用MBP重组表达可溶NGF的报道。因此,本研究拟利用基因工程手段将hβNGF通过自带MBP的pMAL-c2X质粒载体重组在大肠杆菌中,构建一种成熟、稳定、高效的表达系统,从而获得大量具有天然活性的rhβNGF。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒大肠杆菌E. coli TOP10、BL21(DE3),北京全式金生物技术有限公司;质粒pMAL-c2x,Novagen公司。
1.1.2 主要试剂与仪器限制性内切酶、T4连接酶,Fermentas公司;PCR反应试剂盒、质粒提取试剂盒,宝生物工程(大连)有限公司;凝血酶因子Xa试剂盒,Novagen公司;兔抗NGF IgG、羊抗兔IgG,Chemicon公司;NGF国际标准品(NIBSC 93/556,10 000 U/支);其它试剂均为国产分析纯。
美谱达UV-1200可见分光光度计;GS2 PCR仪;Bio-Rad Gel Doc 2000凝胶成像系统;SANYO MPR-1410层析冷柜;ÄKTA Purifier 100蛋白纯化系统;BECKMAN COULTER Avanti J-26XP离心机;BECKMAN MICROFUGE 22R微量台式离心机。
1.2 方法 1.2.1 引物设计与合成根据GenBank中hβNGF基因序列(118 aa),以本实验室保存的人神经生长因子cDNA序列为模板,利用上下游引物扩增NGF成熟肽编码基因。引物为mbp-hβNGF-F:AGGGAAGGAGTTCATCCCATCCCATCTTCCAC(下划线为Xmn Ⅰ酶切位点),mbp-hβNGF-R:CCAAGCTT-TCATCTCACAGCCTTCCTGCTGAG(下划线为Hind Ⅲ酶切位点),引物由TaKaRa公司合成。
1.2.2 目的基因的克隆和表达工程菌的构建PCR扩增目的基因,胶回收目的基因片段。利用限制性内切酶Xmn Ⅰ和Hind Ⅲ对预插入目的片段的原核表达载体pMAL-c2X分别进行双酶切,胶回收酶切后目的片段用T4 DNA Ligase将纯化后的酶切产物与原核表达载体进行连接反应,将构建好的融合表达载体(pMAL-c2X-hβNGF)首先转化到E.coli TOP10中,挑选的单菌落培养液进行菌液PCR检测。提取质粒DNA进行限制性酶切的鉴定,挑取酶切鉴定正确的质粒进行测序,将鉴定正确的pMAL-c2X-hβNGF的重组质粒转化到大肠杆菌 BL21(DE3)表达菌株中。
1.2.3 目的蛋白诱导表达用灭菌接菌环刮取-80℃冻存的甘油菌,划线于琼脂板上,在37℃恒温箱中倒置培养过夜,活化菌株。挑取单菌落接种于20 mL液体LB培养基(含50 μg/mL Amp)中,37℃,300 r/min条件下振荡培养约10-12 h。按1∶50的比例转接于新鲜的液体LB培养基中,37℃,300 r/min条件下振荡培养至OD600≈0.8(约2.0-2.5 h)。分别在25℃和37℃两个温度下,转速均为180 r/min,加入终浓度为0.5 mmol/L的IPTG诱导表达11 h。
1.2.4 表达产物的纯化离心收集菌体,以10 mL 蛋白提取缓冲液重悬200 mL LB培养菌体,在冰水浴中进行超声波破碎。4℃,12 000 r/min离心20 min,收集上清,并用0.45 μm滤膜过滤。用MBP Trap HP(1 mL,5 mL)亲和柱于ÄKTA Purifier 100蛋白纯化系统进行纯化,纯化过程在4℃低温层析柜中进行,分管收集洗脱液,检测蛋白纯度,SDS-PAGE分析各组分。Factor Xa(4℃,16 h)切割亲和层析获得的hβNGF-MBP,然后用Superdex-7510/300GL凝胶过滤分离纯化酶切后的hβNGF,SDS-PAGE分析纯化后蛋白纯度。
1.2.5 表达产物的Westernblot鉴定 SDS-PAGE 电泳后,将胶在Transfer buffer中平衡30 min,15 V恒压转35 min(电流约75 mA);用TBST洗膜3次,再在室温下用封闭液封闭1 h;TBST洗膜后用一抗(兔抗NGF IgG)4℃孵育过夜;TBST洗膜后,加入酶标二抗(羊抗兔IgG-HRP)孵育2 h;TBST洗膜后加入底物(鲁米诺)发光拍照。
1.2.6 生物学活性检测参照《2015版中国药典》采用TF-1法测定神经生长因子生物学活性[12]。TF-1细胞株用完全培养液于37℃、5% CO2条件下培养,传代后24-36 h用于生物学活性测定。在加有标准品溶液和供试品溶液100 μL的96孔细胞培养板中每孔加入细胞悬液100 μL(细胞浓度6×104个/mL),于37℃、5% CO2条件下培养72 h。每孔加入MTS溶液20 μL,于37℃、5% CO2条件下孵育3 h。将96孔细胞培养板放入酶标仪,以550 nm为参比波长,在波长490 nm处测定吸光度,以四参数回归计算法处理实验数据。
2 结果 2.1 hβNGF基因扩增产物的鉴定hβNGF编码基因序列的扩增结果如图 1所示。hβNGF成熟肽共118 aa,编码序列共354 bp,加上15 bp的酶切识别位点和保护碱基共369 bp。扩增条带大小符合预期。
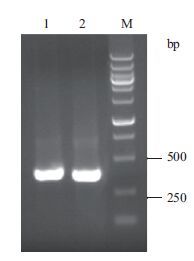
|
| 图 1 hβNGF基因PCR产物检测 1,2:hβNGF-MBP-F/R扩增cDNA的产物;M:DNA Marker |
4个单菌落的培养物经PCR验证均为阳性克隆,表明NGF成熟肽编码序列已经插入到载体中(图 2)。进一步培养重组菌提取pMAL-c2X-hβNGF重组质粒,也进行Xmn Ⅰ和Hind Ⅲ双酶切鉴定,结果(图 3泳道4)显示,在500 bp与250 bp之间可见酶切下来的NGF片段。对最终结果进行测序鉴定,测序结果与天然序列进行比对,确定序列插入正确且不存在突变或移码。
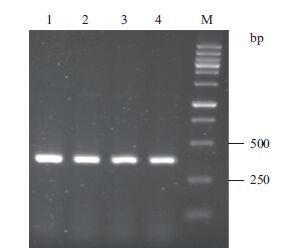
|
| 图 2 阳性转化子的PCR鉴定 1-4:单菌落培养物的PCR检测结果;M:DNA Marker |
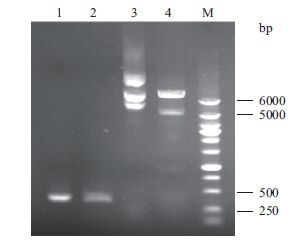
|
| 图 3 pMAL-c2X-hβNGF质粒的双酶切鉴定 1:hβNGF酶切前(PCR产物);2:Xmn Ⅰ和Hind Ⅲ双酶切hβNGF;3:提取的pMAL-c2X-hβNGF质粒;4:pMAL-c2X-hβNGF双酶切产物;M:DNA Marker |
在不同的温度下重组表达hβNGF,结果如图 4所示。泳道1和泳道2对比可以明显看出,利用该系统可以重组表达hβNGF-MBP,蛋白大小约56 kD符合预期;从泳道3和泳道4可知,37℃条件下,hβNGF-MBP基本以包涵体的形式表达;对比泳道3和泳道6可知,在25℃条件下,可获得hβNGF-MBP的可溶性表达。
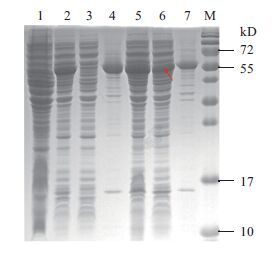
|
| 图 4 表达产物的SDS-PAGE检测 1:pMAL-c2X空载体对照;2:0.5 mmol/L IPTG,37℃诱导11 h的pMAL-c2X-hβNGF全菌;3:0.5 mmol/L IPTG,37℃诱导11 h的pMAL-c2X-hβNGF上清;4:0.5 mmol/L IPTG,37℃诱导11 h的pMAL-c2X-hβNGF沉淀;5:0.5 mmol/L IPTG,25℃诱导11 h的pMAL-c2X-hβNGF全菌;6:0.5 mmol/L IPTG,25℃诱导11 h的pMAL-c2X-hβNGF上清;7:0.5 mmol/L IPTG,25℃诱导11 h的pMAL-c2X-hβNGF沉淀;M:蛋白质 Marker |
将超声破碎的上清过MBP亲和层析柱,以10 mmol/L 麦芽糖洗脱。结果(图 5)显示,对比泳道1和泳道2,上清液有大量可溶性表达的MBP融合蛋白,洗脱获得了纯度较高的融合蛋白。
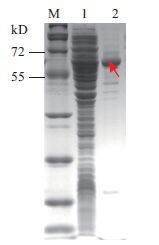
|
| 图 5 hβNGF-MBP纯化的SDS-PAGE检测 M:蛋白质 Marker;1:过柱流穿液;2:麦芽糖洗脱液 |
纯化获得的hβNGF-MBP融合蛋白的缓冲液中仅含有10 mmol/L麦芽糖,可以直接利用Factor Xa去除MBP标签。分别以0、0.5、2和8 U Factor Xa在25℃水浴条件下酶切约50 μg hβNGF-MBP 16 h,结果(图 6)显示,0.5 U的Factor Xa切割效果与2 U和8 U Factor Xa的效果相当,切割下来的MBP标签和hβNGF见图中箭头所指处。后续利用凝胶层析进行二次纯化,效果较好,SDS-PAGE(图 7)分析显示,hβNGF位于13 kD左右,灰度扫描指出纯度达95%以上。以mNGF为对照,对表达产物进行Western blot分析,结果(图 8)显示,重组产物与mNGF有一致的条带,说明这重组子能有效表达hβNGF蛋白。
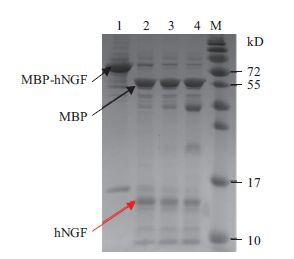
|
| 图 6 hβNGF-MBP标签去除的SDS-PAGE检测 1-4:分别以0 U、0.5 U、2 U和8 U Factor Xa 25℃酶切hβNGF-MBP 16 h;M:蛋白质Marker |
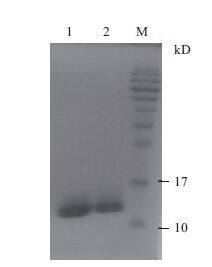
|
| 图 7 纯化得到hβNGF的DS-PAGE检测 1,2:纯化得到的rhβNGF;M:蛋白质Marker |
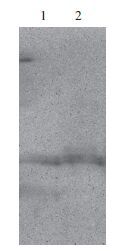
|
| 图 8 hβNGF的Western blot鉴定 1:mNGF;2:hβNGF |
以NGF国际活性标准品为对照,采用TF-1细胞法检测hβNGF的活性,四参数回归计算法处理检测数据。结果(图 9)显示,hβNGF的EC50约为2 ng/mL,比活约为1×106 U/mg,与活性标准品相当,说明hβNGF具有较高的活性。

|
| 图 9 hβNGF活性检测的量效曲线 |
大肠杆菌表达系统是基因表达技术中应用最早和最广泛的经典表达系统,其重组表达目的蛋白具有很多的优点,但其表达效率受到多种因素制约,特别是会形成不溶的包涵体,造成纯化工艺繁琐,蛋白活性受到影响[13, 14]。包涵体形成的主要机制在于蛋白的合成速度过快,没有足够的时间进行正确的折叠,或者胞内的还原环境不利于形成二硫键[15]。MBP作为一种分子伴侣,能有效阻止融合蛋白的折叠中间肽之间聚集沉淀,从而实现蛋白的可溶表达[16]。pMAL-c2X是一种自带MBP基因的质粒载体,将目的基因重组进pMAL-c2X载体可以获得目的蛋白-MBP融合蛋白的可溶表达,目前已经在多种目的蛋白的重组表达中应用。如刘中禄等[17]将人工合成的Tα1序列插入到pMAL-c2X质粒载体中构建pMAL-c2X-Tα1融合表达质粒,再插入大肠杆菌中进行表达,该菌株能有效表达可溶Tα1-MBP融合蛋白,融合蛋白占菌体蛋白的33.6%。宋琳琳等[18]以带CTP基因序列的上游引物扩增Ub-HBcAg,将PCR产物克隆到pMAL-c2X质粒载体并插入大肠杆菌BL21(DE3)中,诱导表达并以亲和层析法纯化融合蛋白,结果表明CTP-Ub-HBcAg原核表达载体并成功可溶表达,且能有效纯化。
在本研究中,我们利用pMAL-c2X表达载体,构建了hβNGF-MBP的大肠杆菌表达体系并进行诱导表达,成功获得了hβNGF-MBP融合蛋白的可溶表达。研究表明,融合蛋白的可溶表达需要适当降低蛋白的表达速度,如吴敬君等[19]以大肠杆菌重组表达肝素黄杆菌硫酸软骨素酶AC-MBP融合蛋白的研究中发现,MBP融合蛋白在普通发酵条件下仍主要以包涵体的形式表达,通过降温(15℃)才能实现融合蛋白的可溶表达。熊志红等[20]以大肠杆菌重组表达另一种分子伴侣SUMO与hβNGF融合蛋白的研究中也发现,表达的融合蛋白依然以包涵体的形式存在。本研究中hβNGF-MBP融合蛋白在普通发酵条件下也主要以包涵体的形式表达,只有在低温(25℃)、低转速(180 r/min)、低IPTG添加量(0.5 mmol/L)的情况下能获得可溶性表达,与上述研究的结论相似。可溶表达的hβNGF-MBP经酶切、纯化后,能获得纯度95%且经Western blot鉴定的hβNGF,其比活高达1×106 U/mg,生物学活性显著高于目前市售的mβNGF产品[21],从而为rhβNGF的规模化生产提供重要的技术基础。
4 结论本研究成功扩增hNGF β亚基基因,将其克隆入pMAL-c2X表达载体,构建了hβNGF-MBP的大肠杆菌表达体系,在低温、低转速、低IPTG条件下诱导表达获得hβNGF-MBP融合蛋白的可溶表达,通过MBP亲和层析、Xa酶切、凝胶层析,获得了高纯度(>95%)、高活性(比活约为1×106 U/mg)的hβNGF。
| [1] | Levi-Montalcini R, Hamburger V. Selective growth stimulating effects of mouse sarcoma on the sensory and sympathetic nervous system of the chick embryo. Journal of Experimental Zoology , 1951, 116 (2) : 321–361. DOI:10.1002/(ISSN)1097-010X |
| [2] | 中国神经生长因子临床应用专家共识协作组. 神经生长因子(恩经复)临床应用专家共识. 中华神经医学杂志 , 2012, 11 (4) : 416–420. |
| [3] | 吴泽宇, 孙晋民, 蔡冬梅. 神经生长因子在非神经系统中的作用研究进展. 西北药学杂志 , 2015, 30 (1) : 104–106. |
| [4] | 徐莉, 饶春明. 神经生长因子的研究进展. 中国生物制品学杂志 , 2014, 27 (1) : 131–134. |
| [5] | 戚菁, 李素芹, 李琳, 等. 不同载体构建人神经生长因子的比较. 药物生物技术 , 2009, 16 (1) : 37–42. |
| [6] | 欧晓敏, 李少华, 刘农乐, 等. 人β神经生长因子基因稀有密码子及mRNA二级结构对其在大肠杆菌中表达的影响. 生物技术通讯 , 2011, 22 (6) : 789–792. |
| [7] | 李佳楠, 杨薇, 吴红梅, 等. 人β-NGF在大肠杆菌中的表达、纯化及活性测定. 中国药学杂志 , 2014, 49 (20) : 1785–1790. |
| [8] | 付明娟, 林接玉, 谢捷明. 包涵体蛋白复性的研究进展. 医学综述 , 2015, 21 (20) : 3657–3659. |
| [9] | 尹雪薇, 彭艳丽, 冉帅, 等. 中国林蛙核糖核酸酶Rdrlec的原核表达及抗菌活性检测. 生物技术通报 , 2013, 44 (5) : 93–98. |
| [10] | Zhang J, Lv X, Xu R, et al. Soluble expression, rapid purification, and characterization of human interleukin-24(IL-24)using a MBP-SUMO dual fusion system in Escherichia coli. Applied Microbiology & Biotechnology , 2015, 99 (16) : 1–9. |
| [11] | Park SJ, Lee SH, Kim KJ, et al. Soluble expression and purification of Receptor activator of nuclear factor-kappa B ligand using E. coli. Journal of Microbiology & Biotechnology , 2014, 25 (2) : 274–279. |
| [12] | 国家药典委员会. 2015版中国药典[M]. 北京: 中国医药科技出版社, 2015 : 3531. |
| [13] | Hwang PM, Pan JS, Sykes BD. Targeted expression, purification, and cleavage of fusion proteins from inclusion bodies in Escherichia coli. Febs Letters , 2014, 588 (2) : 247–52. DOI:10.1016/j.febslet.2013.09.028 |
| [14] | 张云鹏, 温彤, 姜伟. 大肠杆菌和酵母表达系统的研究进展. 生物技术进展 , 2014, 4 (6) : 389–393. |
| [15] | Biotechnology Journal Group. Recombinant protein folding and misfolding in Escherichia coli. Nature Biotechnology , 2004, 22 (11) : 1399–1408. DOI:10.1038/nbt1029 |
| [16] | 吴珊珊, 朱芸, 陈珊珊, 等. 融合标签在蛋白质可溶性表达中的应用进展. 化工进展 , 2014, 33 (4) : 993–998. |
| [17] | 刘中禄, 陶翠兰, 莘旭妮, 等. 重组胸腺素α1 pMAL-C2x-Tα1/TB1工程菌的构建与表达. 中国比较医学杂志 , 2012, 22 (7) : 13–16. |
| [18] | 宋琳琳, 卓萌, 唐余燕, 等. CTP-Ub-HBcAg原核表达载体的构建及其表达. 胃肠病学和肝病学杂志 , 2014, 23 (10) : 1184–1186. |
| [19] | 吴敬君, 李晔, 张翀, 等. 肝素黄杆菌硫酸软骨素酶AC的高效重组表达体系构建及其酶学性质研究. 食品科学 , 2013, 34 (9) : 127–134. |
| [20] | 熊志红, 孙卫国, 杨栗坤, 等. 重组人神经生长因子β亚基的原核优势表达及纯化. 生物技术通讯 , 2015, 26 (6) : 776–779. |
| [21] | 于婷, 宋小红, 付玲, 等. TF-1细胞增殖法测定神经生长因子生物学活性的建立与应用. 生物技术通讯 , 2012 (6) : 840–845. |




