2. 教育部动物性食品安全保障技术工程研究中心, 大连 116620
2. Ministry of Education Center for Food Safety of Animal Origin, Dalian 116620
金黄色葡萄球菌是人和动物的一种主要病原菌[1],它能引起脓肿、脓疱病和乳腺炎等感染性疾病,也能引起肺炎、败血病和中毒性休克综合征等致死性疾病[2]。目前为止,对金黄色葡萄球菌感染的治疗主要以抗生素为主,但滥用抗生素导致耐药菌频现,禽畜产品中抗生素的残留也对食品安全和人体健康造成了严重威胁[3, 4]。因此,寻找抗生素的替代品是解决抗生素各种弊端的一种有效的途径。
卵黄抗体(IgY)是一类具有杀灭病菌作用的抗生素替代品。这种抗体是在特异性抗原刺激下由禽类B淋巴细胞产生并转移到卵黄中的多克隆抗体,以其性质稳定、特异性强等优势而成为特别具有应用前景的抗生素替代品。本实验室多年来一直致力于抗金黄色葡萄球菌IgY的制备和应用,在其制备方面采用免疫蛋鸡的方法,纯化方面一直采用的是传统的水稀法[5, 6]及硫酸铵和硫酸钠盐析结合的方法[7]。免疫蛋鸡所获得的特异性IgY仅占IgY总含量的2%-10%,且分离纯化过程繁琐,因此,如何获得高活性、性能稳定,甚至能通过基因工程菌大量表达的IgY,是突破IgY难以大量提纯瓶颈问题的关键,也是研究IgY抗菌机理必须解决的问题。本实验室通过PCR方法扩增IgY基因的重链可变区和轻链可变区,并通过噬菌体展示技术将重链可变区和轻链可变区的连接产物表达于噬菌体的表面,运用生物淘选的方法淘选到了一条重链可变区和轻链可变区序列完整的金黄色葡萄球菌单链抗体(single-chain fragment variable,scFv)基因[8]。本研究主要针对此基因的原核蛋白表达方法,通过蛋白小量诱导表达、大量诱导表达、包涵体溶解、复性及蛋白纯化和浓缩等手段,以期获得有生物活性的目的蛋白抗体。
1 材料与方法 1.1 材料金黄色葡萄球菌(CVCC545)购自中国兽医微生物菌种保藏管理中心。原核表达载体pColdⅠ、宿主菌大肠杆菌 JM109、大肠杆菌 BL21、PCR扩增用酶PrimeSTAR® HS DNA Polymerase、DL2000 DNA Marker、Premixed Protein Marker(Broad)购自宝生物工程(大连)有限公司;Precision Plus ProteinTM Standards购自Life Technologies公司;In-Fusion HD Cloning Plus购自Clotech公司;Antibody BSA free Mouse monoclonal IgG购自Qiagen公司;Rabbit anti Mouse IgG HRP购自Invitrogen公司;HiTrapTM TALON crude,5 mL TALON SuperflowTM购自美国通用电气公司;SnakeSkinTM Pleated Dialysis Tubing;3500 MWCO购自Thermo公司。
1.2 方法 1.2.1 金黄色葡萄球菌抗体scFv基因的扩增根据金黄色葡萄球菌抗体scFv基因序列和pCold I载体序列设计了1对In-Fusion引物。其中上游引物INF:5'-GAAGGTAGGCATATGGCCGTGACGTTGGAC-3',划线处为scFv基因上的序列,未划线处为pCold I载体上的序列;下游引物INR:5'-AGACTGCAGGTCGACTTATGGTTCCATGCAACAGCCG-3',划线处为scFv基因上的序列,未划线处为pCold I载体上的序列。以噬菌体文库淘选到的scFv基因为模板,进行PCR扩增。PCR体系如下:ScFV DNA片段 1 µL,INF(20 pmol/µL)0.5 µL,INR(20 pmol/µL)0.5 µL,dNTP(2.5 mmol/L each)8 µL,PrimeSTAR HS DNA Polymerase(2.5 U/µL)0.5 µL,5×PrimeSTAR PCR Buffer 10 µL,dH2O补充至50 µL。反应程序为:94℃预变性1 min;98℃变性10 s,55℃退火10 s,72℃延伸1 min,循环扩增30次。扩增产物于1% 琼脂糖凝胶上进行电泳分析,并回收目的条带。
1.2.2 重组质粒的构建表达载体pCold I用Xho Ⅰ、Nde进行双酶切,双酶切产物进行切胶回收后与上述纯化的PCR产物用In-Fusion HD Enzyme 50℃连接15 min。连接产物转化大肠杆菌 JM109感受态细胞,涂布LB/Amp(50 µg/mL)平板筛选阳性克隆,37℃培养箱倒置过夜培养,然后挑取单菌落进行菌落PCR验证,取菌落PCR呈阳性的重组子提取质粒DNA,将重组质粒pCold I -scFv送往宝生物工程(大连)有限公司测序。
1.2.3 重组蛋白的小量表达测序读码框架正确的重组质粒pCold I -scFv转化至大肠杆菌BL21感受态细胞,涂布于LB/Amp(50 µg/mL)平板筛选阳性克隆,挑取单克隆接种至2 mL LB/Amp(50 µg/mL)液体培养基,置于37℃振荡培养,次日取过夜培养的种培养液,按1/100的比例接种至3 mL LB/Amp(50 µg/mL)液体培养基中,当菌体生长至OD600约为0.6时,15℃培养15 min,之后添加适量的100 mmol/L IPTG至终浓度为1 mmol/L,15℃诱导培养22 h。集菌后,取2.0 OD相当的菌体加入320 µL PBS缓冲液(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KHPO4,pH7.4),将细菌悬浊后进行冰浴超声破碎,之后将破碎液进行离心(12 000 r/min,5 min)。取各抽提液(全蛋白、上清、沉淀)8 µL(0.05 OD相当),加入2 µL 5×SDS Loading Buffer,95℃加热10 min,进行SDS-PAGE电泳。
1.2.4 重组蛋白的大量表达及包涵体的洗涤和溶出将经小量表达优化后的pCold I -scFv甘油保存菌种50 µL,接种至5 mL LB/Amp(50 µg/mL)液体培养基中,在16.5φ玻璃试管内,37℃摇床过夜培养。次日取过夜培养的种培养液,按1/100的比例接种至500 mL LB/Amp(50 µg/mL)液体培养基中,在2 L 摇瓶内,37℃摇床震荡诱导培养,培养方法同小量表达。将大量诱导表达的菌体于4℃ 4 000 r/min 离心40 min,收集菌体,用不含尿素的PBS缓冲液洗涤菌体两次,之后用含4 mol/L 尿素的Sonication buffer(50 mmol/L Sodium phosphate,300 mmol/L NaCl,5 mmol/L Imidazole,4 mol/L Urea,pH8.0)将菌体重悬,冰浴超声破碎,继而4℃,12 000 r/min离心40 min,取上清。上清液即是包涵体的溶解液,使用0.45 µmol/L 过滤膜将上清进行过滤,即得到了较纯的蛋白上清液,为蛋白的进一步纯化和复性做好准备。
1.2.5 重组蛋白的纯化溶出的包涵体使用GE HiTrap TALON crude,5 mL TALON Superflow 进行柱层析纯化。首先将GE HiTrap TALON crude,5 mL TALON Superflow纯化柱与AKTA prime Plus机器相连接,用10倍柱体积的MilliQ水和Buffer A(50 mmol/L Sodium phosphate,300 mmol/L NaCl,5 mmol/L Imidazole,pH8.0)对树脂进行平衡。然后进行上样及清洗,将AKTA prime Plus机器的进样管放于1.2.4过滤后的蛋白上清液中,以0.5 mL/min的速度上样。待样品流穿后,用20倍柱体积的Buffer A洗3次柱,充分除去非特异结合的蛋白。在AKTA prime Plus机器的引导下,10倍柱体积的Buffer A和10倍柱体积的Buffer B(50 mmol/L Sodium phosphate,300 mmol/L NaCl,300 mmol/L Imidazole,4 mol/L Urea,pH8.0)以1 mL/min的流速混合,混合液洗脱Buffer咪唑的浓度由5 mmol/L逐渐提高至300 mmol/L。目的蛋白在合适的咪唑浓度下被洗脱下来。使用AKTA prime Plus的自动收集盘对洗脱样品进行收集,每1.1 mL收集一管。从每管样品中取5 µL样品,15% SDS-PAGE凝胶进行电泳,检测目的样本的分布。
1.2.6 重组蛋白的复性将收集后的目的蛋白装入透析袋,在烧杯中用20倍收集蛋白量的PBS缓冲液(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KHPO4,pH7.4)进行3次透析。前2次 2 h/次,第3次过夜。将透析后的蛋白放入15 mL tube中,分别取2、4和8 µL进行电泳,通过BSA及ImageMaster 1D version 3.0解析软件对透析后蛋白进行定量分析。
1.2.7 重组蛋白Westernblot鉴定 将PVDF膜、滤纸分别剪切成与凝胶相同大小,使用转膜缓冲液处理后,按滤纸、PVDF膜、凝胶、滤纸的顺序依次放在转膜仪电极板之间,开始转膜。将PVDF膜置于含1.5% BSA 的10 mL 封闭液中,4℃平放过夜封闭。使用稀释后的Antibody BSA free Mouse monoclonal IgG溶液5 mL,进行一次抗体反应1 h。TBST缓冲液(20 mL)洗涤2次;TBS缓冲液洗涤3次。使用稀释后的Rabbit anti Mouse IgG HRP抗体溶液5 mL,进行二次抗体反应1 h。TBST缓冲液(20 mL)洗涤2次;TBS缓冲液洗涤3次。1 mL TrueBlue Peroxidase Substrate显色1 min。
1.2.8 重组蛋白间接ELISA活性鉴定以金黄色葡萄球菌为抗原检测原核表达的蛋白是否有抗体活性。将购买的金黄色葡萄球菌接种到TSB(胰蛋白胨1.5%,大豆蛋白胨0.5%,氯化钠0.5%)培养基中,37℃过夜培养,第2天,4℃,8 000 r/min,离心10 min,收集菌体,将获得的菌体用PBS重悬,洗涤3次,之后用1%甲醛37℃灭活24 h,再用PBS重悬洗涤3次,用生理盐水稀释备用。为了确保实验的严谨性,实验用同样处理的大肠杆菌做为阴性对照。首先,用100 µL 浓度为0.02 mg/mL的金黄色葡萄球菌和大肠杆菌过夜包被ELISA板,第2天,倾倒包被液,使用100 µL封闭液(含1.0% BSA)37℃封闭1 h,弃孔中溶液,然后每孔加入100 µL 浓度为0.016 mg/mL的可溶性蛋白,于37℃孵育1 h,弃孔中溶液,用TBST洗涤3次;之后每孔加入100 µL 1∶1 000稀释的Antibody BSA free Mouse monoclonal IgG,37℃孵育1 h,弃孔中溶液,用TBST洗涤3次;再加入100 µL 1∶1 000稀释的Rabbit anti Mouse IgG HRP抗体,37℃孵育1 h,弃孔中溶液,用TBST洗涤5次;加100 µL TMBZ显色液,室温密闭显色20 min,之后加入50 µL 2 mol/L H2SO4终止液,立即在TECAN Infinite F200酶标仪上读取A450值。
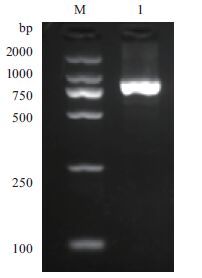
2 结果 2.1 金黄色葡萄球菌抗体scFv基因PCR扩增结果使用In-Fusion引物对scFv基因进行PCR扩增,扩增后的片段见图 1。使用Nde 和Xho Ⅰ对pCold I载体进行酶切,酶切结果见图 2。
|
| 图 1 scFv片段的PCR扩增结果 M:DL2000 DNA Marker;1:scFv PCR扩增产物 |

|
| 图 2 pCold Ⅰ载体Nde和Xho Ⅰ酶切前后结果 M:DL2000 DNA Marker;1:pCold Ⅰ 载体;2:pCold Ⅰ载体Nde/Xho Ⅰ 酶切后 |
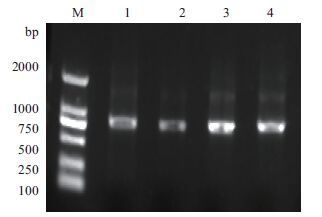
随机从转化平皿上挑取4个pCold I -scFv重组菌落,使用pCold I载体上的引物进行PCR扩增,电泳结果(图 3)显示,重组菌落扩增后得到了1 kb左右的核酸条带,扩增条带大小与目的基因大小吻合。测序结果显示所构建的重组质粒读码框完整,读码正确,说明目的重组质粒构建成功。
|
| 图 3 重组菌落PCR产物电泳结果 M:DL2000 DNA Marker;1-4:重组质粒PCR产物 |
重组质粒pCold I-scFv转化大肠杆菌 BL21感受态细胞,用终浓度为1 mmol/L 的IPTG,15℃诱导培养22 h,用SDS-PAGE电泳分析表达产物。结果显示,有目的蛋白表达,重组蛋白分子量约为32 kD,与预测的分子量一致。大量收集菌体并破碎、离心,分别取等量全蛋白、上清和沉淀,通过SDS-PAGE检测目的蛋白的可溶性。结果(图 4)表明,目的蛋白主要以包涵体的形式存在于沉淀中。

|
| 图 4 pCold I-scFv小量诱导表达蛋白的可溶性检测 M:蛋白质分子量标准;1-3:BL21/pCold I空载体经IPTG诱导后表达细菌总裂解物、裂解物上清、包涵体沉淀;4-6:BL21/pCold I-scFv经IPTG诱导后表达细菌总裂解物、裂解物上清、包涵体沉淀 |
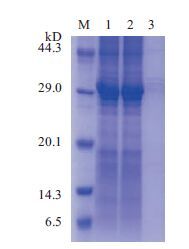
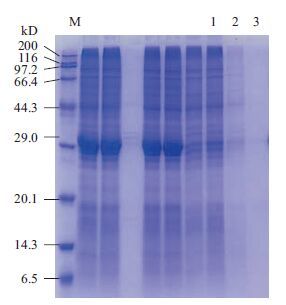
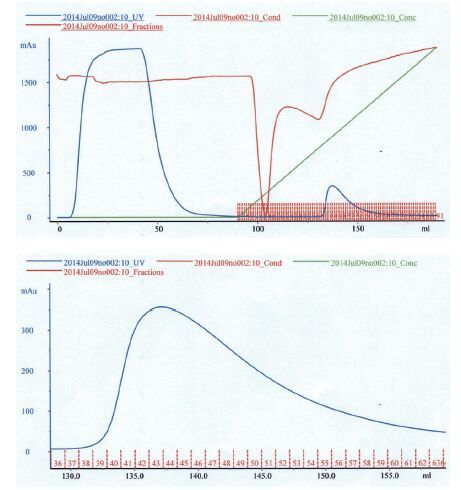
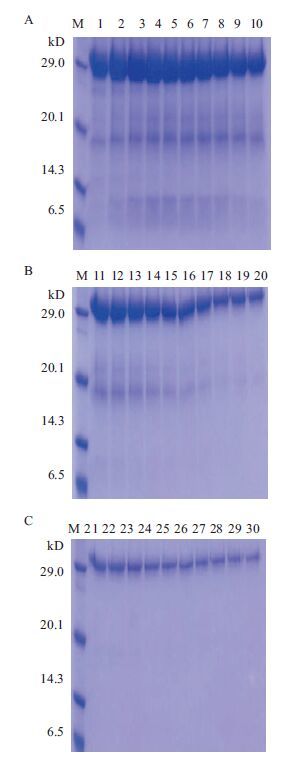
为了获得目的蛋白,本研究将重组质粒pCold I-scFv用终浓度为1 mmol/L的 IPTG 500 mL LB/Amp(50 µg/mL)液体培养基大量诱导表达后,按照1.2.4的方法,使用4 mol/L的尿素对包涵体进行处理,将包涵体蛋白溶出,如图 5所示,经处理后,目的蛋白都溶解于上清液中。表达的目的蛋白羧基端含组氨酸标签,因此考虑利用亲和柱分离目的蛋白,GE HiTrap TALON crude,5 mL TALON Superflow层析介质含有Co2+离子四配位螯合基团,其与琼脂糖微球高度交联。这种层析介质高选择性结合含有组氨酸标签的蛋白,低亲和性结合宿主蛋白,从而提供更低的纯化背景。变性状态的目的蛋白使用0.45 µmol/L 的过滤膜过滤后,用GE HiTrap TALON crude,5 mL TALON Superflow 进行柱层析纯化。纯化过程中,将GE HiTrap TALON crude,5 mL TALON Superflow层析柱与AKTA prime Plus机器相连接,使用AKTA prime Plus机器进行层析柱的上样,待样品流穿后,用20倍柱体积的Buffer A在低咪唑浓度下洗3次柱,充分除去非特异结合的蛋白,3次清洗状态如图 6所示。之后使用AKTA prime Plus机器将10倍柱体积的Buffer A和10倍柱体积的Buffer B缓慢混合,混合的过程中咪唑的浓度按线性梯度由5 mmol/L提高到300 mmol/L,目的蛋白在合适的咪唑浓度下洗脱下来。在纯化的过程中AKTA prime Plus的自动收集盘对洗脱样品进行收集,每1.1 mL收集一管。由AKTA prime Plus的出峰情况(图 7)可以看出,目的蛋白从第40管开始大量溶出,从第40-69管中各取5 µL样品,进行15% SDS-PAGE凝胶电泳,检测目的样本的分布,结果如图 8所示。
|
| 图 5 包涵体溶出后SDS-PAGE电泳检测 M:蛋白质分子量标准;1-3:4 mol/L尿素溶解细菌后总裂解物、裂解物上清、包涵体沉淀 |
|
| 图 6 非目的蛋白洗脱情况分析 M:蛋白质分子量标准;1-3:第一次、第二次、第三次洗柱后洗液1、2、3 |
|
| 图 7 pCold I-scFv蛋白溶出 |
|
| 图 8 目的蛋白梯度洗脱液情况分析 M:蛋白质分子量标准;1-30:第40-69管目的蛋白洗脱液 |
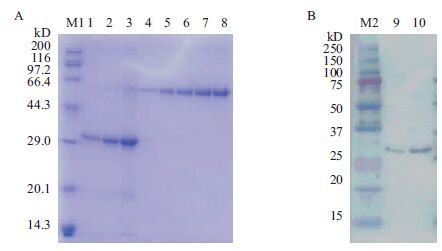
收集目的蛋白第40-69管共计约34.1 mL。使用收集样品20倍量的PBS在4℃对蛋白进行3次透析。前2次 2 h/次,第3次过夜透析,透析过程中未见絮状沉淀,透析后也未见沉淀产生,证明复性成功。复性后共收集样品32 mL,取少量复性后蛋白进行SDS-PAGE电泳,结果如图 9-A所示;取少量复性后蛋白进行Western blot检测,结果如图 9-B所示。使用ImageMaster 1D version 3.0解析软件根据定量蛋白BSA进行定量分析,分析结果显示目的蛋白的浓度为0.16 mg/mL,目的蛋白的纯度为98%。32 mL透析后的目的蛋白总量为5.12 mg,蛋白收率为10 mg/L菌体。
|
| 图 9 pCold I-scFv蛋白的透析(A)及Western blot检测(B) M1:蛋白质分子量标准;M2:彩色蛋白质分子量标准;1-3:纯化后蛋白2、4和8 μL上样;4-8:定量标准BSA200、400、600、800和1 000 ng;9,10:纯化后蛋白0.1 μL和0.2 μL上样转PVDF膜 |
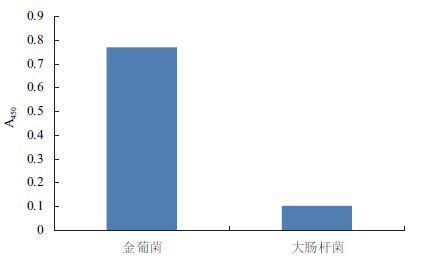
实验以大肠杆菌为阴性对照,使用蛋白上带有的his标签对应的一抗和二抗检测可溶性蛋白与金黄色葡萄球菌(金葡菌)抗原及大肠杆菌的结合能力。间接ELISA的结果(图 10)显示,pCold I -scFv蛋白与金黄色葡萄球菌抗原的结合能力明显高于与大肠杆菌的结合能力,说明通过原核表达及纯化、透析得到的是有金黄色葡萄球菌生物活性的目的蛋白。
|
| 图 10 pCold I-scFv蛋白ELISA检测 |
IgY抗体是一种具有较大应用潜力的抗体,目前,已有大量添加IgY的产品,如发酵酸奶、卫生消毒产品、功能性食品及化妆品等上市销售[9, 10]。IgY可应用于医疗诊断及治疗,通过临床验证也显示出良好效果[11-20]。虽然IgY抗体有着较大的应用潜力,但是传统的制备IgY抗体的方法特异性抗体的得率较低、纯化也比较复杂;随着生物科学的发展,采用基因工程方法制备IgY单链抗体的技术应运而生,通过体外表达的方式得到具有商业应用价值的单链抗体也成为众多研究者追捧的目标。
大肠杆菌原核表达系统具有繁殖快、遗传背景清楚、表达效率高等优点,是目前应用最广泛的蛋白表达系统。金黄色葡萄球菌是一种特别常见的人畜共患菌,目前鲜有使用原核表达系统表达金黄色葡萄球菌IgY单链抗体的报道。本研究通过选择合适的表达载体pCold I及低温诱导培养条件,实现了scFv单链抗体的高表达,表达的重组抗体蛋白主要以包涵体形式存在。包涵体通过离心容易收集,有利于分离纯化;包涵体能够保护蛋白免受蛋白酶的水解;目的蛋白以无活性的包涵体形式表达,不会影响宿主菌生长。本研究使用4 mol/L尿素成功地将包涵体溶出,溶出的蛋白通过TALON树脂进一步亲和纯化得到了较高纯度的目的蛋白。TALON树脂以Co2+作为螯合金属,与传统的以Ni2+作为螯合金属的树脂相比,其结构更规则,结合能力更强,故使用TALON树脂比通常以Ni2+作为螯合金属的树脂纯化效果更好。
溶出蛋白质的复性也是特别关键的一个步骤,因此复性方法的选择就显得尤为重要。透析法操作简单、不增加蛋白质的体积,通过逐渐降低外透液的浓度来控制变性剂的去除速度,使蛋白质呈现生物活性[21-23]。本研究选择透析法进行蛋白复性,将从TALON树脂中溶出的蛋白溶液置于SnakeSkin Pleated Dialysis Tubing 3500 MWCO透析膜内,透析过程中未见絮状沉淀,透析后也无沉淀产生,证明复性成功。复性后的目的蛋白浓度为0.16 mg/mL,纯度为98%。体外抗体活性测定显示,纯化的重组蛋白在0.016 mg/mL时就表现出良好的金黄色葡萄球菌抗原的结合能力,说明重组蛋白具有良好的金黄色葡萄球菌抗体活性。
本研究通过大肠杆菌原核表达系统以及摇瓶培养,获得了纯化收率为10 mg/L菌体、纯度为98%的有活性的scFv单链抗体蛋白。其方法具有成本低、产率高、纯度高、技术路线简单的优势,不仅为规模化制备scFv单链抗体提供了宝贵的技术路线,为金黄色葡萄球菌IgY抗体蛋白进一步的功能和应用研究奠定了基础,同时也为大肠杆菌生产其它重组小分子抗体提供了有价值的参考。
4 结论本研究通过质粒构建及大肠杆菌原核表达的方法,获得了以包涵体形式存在的金黄色葡萄球菌抗体蛋白,此包涵体经4 mol/L尿素成功溶出,使用透析法对蛋白进行复性之后,经ELISA鉴定证实所表达的蛋白具有金黄色葡萄球菌抗体活性。
| [1] | Yacoby I. Drug carrying bacteriophages[D]. Senate of Tel-Aviv University, 2007. |
| [2] | Bamberger DM, Boyd SE. Management of Staphylococcus aureus infections. Am Fam Physician , 2005 (72) : 2474–2481. |
| [3] | Chambers HF, Deleo FR. Waves of resistance:Staphylococcus aureus in the antibiotic era. Nat Rev Microbiol , 2009 (7) : 629–641. |
| [4] | Xu YP, Li XY, Jin LJ, et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases:A review. Biotechnol Adv , 2011 (29) : 860–868. |
| [5] | Akashi K, Eto T, Shibuya T, et al. Aclarubicin induces differentiation of leukemic progenitors in myelodysplatic syndrome cooperating with granulocyte colony-stimulating factor. Leuk Res , 2000, 24 (3) : 243–248. DOI:10.1016/S0145-2126(99)00175-7 |
| [6] | 钟济华, 陈芳源, 王海嵘, 等. CAG方案对急性髓系白血病细胞作用机制的研究. 中华血液学杂志 , 2006, 77 (7) : 492–494. |
| [7] | Bai A, Kima H, Hori M, et al. Priming with G-CSF effectively enhances low-dose Ara-C-induced in vivo apoptosis in myeloid leukemia cells. Exp Hematol , 1999, 27 (2) : 259–265. DOI:10.1016/S0301-472X(98)00041-1 |
| [8] | Li JQ, Xu YP, Li XY, et al. Construction and characterization of a highly reactive chicken-derived single-chain variable fragment(scFv)antibody against Staphylococcus aureus developedwith the T7 phage display system. International Immunopharmacology , 2016, 35 : 149–154. DOI:10.1016/j.intimp.2016.02.024 |
| [9] | Hofie K, Hofie N, Abdou AM, et al. Suppressive effect of function at drinking yogurt containing specific egg yolk immunoglobulin on helicon bacterpy lorri in humans. J Dairy Sci , 2004, 87 (12) : 4073–4079. DOI:10.3168/jds.S0022-0302(04)73549-3 |
| [10] | 王永明. 百贝宁治疗要幼儿轮状病毒性肠炎疗效观察. 中国实用医药 , 2008, 3 (19) : 92. |
| [11] | Silva WDD, Tambourgi DV. IgY:A promising antibody for use in immunodiagnostic and in immunotherapy. Veterinary Immunology and Immunopathology , 2010, 135 : 3–4. |
| [12] | Bellingeri RV, Busso L, Alustiza FE, et al. Characterization of egg yolk immunoglobulin(IgY)against enterotoxigenic Escherichia coli and evaluation of its effects on bovine intestinal cells. African Journal of Microbiology Research , 2013, 7 (5) : 398–405. DOI:10.5897/AJMR |
| [13] | Kammilaa S, Dasa D, Bhatnagara PK, et al. A rapid point of care immunoswab assay for SARA-COV detection. J Virol Methods , 2008, 52 (12) : 284. |
| [14] | Zhang XY, Kurth A, Pauly D, et al. Application of high titred IgY antibodies in ortopox virus diagnostics. China Pharm Sei , 2008, 17 (3) : 183–191. |
| [15] | 杨军, 张明娟, 强磊, 等. 抗HPV l6LI IgY抗体的制备及活性检测. 南方医科大学学报 , 2008, 28 (3) : 324–327. |
| [16] | 陈晓勇, 丁务高, 傅颖媛, 等. 抗白色假丝酵母菌IgY的应用研究. 中国实用妇科与产科杂志 , 2007, 23 (12) : 929–931. |
| [17] | 郑平, 孙先军, 郭字红, 等. 抗轮状病毒免疫球蛋白治疗婴幼儿轮状病毒肠炎疗效观. 中国妇幼保健 , 2007, 22 (29) : 4108–4109. |
| [18] | 张明娟, 杨军, 葛蘅, 等. 抗哇巴因鸡蛋黄IgY与兔抗体IgG在酶联免疫检测中的比较. 中国应用理学杂志 , 2007, 23 (4) : 505–507. |
| [19] | Xiao Y, Gao X, Gannot G, et al. Quantilation of HER2 and telomerase biomarkers in solid tumors with IgY antibodies and nanocrystal detection. Int J Cancer , 2008, 122 (10) : 2178–2186. DOI:10.1002/ijc.23320 |
| [20] | Xiao Y, Gao X, Taratula O, et al. Anti-HER2 IgY antibody-functionalized single-walled carbon nanotubes for detection and selective destruction of breast cancer cells. BMC Cancer , 2009, 9 (10) : 351. |
| [21] | Ramos OH, Carmona AK, Selistre-de-Araujo HS. Expression, refolding, and invitro activation of a recombinant snake venom pro-metalloprotease. Protein Express Purif , 2003, 28 (1) : 34–41. DOI:10.1016/S1046-5928(02)00644-7 |
| [22] | 付明娟, 林接玉, 谢捷明. 包涵体蛋白复性的研究进展. 医学综述 , 2015, 20 : 3657–3659. |
| [23] | 张素芬, 齐永, 潘英, 等. 肺炎衣原体外膜蛋白Omp85的重组表达及其复性条件研究. 药物生物技术 , 2015, 5 : 392–395. |




