2. 宁德市富发水产有限公司, 宁德 352103;
3. 漳州市水产技术推广站, 漳州 363000;
4. 福建农林大学动物科学学院, 福州 350002
2. Ningde Fufa Fisheries Company Limited, Ningde 352103;
3. Fisheries Technical Extension Station of Zhangzhou, Zhangzhou 363000;
4. College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou 350002
细胞周期是细胞生命活动的重要特征之一,受到细胞周期蛋白(cyclin)、周期蛋白依赖性激酶(cyclin dependent kinase,CDK)等因子的调控,而CDKs的活性受到细胞周期蛋白依赖性激酶抑制因子(CDK inhibitor,CKI)、细胞周期蛋白激酶活化激酶(CDK activating kinase,CAK)以及细胞周期蛋白依赖性激酶调节亚基(Cyclin kinase subunit,CKS)的调控[1]。CKS1是细胞周期调节蛋白CKS/Suc1家族成员之一,在序列上高度保守,在细胞周期中通过与CDKs结合参与调控真核生物的细胞分裂[2]。CDC28蛋白激酶调节亚基1B(CDC28 protein kinase regulatory subunit 1B,CKS1B)是CKS1家族成员之一,在细胞周期中参与组成泛素连接酶SCFSKP2-CKS1复合物,进行泛素化降解细胞周期蛋白抑制因子p27kip1,使细胞周期从G1期顺利向S期转换,为后续细胞分裂做准备[3, 4]。Reynard等[5]研究表明CKS1在细胞分裂G1期和M期均具有重要作用。Westbrook等[6]在CKS1参与乳腺癌细胞调控机制的研究中发现,减少雌激素的分泌会导致CKS1表达水平降低,而使癌细胞停滞于G1期,进一步敲除CKS1基因后,CDK1的表达亦相应减少,使细胞分裂难以进入M期。Demetrick等[7]研究表明CKS1在生殖细胞减数分裂第一次分裂中期向后期转换过程中具有重要的作用。因此,CKS1是细胞有丝分裂和减数分裂的一个重要的调节因子。
目前关于甲壳动物生殖内分泌调节系统的研究已发展成为其内分泌学研究的一个学术热点。拟穴青蟹(Scylla paramamosain)是我国东南沿海的一种重要的经济养殖蟹类,与其他蟹类相比,具有个体较大、生长较快、肉鲜味美、营养价值高等特点,深受广大消费者喜爱,在我国水产养殖中具有重要的地位[8]。目前研究拟穴青蟹性腺发育的调控机制已深入到分子水平,而关于CKS1在甲壳动物性腺发育中的研究尚未见到报道。因此,本研究首次在甲壳动物中成功克隆出拟穴青蟹CKS1B(命名为Sp-CKS1B)基因的全长cDNA序列[9],并检测其在不同组织以及性腺发育过程中的差异表达,以期在分子水平上为研究CKS1家族基因参与甲壳动物性腺发育的调控机制提供参考资料。
1 材料与方法 1.1 材料所用拟穴青蟹采自厦门农贸市场,结合性腺的外部形态、性腺发育指数[10]及组织学特征[11, 12],将卵巢分为5个时期,精巢分为3个时期,每个性腺发育时期的个体数选取3只以上,并选取5只以上O5期雌蟹个体的组织用于测定组织差异表达分析。
1.2 方法利用RDP试剂[13]及RNA提取方法提取拟穴青蟹各样品总RNA。根据前期获得的Sp-CKS1B基因片段,利用Primer5.0软件,设计其5' RACE和3' RACE引物,克隆全长cDNA序列,采用NCBI数据库中VecScreen、Blast、ORF Finder以及PI、SWISS-MODEL、MEGA 4.0等软件对其序列进行生物信息学分析。以随机引物介导合成反转录cDNA第一条链,以18S rRNA[14]为参照基因,采用qRT-PCR技术,检测其在不同组织及性腺不同发育阶段的表达水平。
1.3 数据分析根据qRT-PCR技术所得的RQ值,利用SPSS 15.0软件对其进行样本T-检验分析,所用数据用平均值±标准误(x±s)来表示,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果 2.1 Sp-CKS1B全长cDNA的克隆与序列分析以拟穴青蟹的性腺EST[15]文库筛选到的CKS1B基因片段为基础,通过SMART-RACE技术成功克隆出Sp-CKS1B基因的全长cDNA序列,基因登录号为FJ623275。如图 1所示,Sp-CKS1B的全长cDNA序列722 bp,其中5' UTR为82 bp,3' UTR 为379 bp,开放阅读框261 bp编码86个氨基酸。推导的蛋白分子量为10.5 kD,pI 6.27。BLAST比对结果显示,其与大多数物种的CKS1具有70%以上的一致性,结构域分析显示其包含典型的CKS保守序列(I5-T73),属于CKS1家族蛋白。

|
| 图 1 拟穴青蟹CKS1B cDNA及其氨基酸序列 方框部分为5' RACE引物,双下划线为3' RACE引物,氨基酸粗体部分表示典型的CKS保守序列,波浪线表示决定CKS蛋白折叠方式的保守β区域;*表示终止密码子 |
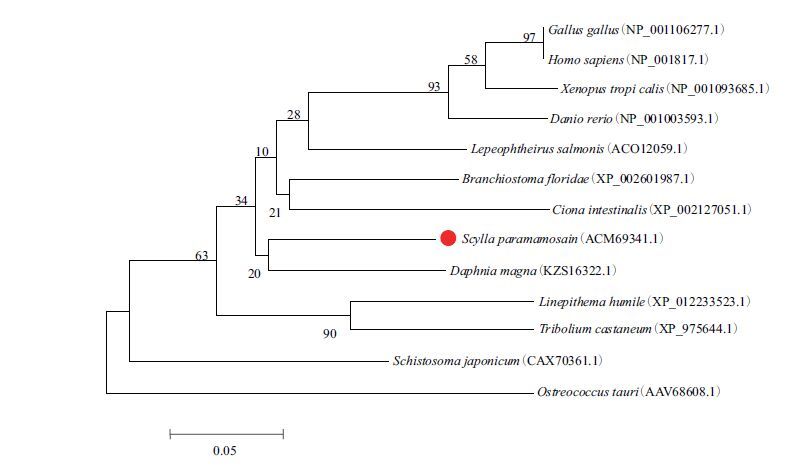
根据NCBI数据库中不同物种的CKS1B蛋白序列,以Mega 4.0软件的邻接法将拟穴青蟹Sp-CKS1B推导的氨基酸序列与其他物种的CKS1B氨基酸序列进行多重比对,构建Sp-CKS1B系统进化树。结果(图 2)显示,脊椎动物、脊索动物、甲壳类、昆虫类各自形成一簇,绿藻(Ostreococcus tauri)处于系统进化树的最外围,拟穴青蟹Sp-CKS1B与淡水甲壳动物大型溞(Daphnia magna)聚为一枝,位于脊椎动物、脊索动物、昆虫类的中间。
|
| 图 2 基于邻位相接法构建的系统进化树 |
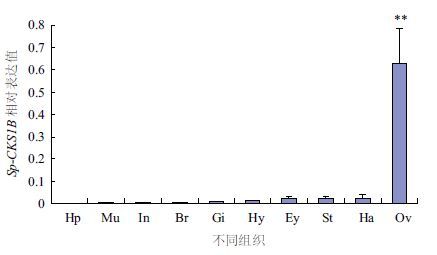
利用qRT-PCR技术得出的组织差异表达结果(图 3)显示,Sp-CKS1B 基因在O5期雌蟹卵巢中的表达水平最高,并与其他各组织的表达水平具有极显著差异(P<0.01),其次为血淋巴、胃以及眼柄中的表达,表达最低值出现在肝胰腺。卵巢以外其他各组织间的表达无显著性差异(P>0.05)。
|
| 图 3 Sp-CKS1B基因在O5期雌蟹不同组织间的表达 Hp:肝胰腺;Mu:肌肉;In:肠;Br:脑;Gi:鳃;He:心;Ey:眼柄;St:胃;Ha:血淋巴;Ov:卵巢。**表示差异极显著(P<0.01) |
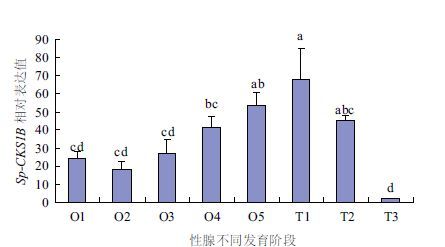
如图 4所示,在拟穴青蟹性腺的不同发育阶段中,Sp-CKS1B 基因在精巢T3期的表达量最低,并显著低于T1、T2以及卵巢O4、O5期的表达水平(P<0.05);而在精巢T1期的表达量最高,O5期的表达水平紧随其后,二者与卵巢O1-O4期的表达水平具有显著性差异(P<0.05);O1-O3期以及T3期之间的表达水平无明显差异(P>0.05)。
|
| 图 4 Sp-CKS1B基因在性腺发育各时期的表达 O1:增殖期;O2:卵黄生成前期;O3:卵黄生成早期;O4:卵黄生成中期;O5:卵黄生成晚期;T1:精母细胞期;T2:精子细胞期;T3:成熟精子期。柱上字母不同表示差异显著(P<0.05) |
细胞周期是细胞生命活动的基本形式,通过对细胞周期调控因子的深入研究是目前研究配子细胞的发生与成熟的一大热点。CKS1是一种序列高度保守的细胞周期调节蛋白,属于CKS/Suc1家族[16],作为CDKs的调节亚基,为CDKs功能活性所必须,在细胞周期过程中起着重要的调控作用。CKS1B是CKS1的家族成员之一,主要参与合成泛素连接酶SCFSKP2-CKS1复合物,对于CDKs的功能抑制因子p27起着泛素化降解作用,从而促进细胞周期顺利进入S期[3, 4],为后续细胞分裂周期做准备。对不同物种CKS1B的序列与结构进行分析有助于更好地了解其功能的作用机制。本研究首次在甲壳动物中克隆出Sp-CKS1B的全长cDNA序列,通过比对分析显示其序列中包含1个典型的CKS保守区域(I5-T73),属于CKS1家族成员,其序列中存在一个高度保守的“HXPEPH”序列的β区域,该区域决定CKS蛋白的折叠方式[9]。Richardson等[17]率先从人的身上克隆出CKS1基因,其研究表明CKS1从酵母到人的一致性较高,高达81%,Bourne等[18]研究结果表明大部分物种的CKS1蛋白分子结构也存在较高的相似性。本研究通过对Sp-CKS1B的序列进行BLAST比对分析,结果显示其序列在不同物种中高度保守,与大部分物种的CKS1均有70%以上的一致性,特别是与淡水甲壳动物大型溞(Daphnia magna)CKS1的一致性最高,达88%,而与人的CKS1B序列(基因登录号:EU176487.1)一致性亦为79%,序列与结构的高度保守反映了其在细胞周期过程中可能具有相似且十分重要的生物学功能。
CKS在细胞周期中的调节作用已被广大研究者所熟知[19-21],高等真核生物的CKS家族有2个成员:CKS1和CKS2,它们都是通过结合CDKs促进CDKs功能活性,从而参与调控细胞周期[22]。本研究对Sp-CKS1B在O5期雌蟹不同组织间的表达水平结果(图 3)显示,Sp-CKS1B基因在卵巢中的表达量最高,并与其他各组织具有极显著差异(P<0.01),这与前期关于Sp-Ub[10]、Sp-SUMO1[12]、Sp-CDK1[14]等细胞周期相关蛋白基因在拟穴青蟹不同组织间的差异表达相一致,研究表明细胞周期相关激酶CDK1和泛素降解系统相关Ub以及SUMO基因在拟穴青蟹卵巢中的表达极显著高于其他各组织。CDK1是细胞分裂过程中G1/S期以及G2/M期转换的重要调节因子[23, 24],泛素蛋白酶体降解途径(UPP)是真核生物细胞内的一种重要的蛋白降解途径,细胞中有超过80%的蛋白须通过UPP进行降解以完成细胞分裂[1],Sp-CKS1B与这些基因在卵巢中相同模式的高表达,可能是由于O5期卵巢中的细胞分裂次数较多,且临近排卵期,卵母细胞不断成熟、体积不断膨胀[11],可能需要活化众多的CDKs和降解细胞周期相关蛋白以完成细胞分裂,因而它的表达水平相比其他组织处于较高的水平。
进一步,本研究通过对拟穴青蟹性腺不同发育时期Sp-CKS1B的差异表达结果(图 4)发现,Sp-CKS1B在性腺各个时期均有表达,其表达值最高出现在精巢T1期,其次为O5期,二者与卵巢O1-O4期的表达水平具有显著性差异(P<0.05);而在精巢T3期的表达量最低,并与精巢T1、T2期以及卵巢O4、O5期的表达水平具有显著性差异(P<0.05)。其中Sp-CKS1B在卵巢中的表达呈一定的梯度增加现象,而在精巢的表达却呈相反趋势,可能是由卵巢[11]和精巢[25, 26]发育调节机制的差异引起。在卵巢发育过程中,Sp-CKS1B在O1-O4期的表达未有显著性差异,至O5期达到最高值,并与O1-O3期具有显著性差异,这与Sp-CDK1[14]在拟穴青蟹卵巢中的表达有所区别,而与Sp-Ub[10]的表达模式一致。CDK1在细胞周期各时相转换过程中均有普遍功能,CDK1/cyclinA结合可使细胞顺利通过G2期,并参与了G2/M期的过渡期,CDK1/cyclinB复合物可促进细胞进出M期[1, 23, 24],其在卵巢中的表达具有较为广泛的分布;Ub是真核细胞中普遍存在的小分子蛋白,参与了细胞内绝大多数的泛素化降解[1]。Sp-CKS1B的表达并不仅仅作用于CDK1,其在卵子发生中后期显著提高可能是由于拟穴青蟹卵巢发育过程中,其卵子细胞不断增多,细胞分裂旺盛,成熟卵黄蛋白积累增加[27, 28],促进其细胞直径也不断膨胀[11],所需的CKS亦会相应增加,故而其表达量会有所增加。
本研究中Sp-CKS1B在精巢发育过程中呈现递减趋势,与Sp-CDK1[14]和Sp-Ub[10]的表达模式相似。Spruck等[29]对小鼠生殖细胞发生过程的调控机制研究中发现,如缺失CKS2基因将导致减数分裂Ⅰ期难以向后期转换;Tang等[30]研究发现CDK偶联的CKS1在G1和G2期均发挥着重要的作用;Reynard等[5]的研究发现,芽殖酵母Cks1可促进细胞周期G1期与M期中的CDKs-cyclins复合物功能活性的激活;Rother等[31]的研究结果发现Cks1在晚G1期开始表达,至S/G2期达到最高;Krishnan等[32]通过氟西汀处理肿瘤细胞的研究发现CKS1与cyclinA的表达水平具有同步下调现象,使肿瘤细胞停滞于G0/G1期,这些研究成果为进一步解释Sp-CKS1B在精巢中的差异表达提供了理论依据。本研究结果中Sp-CKS1B在精巢T1期的表达水平最高,在T3期的表达量最低,可能是由于精巢发育过程中,前期T1-T2期精原细胞不断变态发育为精子细胞,生精细胞的细胞分裂旺盛,CKS1B的表达量增高可促进更多的CDKs/cyclins复合物功能的活化[5, 6],并促进众多蛋白通过泛素化途径降解[2, 3],促进细胞分裂次数急剧增加,因而导致表达量增多;而T3期的成熟细胞数量不断增多,形成了较多的生殖带[25, 26],处于细胞分裂周期中的细胞比例较少,因而其表达水平最低。
4 结论本研究首次克隆出拟穴青蟹Sp-CKS1B的全长cDNA序列,BLAST比对拼接显示其序列具有保守的CKS结构域,属于CKS1家族。通过对其在不同组织以及性腺不同发育阶段的差异表达研究表明,Sp-CKS1B在卵巢中的表达量最高,并与其他组织具有极显著差异;而在性腺不同发育阶段的表达分布并不一致,显示Sp-CKS1B对拟穴青蟹性腺发育及生殖细胞的发生与成熟具有重要的调节作用。
| [1] | 韩坤煌, 张子平, 王艺磊, 等. Cyclin-CDK-CKI 及 UPP 参与生殖调控及在甲壳动物性腺发育中的研究进展. 生物技术通报 , 2010 (7) : 48–54. |
| [2] | Ganoth D, Bornstein G, Ko TK, et al. The cell cycle regulatory protein Cks1 is required for SCF(Skp2)-mediated ubiquitinylation of p27. Nat Cell Biol , 2001, 3 : 321–324. DOI:10.1038/35060126 |
| [3] | Spruck C, Strohmaier H, Watson M, et al. A CDK-independent function of mammalian Cks1:targeting of SCF(Skp2)to the CDK inhibitor p27Kip1. Mol Cell , 2001, 7 (3) : 639–650. DOI:10.1016/S1097-2765(01)00210-6 |
| [4] | Uehara N, Yoshizawa K, Tsubura A. Vorinostat enhances protein stability of p27 and p21 through negative regulation of Skp2 and Cks1 in human breast cancer cells. Oncol Rep , 2012, 28 (1) : 105–110. |
| [5] | Reynard GJ, Reynolds W, Verma R, et al. Cks1 is required for G(1)cyclin-cyclin-dependent kinase activity in budding yeast. Mol Cell Biol , 2000, 20 (16) : 5858–5864. DOI:10.1128/MCB.20.16.5858-5864.2000 |
| [6] | Westbrook L, Manuvakhova M, Kern FG, et al. Cks1 regulates cdk1 expression:a novel role during mitotic entry in breast cancer cells. Cancer Res , 2007, 67 (23) : 11393–11401. |
| [7] | Demetrick DJ, Zhang H, Beach DH. Chromosomal mapping of the human genes CKS1 to 8q21 and CKS2 to 9q22. Cytogenet Cell Genet , 1996, 73 (3) : 250–254. DOI:10.1159/000134349 |
| [8] | Ye HH, Tao Y, Wang GZ, et al. Experimental nursery culture of the mud crab Scylla paramamosain(Estam-pador)in China. Aqucult Int , 2011, 19 (2) : 313–321. DOI:10.1007/s10499-010-9399-3 |
| [9] | 韩坤煌. 拟穴青蟹细胞周期及泛素系统若干基因参与性腺发育的研究[D]. 厦门:集美大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10390-1014165118.htm |
| [10] | 戴燕彬, 韩坤煌, 颜素芬, 等. 拟穴青蟹泛素基因的克隆及其在性腺发育过程中的表达. 中国水产科学 , 2012, 19 (6) : 946–955. |
| [11] | Islam M, Kodama K, Kurokura H. Ovarian development of the mud crab Scylla paramamosain in a tropical mangrove swamp, Thailand. J Sci Res , 2010, 2 (2) : 380–389. |
| [12] | Dai Y, Han K, Zou Z, et al. SUMO-1 of mud crab(Scylla paramamosain)in gametogenesis. Gene , 2012, 503 (2) : 260–268. DOI:10.1016/j.gene.2012.04.056 |
| [13] | Zhang Z, Wu RS, Mok HO, et al. Isolation, characterization and expression analysis of a hypoxia-responsive glucose transporter gene from the grass carp, Ctenopharyngodon idellus. Eur J Biochem , 2003, 270 (14) : 3010–3017. DOI:10.1046/j.1432-1033.2003.03678.x |
| [14] | Han K, Dai Y, Zou Z, et al. Molecular characterization and expression profiles of cdc2 and cyclin B during oogenesis and spermatogenesis in green mud crab(Scylla paramamosain). Comp Biochem Physiol B Biochem Mol Biol , 2012, 163 (3-4) : 292–302. DOI:10.1016/j.cbpb.2012.07.001 |
| [15] | Zou Z, Zhang Z, Wang Y, et al. EST analysis on the gonad development related organs and microarray screen for differentially expressed genes in mature ovary and testis of Scylla paramamosain. Comp Biochem Physiol Part D Genomics Proteomics , 2011, 6 (2) : 150–157. DOI:10.1016/j.cbd.2010.12.003 |
| [16] | Pines J. Cell cycle:reaching for a role for the Cks proteins. Curr Biol , 1996, 6 (11) : 1399–1402. DOI:10.1016/S0960-9822(96)00741-5 |
| [17] | Richardson HE, Stueland CS, Thomas J, et al. Human cDNA encoding homologs of the small p342Cdc28/Cdc2 associated protein of Saccharomyces cerevisiae and Schizosaccharomyces pombe. Genes Dev , 1990, 4 : 1332–1344. DOI:10.1101/gad.4.8.1332 |
| [18] | Bourne Y, Watson MH, Arvai AS, et al. Crystal structure and mutational analysis of the Saccharomyces cerevisiae cell cycle regulatory protein Cks1:implications for domain swapping, anion binding and protein interactions. Structure , 2000, 8 (8) : 841–850. DOI:10.1016/S0969-2126(00)00175-1 |
| [19] | Egan EA, Solomon MJ. Cyclin-stimulated binding of Cks proteins to cyclin-dependent kinases. Mol Cell Biol , 1998, 18 (7) : 3659–3667. DOI:10.1128/MCB.18.7.3659 |
| [20] | Spruck C, Strohmaier H, Watson M, et al. A CDK-independent function of mammalian Cks1:targeting of SCF(Skp2)to the CDK inhibitor p27Kip1. Mol Cell , 2001, 7 (3) : 639–650. DOI:10.1016/S1097-2765(01)00210-6 |
| [21] | Ganoth D, Bornstein G, Ko TK, et al. The cell-cycle regulatory protein Cks1 is required for SCF(Skp2)-mediated ubiquitinyla-tion of p27. Nat Cell Biol , 2001, 3 (3) : 321–324. DOI:10.1038/35060126 |
| [22] | Martinsson-Ahlzén HS, Liberal V, Grünenfelder B, et al. Cyclin-dependent kinase-associated proteins Cks1 and Cks2 are essential during early embryogenesis and for cell cycle progression in somatic cells. Mol Cell Biol , 2008, 28 (18) : 5698–5709. |
| [23] | Chesnel F, Bazile F, Pascal A, et al. Cyclin B dissociation from CDK1 precedes its degradation upon MPF inactivation in mitotic extracts of Xenopus laevis embryos. Cell Cycle , 2006, 5 (15) : 1687–1698. DOI:10.4161/cc.5.15.3123 |
| [24] | Murray A, Hunt T. The Cell Cycle:An Introduction[M]. New York: Oxford University Press, 1993. |
| [25] | 王艺磊, 张子平, 李少菁. 锯缘青蟹精子发生的超微结构. 动物学报 , 1997, 43 (3) : 249–254. |
| [26] | 叶海辉, 李少菁, 黄辉洋, 等. 锯缘青蟹精巢发育的组织学观察. 动物学研究 , 2002, 23 (2) : 141–144. |
| [27] | Tsukimura B. Crustacean vitellogenesis:its role in oocyte development. Am Zool , 2001, 41 (3) : 465–476. |
| [28] | Subramoniam T. Mechanisms and control of vitellogenesis in crustaceans. Fish Sci , 2011, 77 (1) : 1–21. DOI:10.1007/s12562-010-0301-z |
| [29] | Spruck CH, de Miguel MP, Smith AP, et al. Requirement of Cks2 for the first metaphase / anaphase transition of mammalian meiosis. Science , 2003, 300 (5619) : 647–650. DOI:10.1126/science.1084149 |
| [30] | Tang Y, Reed SI. The Cdk-associated protein Cks1 functions both in G1 and G2 in Saccharomyces cerevisiae. Genes Dev , 1993, 7 (5) : 822–832. DOI:10.1101/gad.7.5.822 |
| [31] | Rother K, Li YY, Tsch?p K, et al. Expression of cyclin-dependent kinase subunit 1(Cks1)is regulated during the cell cycle by a CDE/CHR tandem element and is downregulated by p53 but not by p63 or p73. Cell Cycle , 2007, 6 (7) : 853–862. DOI:10.4161/cc.6.7.4017 |
| [32] | Krishnan A, Hariharan R, Nair SA, et al. Fluoxetine mediates G0/G1 arrest by inducing functional inhibition of cyclin dependent kinase subunit(CKS)1. Biochem Pharmacol , 2008, 75 (10) : 1924–1934. DOI:10.1016/j.bcp.2008.02.013 |




