2. 福建农林大学动物科学学院, 福州 350002
2. College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou 350002
当机体受到外源物质侵染后,抗原通过主要组织相容性复合体(MHC)上的抗原呈递细胞(APCs)与T淋巴细胞受体(TCR)结合,并以非共价形式与CD3形成复合物。在TCR/CD3复合物中,CD3分子由1条γ链、1条δ链、2条ε链及2条ζ链组成,其中γ、δ和ε链的胞质区分别含有1个免疫受体酪氨酸激活基序(immunoreceptor tyrosine based activation motif,ITAM)位点,而ζ链则含有3个ITAMs[1]。作为非受体酪氨酸激酶Src家族中一员,T淋巴细胞酪氨酸激酶(lymphocyte cell kinase,LCK)具有典型的SH3结构域、SH2结构域以及酪氨酸激酶(TyrKc)结构域,并通过其N端的豆蓮酰化(N-myristoylation)和棕榈醜化(palmitoylation)位点与细胞膜相连接。在TCR与抗原肽/MHC复合物相互作用中,胞质的LCK通过非共价键与CD4或CD8辅助受体胞内区相结合而首先被激活[2]。活化后的LCK可以催化CD3胞质区的ITAMs磷酸化。这些磷酸化的ITAMs提供含有SH2结构的多种激酶的高亲和力的位点,其中ZAP-70与CD3ζ链的ITAMs结合后被激活,从而导致其他信号分子募集并激活,最终引起TCR信号传导的级联反应。因此,LCK对于介导TCR信号转导过程及T细胞的发育、分化、增殖和激活具有十分重要的作用[3]。
硬骨鱼LCK基因克隆与分析的研究已经在红鳍东方鲀(Fugu rubripes)[4]、斑马鱼(Danio rerio)[5]、虹鳟(Oncorhynchus mykiss)[6]、大菱鲆(Scophthalmus maximus)[7]及大西洋庸鲽(Hippogl-ossus hippoglossus L.)[8]中有所报道。蛋白序列比对结果显示鱼类与哺乳动物的LCK结构域高度保守,在哺乳动物中决定LCK基因功能的半胱氨酸和酪氨酸残基也存在于鱼类中,表明其蛋白与蛋白的相互作用类似于哺乳动物[5]。目前,哺乳动物LCK基因功能的研究已经相当深入,但在鱼类的研究中还比较薄弱[3, 9]。最近的研究发现,斑点叉尾鮰(Ictalurus punctatus)重组LCK蛋白能够与T细胞受体CD2、CD4-1以及CD4-2相结合,提示该蛋白具有类似哺乳动物LCK的TCR信号传导功能[9]。另外,Motoko等[10]报道LCK基因可以作为分子标记对日本鳗鲡(Anguilla japonica)T细胞分化和胸腺发育进行研究。
大黄鱼是我国重要的水产经济鱼类,随着近年来养殖规模的不断扩大,高密度养殖模式导致的病害也愈发严重,大大降低了养殖的经济效益[11, 12]。目前,大黄鱼免疫器官的组织结构、发育以及免疫细胞基本类型的研究已有报道,但关于T细胞受体(TCR)信号传导以及T细胞发育分子机制的研究还相当薄弱[13, 14],而LCK基因在雌雄大黄鱼不同组织的表达差异以及胚胎发育过程中的表达变化研究尚未见报道。本研究首次克隆获得了大黄鱼LCK基因(命名为LcLCK)全长cDNA,并利用实时荧光定量PCR(qRT-PCR)技术对该基因在大黄鱼各组织器官和胚胎发育各时期的表达情况进行检测与分析,并且构建LcLCK基因的原核表达载体,在大肠杆菌中进行高效表达,旨为深入研究大黄鱼LcLCK的基因结构和功能,并为大黄鱼T细胞活化的分子机制奠定基础。
1 材料与方法 1.1 材料大黄鱼购自福建省宁德富发水产有限公司,雄鱼和雌鱼的体重分别在300-400 g和500-600 g之间。解剖获得健康大黄鱼各组织器官,分别放入标记好收集管中,液氮冻存后-80℃超低温冰箱保存;分别收集不同发育时期的大黄鱼胚胎,包括多细胞期、囊胚期、原肠期、卵黄栓形成期、眼泡出现期、胚孔关闭期、晶体出现期、肌肉效应期、心跳期、孵出期,同时也收集初孵仔鱼期的大黄鱼。收集标记后放入液氮冻存,之后-80℃超低温冰箱保存。
1.2 方法 1.2.1 总RNA的提取以及cDNA的合成采用Trizol(Invitrogen)法提取大黄鱼总RNA,步骤参照产品说明书。cDNA的合成方法参照姚志刚等[15]方法进行,引物见表 1。
以cDNA为模板,通过PCR扩增LcLCK基因片段(引物LCK-F和LCK-R,见表 1)。PCR产物经纯化后在T4 DNA连接酶的作用下与pMD19-T(TaKaRa)载体连接,随后将重组载体转化到E.coli DH5α感受态细胞中,涂平板后挑选阳性单克隆菌落进行测序。测序结果经BLAST比对分析为大黄鱼LcLCK基因。Primer 5.0软件设计的3'-RACE和5'-RACE引物(表 1),通过PCR扩增基因的全长cDNA序列,开放阅读框(open reading frame,ORF)序列通过head to toe PCR进行验证,引物见表 1。
1.2.3 LcLCK的生物信息学分析测序结果通过NCBI数据库中Blast以及ORF Finder软件进行基因的全长cDNA序列拼接与分析。氨基酸序列的多重比对通过BioEdit(http://www.mbio.ncsu.edu/BioEdit/)软件进行,蛋白的结构域由SMART(http://smart.embl-heidelberg.de/)软件预测,ExPASy(http://cn.expasy.org/tools/pitool.html)用来预测蛋白序列的等电点及分子量,MEGA 6.0软件(Neighbor-Joning法)用来构建系统发育树。
1.2.4 LcLCK基因在各组织及胚胎各发育时期的表达分析LcLCK基因各组织及胚胎各发育时期cDNA模板的制备以及实时荧光定量PCR(qRT-PCR)步骤参照姚志刚等[15]方法进行。LcLCK基因荧光定量特异性引物5'real-LCK和3'real-LCK以及内参基因5'-β-actin和3'-β-actin引物序列,见表 1。不同组织以及不同胚胎发育阶段均取4个平行样品,每个样品的RQ值(即2-ΔΔCT)由仪器分析得出,采用RQ x±s表示相对表达水平,通过SPSS软件对获得的数据进行样本t-检验分析,显著性差异表示为P< 0.05。
1.2.5 原核表达载体pGEX-4T-2-LCK的构建以pMD19-T-LCK-ORF重组质粒为模板进行PCR,取1 μL加入到0.2 mL薄壁PCR反应管中,再依次加入以下PCR反应组分(表 2),扩增条件为:94℃ 5 min;94℃ 30 s,63℃ 30 s,72℃ 1.5 min,35个循环;72℃延伸10 min。获得PCR产物经琼脂糖凝胶(1.5%)检测后进行胶纯化,纯化产物和pGEX-4T-2表达载体分别进行双酶切,限制性内切酶分别为Xho Ⅰ和Sam Ⅰ。经T4 DNA Ligase连接后,转化至E.coli DH5α感受态细胞,从平板固体培养基上挑取单菌落,经扩大培养后进行质粒提取并送测序,将测序正确的重组质粒命名为pGEX-4T-2-LCK。
将重组质粒pGEX-4T-2-LCK转化BL21(DE3)感受态细胞,于摇床37℃过夜培养。按1∶100的接种量培养菌液100 mL,OD600达到0.6左右时进行IPTG诱导,浓度为1.0 mmol/L。37℃诱导6 h后,取1 mL菌液离心后用PBS重悬混匀,加入25 μL上样缓冲液置于PCR仪中95℃ 5 min,温度降至室温后通过SDS-PAGE电泳对重组蛋白的表达情况进行检测。
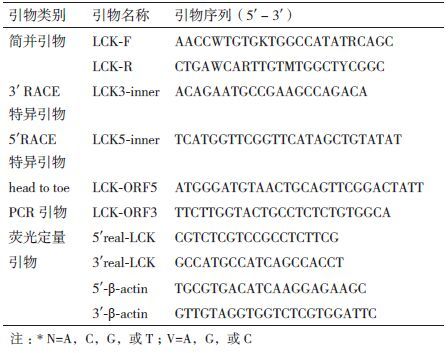
2 结果 2.1 LcLCK基因全长克隆及序列分析以大黄鱼头肾cDNA为模板,PCR扩增获得LCK基因片段长度约为1 000 bp,5'RACE和3' RACE的扩增产物长度分别为430 bp和800 bp,大黄鱼LCK基因开放阅读框(ORF)的PCR扩增结果(图 1)为1 503 bp。LcLCK的全长cDNA序列为2 334 bp(GenBank登录号:JF837184),其中5'非编码区(untranslated region,UTR)为209 bp、3'UTR为594 bp、开放阅读框(ORF)为1 503 bp。该基因编码501个氨基酸,预测蛋白质分子量为57.3 kD,等电点为4.93。
|
| 图 1 LcLCK基因克隆的电泳图谱 M:分子量标准;1:大黄鱼LCK片段;2:大黄鱼LCK基因5' RACE;3:大黄鱼LCK基因3' RACE;4:大黄鱼LCK ORF |
LcLCK氨基酸序列与其他物种LCK氨基酸序列结果(图 2)显示,LcLCK分为SH3、SH2和TyrKc 3个结构域,在N端含有GCXCS和CXXC基序,与其他鱼类和哺乳类动物LCK相似;LcLCK的C端含有2个保守的酪氨酸位点,这与人类LCK基因中的Tyr394和Tyr505相一致。

|
| 图 2 LcLCK和其他物种LCK氨基酸序列的多重比较 左侧物种名称及相应的登录号分别为:Larimichthys crocea(AEL33718.1);Anguilla japonica(BAL48858.1);Danio rerio(NP_001001596.1);Homo sapiens(NP_005347.3);Oncorhynchus mykiss(NP_001118013.1)箭头标注为LCK的SH3、SH2和TyrKc结构域,方框标注为N-端的GCXCS和CXXC基序,黑色底纹标注为C-端的两个酪氨酸(Y)残基 |
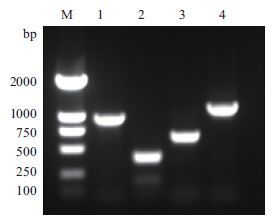
N-J系统发育树(图 3)表明,LcLCK和红鳍东方鲀(Takifugu rubripes)LCK同源性最高,并与其他鱼类LCK聚为一支,另外哺乳类LCK聚为一支,而作为鱼类和哺乳类之间过渡的两栖类单独聚为一支;短爪章鱼(Amphioctopus fangsiao)、非洲爪蟾(Xenopus laevis)LCK分别形成独立分支,与LcLCK距离较远。
|
| 图 3 LcLCK和其他物种LCK氨基酸序列系统发育树(LcLCK用▲标出) 物种名称及相应的登录号分别为:Larimichthys crocea(AEL33718.1);Amazona aestiva(KQK81445.1);Amphioctopus fangsiao(AIR09496.1);Anguilla japonica(BAL48858.1);Bos Taurus(NP_001029506.1);Danio rerio(NP_001001596.1);Homo sapiens(NP_005347.3);Mus musculus(NP_001155904.1);Oncorhynchus mykiss(NP_001118013.1);Salmo salar(NP_001133379.1);Takifugu rubripes(AAL89664.1);Vibrio parahaemolyticus(KWU37833.1);Xenopus laevis(NP_001087088.1) |
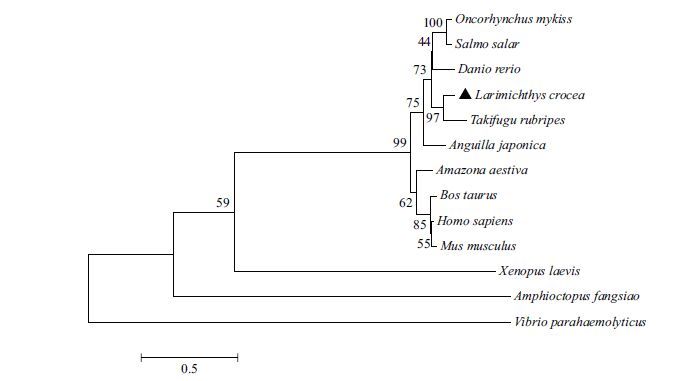
实时荧光定量分析(图 4)表明,LcLCK mRNA在雌性大黄鱼和雄性大黄鱼各组织器官中均有表达,各组织中相对表达量差异较大,脾脏中的表达量最高;雌性鳃、头肾以及雄性鳃、肠中的LcLCK表达量较高;雄性性腺和肠中LcLCK表达量显著高于雌性(P<0.05),而雌性鳃、头肾中LcLCK表达水平则显著高于雄性(P<0.05)。
|
| 图 4 LcLCK在大黄鱼雌雄各组织器官中表达图 *表示雌性和雄性相同组织中表达存在显著性差异(P<0.05);**表示雌性和雄性相同组织中表达存在极显著性差异(P<0.01) |
LcLCK基因在胚胎发育各时期的检测结果(图 5)表明,当胚胎发育处于多细胞期、囊胚期和原肠期时,LcLCK基因有高丰度表达,在囊胚期达到峰值,与其他发育时期的表达量相比差异显著(P<0.05)。LcLCK基因表达水平从卵黄栓形成期开始出现明显下降,随后的眼泡出现期、胚孔关闭期、晶体出现期、尾牙期、心跳期,以及孵出期时LcLCK基因表达水平持续下降,而初孵仔鱼期LcLCK表达水平则有所回升。

|
| 图 5 LcLCK基因在胚胎发育各时期表达 1:多细胞期;2:囊胚期;3:原肠期;4:卵黄栓形成期;5:眼泡出现期;6:胚孔关闭期;7:晶体出现期;8:尾牙期;9:心跳期;10:孵出期;11:初孵仔鱼期;*表示雌性和雄性相同组织中表达存在显著性差异(P<0.05);**表示雌性和雄性相同组织中表达存在极显著性差异(P<0.01) |
将构建成功的pGEX-4T-2-LCK重组表达质粒转化至BL21感受态细胞,经IPTG诱导4 h后采用12.5% SDS-PAGE对表达产物进行检测。如图 6所示,当IPTG诱导4 h后,含有空质粒pGEX-4T-2(BL21)菌体蛋白沉淀在大约26 kD处出现明显的一条新增蛋白带,含有pGEX-4T-2-LCK(BL21)重组质粒的菌体蛋白沉淀则在大约84 kD处出现一条明显的新增蛋白带,而未经IPTG诱导的pGEX-4T-2空质粒菌体蛋白沉淀和上清在26 kD和84 kD处均未见明显的蛋白表达。以上结果表明,大黄鱼LcLCK基因在大肠杆菌中以包涵体的形式进行表达。此外,为了进一步了解重组表达质粒在诱导不同时间后的表达量变化,对所挑选的阳性克隆菌株分别诱导3 h、4 h、5 h和6 h。结果(图 7)表明重组蛋白的表达量随着诱导时间的延长而提高。
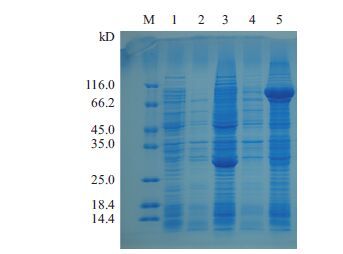
|
| 图 6 LcLCK基因表达的SDS-PAGE电泳分析图 M:分子量标准;1:未诱导的pGEX-4T-2(BL21)菌体蛋白;2:诱导4 h的pGEX-4T-2(BL21)菌体蛋白上清;3:诱导4 h的pGEX-4T-2(BL21)菌体蛋白沉淀;4:诱导4 h的pGEX-4T-2-LCK(BL21)菌体蛋白上清;5:诱导4 h的pGEX-4T-2-LCK(BL21)菌体蛋白沉淀 |
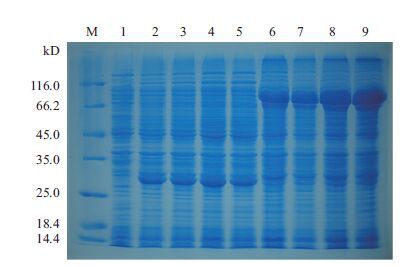
|
| 图 7 LcLCK基因不同时间的诱导表达状况 M:分子量标准;1:未诱导的pGEX-4T-2(BL21)菌体蛋白;2-5:诱导3 h、4 h、5 h以及6 h的pGEX-4T-2(BL21)菌体蛋白沉淀;6-9:诱导3 h、4 h、5 h、6 h的pGEX-4T-2-LCK(BL21)菌体蛋白沉淀 |
LCK是Src家族中的一个重要成员,在T细胞活化信号转导以及分化调节过程中起着重要的作用[3]。本研究获得了大黄鱼LcLCK全长cDNA,编码501个氨基酸,蛋白序列分析显示LcLCK含有Src家族保守结构域,推测该蛋白具有类似于哺乳动物LCK蛋白功能。人类LCK N端保守的CXXC基序能够与T细胞CD4和CD8的胞浆区相互作用,促进LCK与TCR结合[16]。虽然大黄鱼以及其他鱼类也都存在这一基序,但比对结果发现基序CXXC后面还有两个保守的NC位点,这一变化很可能是硬骨鱼LCK区别于哺乳动物的特征序列[6, 10, 17]。此外,在LcLCK C端存在两个保守的酪氨酸位点,与人类LCK序列中Try394和Try505一致。已有的研究表明这两个保守的酪氨酸位点与LCK的活性调控有关[18]。哺乳动物蛋白酪氨酸激酶C-terminal Src kinase(Csk)可以催化Try505的磷酸化反应,以维持LCK的静息状态,而当酪氨酸磷酸酶CD45使Try505发生去磷酸化后,LCK酶活性被激活。相反,Try394磷酸化后会引起LCK结构变化,使其催化活性被激活,从而催化CD3ζ链上的ITAMs磷酸化反应[18, 19]。以上分析表明LcLCK具备了T细胞活化功能的结构基础。
大黄鱼LcLCK基因在雌雄个体的不同组织中均有表达,该组成型基因表达模式在红鳍东方鲀中也有所报道[4]。但是,大菱鲆的研究发现LCK基因仅在脾脏中表达[7],而其他组织器官未见表达。虹鳟胸腺LCK基因的表达水平最高,在脾脏、肾脏以及外周血淋巴细胞中也有一定表达[6]。以上结果表明LCK基因在鱼类各组织中的表达分布与其种属特异性密切相关。雌性和雄性大黄鱼LcLCK基因在脾脏、鳃、头肾及肠等免疫相关组织均有高丰度表达,这与日本鳗鲡LCK基因研究结果相符[10]。另外,脾脏中的LcLCK表达量在雌雄大黄鱼所有检测组织器官中均为最高,提示脾脏在大黄鱼T淋巴细胞的发育、分化、增殖以及细胞免疫应答中发挥重要作用[20]。雌性大黄鱼主要免疫器官脾脏、鳃和头肾的LcLCK表达水平显著高于雄性,提示雌性大黄鱼的T细胞发育、增殖方面优于雄性。鉴于T细胞的功能主要介导细胞免疫并在免疫应答中起调节作用[21],也有研究表明大黄鱼雌性个体在生长速度方面优于雄性个体[22],然而大黄鱼主要免疫组织器官LcLCK基因表达水平在雌雄个体中的差异是否会导致其细胞免疫水平的不同还有待进一步研究。
胸腺是大多数鱼类最早发育的中枢淋巴器官,也是功能性T淋巴细胞产生的主要免疫器官[23, 24]。Kawabe等[10]研究发现日本鳗鲡胚胎发育第3天和第7天以及柳叶状幼体期均能检测到LCK基因的表达,因此LCK基因可作为T细胞分化以及胸腺发育的分子标记。目前,虽然对大黄鱼胚胎阶段胸腺发育的研究还未见报道,但已有学者通过显微技术研究了大黄鱼仔鱼期和幼鱼期胸腺的发育情况,结果表明在胸腺原基在4日龄仔鱼就已经出现,7日龄仔鱼期的胸腺进一步增大,胸腺细胞多数为典型淋巴细胞[25]。本实验研究了大黄鱼从多细胞期到仔鱼期的整个胚胎发育不同阶段LcLCK基因表达变化情况,结果表明在大黄鱼胚胎多细胞期就检测到LcL-CK基因高水平表达,囊胚期达到峰值,原肠期也有较高的表达水平,提示胸腺在胚胎发育早期就已经开始有了分化,特别在囊胚期最为活跃,到原肠期也有较高的发育水平。但从卵黄栓形成期到孵出期LcLCK基因表达水平持续降低,而到了初孵仔鱼期又开始回升,提示胸腺的发育有着严格调控机制。
本研究所构建的原核表达载体pGEX-4T-2-LCK在大肠杆菌中的高效表达,说明pGEX-4T-2是一种高效的蛋白表达载体,这很可能与强启动子tac密切相关[26]。
4 结论本实验从大黄鱼克隆获得LcLCK的cDNA全长,并实现了在大肠杆菌中的高效表达。
实时荧光定量PCR结果显示在雌性和雄性大黄鱼个体主要免疫器官中LcLCK基因均有较高的表达水平,且在胚胎发育过程中该基因的表达量发生了显著变化。
| [1] | Samelson LE. Signal transduction mediated by the T cell antigen receptor:the role of adapter proteins. Annual Review of Immunology , 2002, 20 (20) : 371–394. |
| [2] | Palacios EH, Weiss A. Function of the Src-family kinases, Lck and Fyn, in T-cell development and activation. Oncogene , 2004, 23 (48) : 7990–8000. DOI:10.1038/sj.onc.1208074 |
| [3] | Davis SJ, van der Merwe PA. Lck and the nature of the T cell receptor trigger. Trends in Immunology , 2011, 32 (1) : 1–5. DOI:10.1016/j.it.2010.11.003 |
| [4] | Sydney B, Byrappa V, Wai Ho Y, et al. Conserved regulation of the lymphocyte-specific expression of lck in the Fugu and mammals. Proceedings of the National Academy of Sciences of the United States of America , 2002, 99 (5) : 2936–2941. DOI:10.1073/pnas.032680599 |
| [5] | Langenau DM, Ferrando AA, David T, et al. In vivo tracking of T cell development, ablation, and engraftment in transgenic zebrafish. Proc Natl Acad Sci , 2004, 101 (19) : 7369–7374. DOI:10.1073/pnas.0402248101 |
| [6] | Laing KJ, Dutton S, Hansen JD. Molecular and biochemical analysis of rainbow trout LCK suggests a conserved mechanism for T-cell signaling in gnathostomes. Molecular Immunology , 2007, 44 (10) : 2737–2748. DOI:10.1016/j.molimm.2006.11.021 |
| [7] | 王贤丽, 张玉喜, 孟亮, 等. 大菱鲆T淋巴细胞酪氨酸激酶(LCK)基因全长cDNA的克隆及表达分析. 中国水产科学 , 2009 (5) : 660–667. |
| [8] | ∅vergårdAC, NerlandAH, PatelS. Cloning, characterization, and expression pattern of Atlantic halibut(Hippoglossus hippoglossus L.)CD4-2, Lck, and ZAP-70. Fish and Shellfish Immunology , 2010, 29 (6) : 987–997. |
| [9] | Taylor EB, Wilson M, Bengten E. The Src tyrosine kinase Lck binds to CD2, CD4-1, and CD4-2 T cell co-receptors in channel catfish, Ictalurus punctatus. Mol Immunol , 2015, 66 (2) : 126–138. DOI:10.1016/j.molimm.2015.02.023 |
| [10] | Kawabe M, Suetake H, Kikuchi K, et al. Early T-cell and thymus development in Japanese eel Anguilla japonica. Fisheries Science , 2012, 78 (3) : 539–547. DOI:10.1007/s12562-012-0479-3 |
| [11] | 袁雪梅, 葛明峰, 安树伟, 等. 大黄鱼致病香鱼假单胞菌对环境因子的响应及其感染检测的分析. 应用海洋学学报 , 2015 (4) : 549–553. |
| [12] | 胡娇, 张飞, 徐晓津, 等. 大黄鱼(Pseudosciaena crocea)内脏白点病病原分离鉴定及致病性研究. 海洋与湖沼 , 2014 (2) : 409–417. |
| [13] | Li Q, Ao J, Mu Y, et al. Cathepsin S, but not cathepsin L, particip-ates in the MHC class II-associated invariant chain processing in large yellow croaker(Larimichthys crocea). Fish and Shellfish Immunology , 2015, 47 (2) : 743–750. DOI:10.1016/j.fsi.2015.10.009 |
| [14] | Castro R, Bernard D, Lefranc MP, et al. T cell diversity and TcR repertoires in teleost fish. Fish and Shellfish Immunology , 2011, 31 (5) : 644–654. DOI:10.1016/j.fsi.2010.08.016 |
| [15] | 姚志刚, 冯建军, 王艺磊, 等. 欧洲鳗鲡MyD88基因的克隆及其免疫功能分析. 水产学报 , 2015 (3) : 305–317. |
| [16] | Shaw AS, Amrein KE, Hammond C, et al. The lck tyrosine protein kinase interacts with the cytoplasmic tail of the CD4 glycoprotein through its unique amino-terminal domain. Cell , 1989, 59 (4) : 627–636. DOI:10.1016/0092-8674(89)90008-1 |
| [17] | Araki K, Hirano K, Takizawa F, et al. Identification and characterization of multiple lck genes in ginbuna crucian carp Carassius auratus langsdorfii. Fisheries Science , 2007, 73 (5) : 1017–1024. DOI:10.1111/fis.2007.73.issue-5 |
| [18] | Hermiston ML, Zheng X, Ravindra M, et al. Reciprocal regulation of lymphocyte activation by tyrosine kinases and phosphatases. Journal of Clinical Investigation , 2002, 109 (1) : 9–14. DOI:10.1172/JCI0214794 |
| [19] | Bjorge J, Jakymiw A, Fujita D. Selected glimpses into the activation and function of Src kinase. Oncogene , 2000, 19 (49) : 5620–5635. DOI:10.1038/sj.onc.1203923 |
| [20] | 徐晓津, 谢仰杰, 王军, 等. 孵化至12月龄大黄鱼免疫器官的发育变化. 水产学报 , 2011 (4) : 604–613. |
| [21] | 张永安, 孙宝剑, 聂品. 鱼类免疫组织和细胞的研究概况. 水生生物学报 , 2000 (6) : 648–654. |
| [22] | 黄伟卿, 韩坤煌, 郑昇阳, 等. 36月龄雌、雄大黄鱼生长性状的相关分析与通径系数. 水产学杂志 , 2014 (3) : 39–43. |
| [23] | Matsunaga T, Rahman A. In search of the origin of the thymus:the thymus and GALT may be evolutionarily related. Scandinavian Journal of Immunology , 2001, 53 (1) : 290–294. |
| [24] | Jósefsson S, Tatner MF. Histogenesis of the lymphoid organs in sea bream(Sparus aurata L. Fish and Shellfish Immunology , 1993, 3 (1) : 35–49. DOI:10.1006/fsim.1993.1004 |
| [25] | 徐晓津, 翁朝红, 王军, 等. 大黄鱼早期发育过程中免疫器官的发生. 海洋学报:中文版 , 2007 (3) : 105–113. |
| [26] | 钟俐强, 杨斯皓, 贾钰铭, 等. pGEX-4T-2-TK原核表达质粒的构建及其表达. 重庆医学 , 2010 (9) : 1036–1038. |