遗传标记(genetic marker)是指在遗传分析上用作标记基因的方法,它可追踪染色体或染色体某一节段以及某一个基因座在家系中传递的任何一种遗传特性,具有可遗传性和可识别性的特征。遗传标记主要包括形态标记(morphological maker)、细胞标记(cytological maker)、生化标记(biochemical maker)和分子标记(molecular maker)[1]。由于前3种遗传标记可标记的位点少并且受外界环境因素的影响比较大,因而在实际应用中分子标记是遗传分析上较为普遍采用的方法。
分子标记是继形态标记、细胞标记和生化标记之后发展起来的一种较为理想的遗传标记,它是以个体间遗传物质内核苷酸序列变异为基础的遗传标记,是DNA水平遗传多态性的直接反映[2, 3]。分子标记具有较大的优越性,如大多数分子标记为共显性,对隐性性状的选择十分便利;基因组变异极其丰富,分子标记的数量几乎是无限的;检测手段简单、迅速等。在过去的几十年中,利用SSR(simple sequence repeats)、RFLP(restriction fragment length polymorphism)、AFLP(amplified fragment length polymorphisms)、RAPD(random amplified polymorphic DNA)和DArT(diversity arrays technology)等标记已构建了一些携带重要基因染色体区域的分子标记图谱[4]。
然而,由于这些遗传标记与目标基因具有一定距离,其预测值取决于标记与目标基因在特定群体中的连锁程度,随着繁殖代数增加,遗传距离加大,其连锁关系打破的概率会逐渐上升,使分子标记辅助选择的准确性下降。相比之下,通过开发与表型相关的功能基因序列形成的功能标记已成为DNA分子标记的热点,该标记为显性标记,是分子育种中标记辅助选择的理想标记。本文通过对功能标记作为辅助育种手段在小麦中的应用进行综述,以期为相关分子标记的开发提供参考。
1 功能标记(functional makers,FMs)的概念Andersen 等将功能标记定义为基于与表型性状紧密相关的功能基因内部的多态性序列而开发的分子标记[5]。相比随机 DNA 分子标记(基于基因组中随机多态性位点开发的标记)和与目的基因连锁的分子标记(基于基因与基因之间的多态性位点开发的标记),功能标记直接反映作物的表型性状。功能标记的特点可以归为以下几点: (1)可准确的检测、锁定目标基因;(2)遗传效应值更加可靠;(3)能准确反应功能性等位基因的遗传变异[6]。
功能标记开发的首要条件是明确与作物表型性状紧密相关的功能基因,目前关于基因功能鉴定的方法是根据相似功能基因之间的序列同源性推测表达序列可能具有的功能。另外,表达谱分析等高通量的检测方法、RNA干扰、T-DNA转座子、转座子基因标签(插入突变体),QTL作图、蛋白质数量位点(protein quantityloci,PQLs)、激活标记及病毒诱导基因沉默(virus induced gene silencing,VIGS)等也是鉴别功能基因的重要方法。目前,根据功能标记开发的两种有效策略: 关联分析方法和建立近等位基因系群体,可将功能标记分为直接性功能标记和间接性功能标记。目前,已开发和利用最多的是直接性功能标记。
1.1 间接性功能标记(indirect functional marker,IFM)功能性分子标记开发的前提条件是多态性的等位基因序列。间接性功能标记是一种以连锁不平衡(linkage disequilibrium,LD)为基础的分子标记,是通过鉴定群体内的目标性状与遗传标记的关联性而获得的[8],一个群体内不同座位等位基因之间的非随机关联被称为连锁不平衡。关联性由关联分析法计算得到,这种方法只在统计数据方面提供了基因序列与目标性状之间关联性的证据,具体的基因序列的多态性和目标性状的关系还需要直接类型的功能性分子标记进行证明。
1.2 直接性功能性分子标记(direct functional maker,DFM)直接性功能标记是通过直接比较近等基因系中功能基因序列差异开发的,其中的等位功能基因序列可以通过同源重组(homologous recombination,HR)和定向诱导基因组局部突变技术(targeting-induced local lesions in genomes,TILLING)获得。TILLING技术具有快速、有效地鉴定和定向筛选突变的优点[9],通过借助高通量的检测手段,可以对转基因或化学诱变等途径获得的近等基因系进行点突变的鉴定。由于化学诱变会产生大量的点突变,并且检测单个点突变仍然比较困难,因而可以将经过化学诱变的单株与其对照亲本回交转育,使其遗传背景恢复到对照种水平构建近等基因系。利用化学诱变构建近等基因系并结合TILLING技术是目前最有效的检测等位功能基因单核苷酸多态性的方法,由这种开发策略得到的功能性分子标记被称为直接类型功能性分子标记。然而,由这种策略开发的直接性功能标记费用相对较高,目前通常采用的方法是首先通过关联分析筛选候选功能基因,然后再利用获得的近等基因系对等位功能基因序列直接比对,根据差异的核苷酸位点开发直接性功能标记。
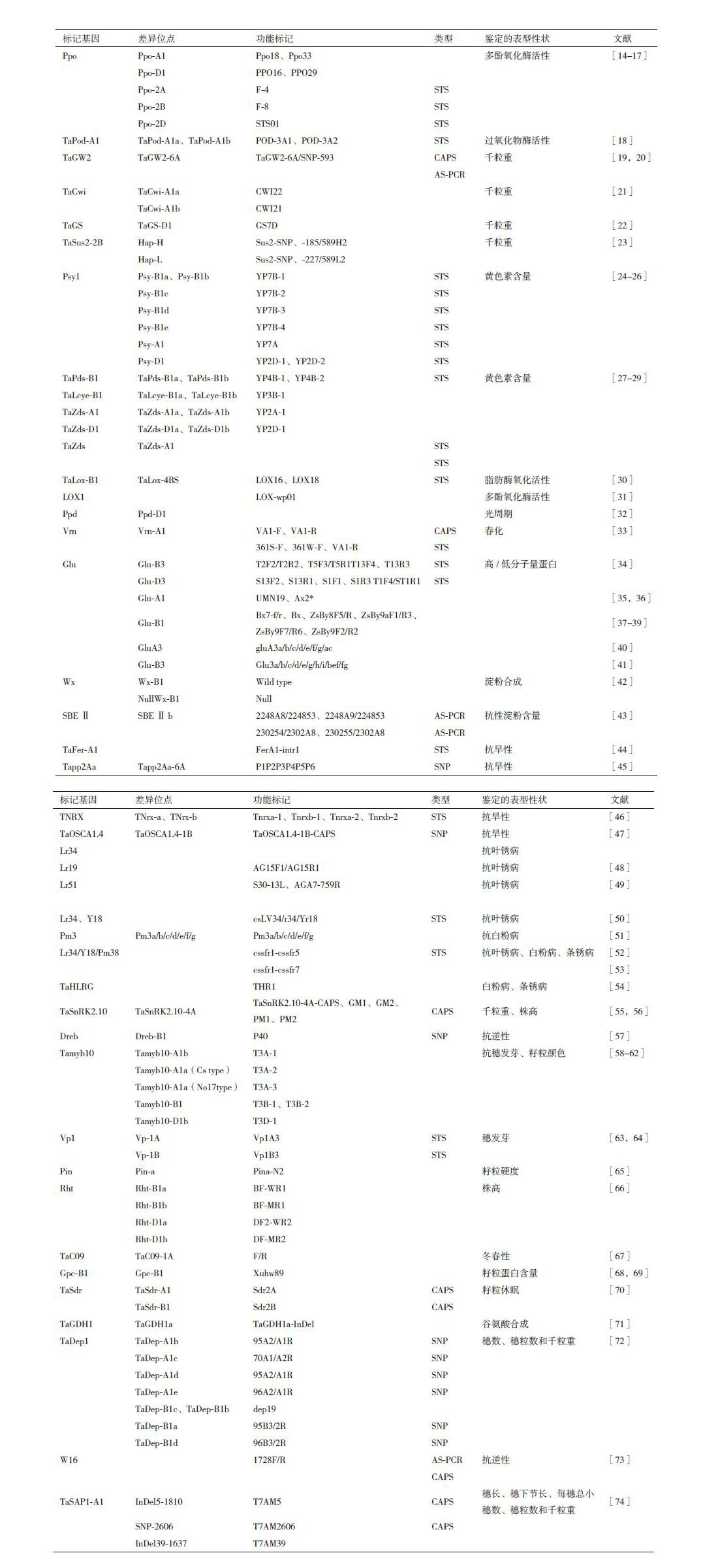
2 功能性分子标记在中国小麦育种的应用小麦是世界上最重要的粮食作物之一,全球有超过40%的人口以小麦为主食[11]。功能标记作为一种新型的DNA分子标记可以快速、准确地检测小麦品种资源所携带的基因,有效地提高后代选择的准确性[12, 13],从而缩短育种年限,加快育种步伐。目前,在小麦育种中已经开发的功能标记主要应用在种质资源纯度鉴定、生长发育、抗病虫、抗逆及品质改良等方面(表 1)。
小麦条锈病是一种在世界范围内普遍流行的气传性病害,严重威胁小麦生产,而我国又是世界最大的小麦条锈病流行区,条锈菌生理小种的高度变异是造成该病流行的重要原因。伍玲等[52]根据与Lr34/Yr18/Pm38紧密连锁的STS标记csLV34和基于该基因第11外显子等位变异开发了5对功能标记 cssfr1-cssfr5,利用这6对功能标记csLV34以及cssfr1-cssfr5对273个CIMMYT小麦品系的检测结果和田间验证结果一致性为 96.7%,表明功能标记csLV34和cssfr1-cssfr5 可准确鉴定小麦的白粉病、叶锈病和条锈病,可应用于小麦抗病育种。Liu等[54]克隆了3个与白粉病和条锈病相关基因PTaRtL、TaSBL和TaHLRG的完整ORF序列,并将PTaRtL和TaSBL的表达定位在细胞膜和细胞核上。根据TaHLRG基因序列开发了一个功能标记THR1,利用缺体-四体系将TaHLRG定位在小麦的6A染色体上。ANOVA分析结果验证了TaHLRG与小麦条锈病成株抗性的相关性。在对白粉病表现有成株抗性的DH群体白农64/京双16和F2: 3群体鲁麦21/京双16中,TaHLRG可分别解释抗、感表型变异的9.3%-9.7%和11.9%-20.5%。在对条锈病表现有成株抗性的F2: 3群体Strampelli/辉县红中,TaHLRG基因可以解释表型变异的11.8%-22.5%。
目前,利用功能性分子标记研究条锈菌生理小种与抗病基因之间的关系已取得较大进展,能较好地揭示抗病性内在的分子机理,这对于抗条锈小麦品种培育以及条锈病防治具有重要意义。
2.2 在小麦抗逆性中的应用干旱是限制农业发展的主要逆境因子之一,我国人均的水资源占有量不足世界人均的1/4,且水资源的时空分布极不均匀。我国的小麦主产区大部分在干旱、半干旱地区,因而选育和推广抗旱小麦品种、寻找与抗旱相关的基因,并开发特异性的分子标记是促进小麦生产持续稳定发展的重要途径。由于铁结合蛋白(ferritin,Fer)参与干旱胁迫应答反应,所以开发Fer基因抗旱相关的分子标记可为抗旱小麦品种选育提供依据。鞠丽萍等[44]通过比对2个抗旱性强与2个抗旱性弱的小麦品种,在1A染色体上的铁结合蛋白基因(TaFer-A1)基因序列上,发现TaFer-A1基因的第1个内含子区域内有3个连续碱基的TCT缺失和插入,根据该变异位点开发出共显性分子标记 FerA1-intr1,并利用150 份抗旱性不同的小麦品系对该功能标记进行了验证,结果表明该标记与小麦抗旱性密切相关。
硫氧还蛋白(thioredoxin,Trx)是植物体内的一类多功能蛋白,参与光合作用中的电子传递、被氧化蛋白质的修复、体内活性氧的清除等生理代谢[13]。张帆等[46]选用旱地小麦品种晋麦47为试验材料,获得了普通小麦硫氧还蛋白(Trx)超家族的1个新基因TaNRX,通过测序比较TNRX基因组全序列的差异,设计了4对显性互补STS标记(Tnrxa-1、Tnrxb-1、Tnrxa-2及Tnrxb-2),并将TaNRX基因划分为与抗旱相关的两种等位变异TNrx-a与TNrx-b,分子标记检测为TNrx-a基因型群体后代和品种(系)的整体平均相对发芽率明显高于TNrx-b基因型,说明开发的4个STS标记可以进行小麦抗旱性鉴定筛选,表明TNRX基因在小麦调控干旱胁迫的生理适应过程中发挥着重要作用。
转录因子TaDREB1是受多种非生物胁迫诱导而上调表达的调节基因,在小麦感受逆境胁迫后的基因表达调控网络中起着重要的作用。Wei等[57]以4份六倍体小麦、3份普通小麦的二倍体野生近缘种和1份普通小麦的四倍体野生近缘种、1套以中国春为背景的缺四体和2个小麦遗传作图群体为材料,用直接测序的方法分析了TaDREB1基因的SNPs,并据此设计了一对可以稳定检测RIL群体双亲(Opata85和W7984)之间TaDREB1等位基因SNP的特异引物P40,利用该标记将TaDREB1基因定位于3BS,位于Xfam61和Xfba91之间。并用缺四体和Southern杂交予以验证。
TaPP2Aa为小麦抗旱相关蛋白磷酸酶结构亚基基因,因此开发功能标记并作图可为分子标记辅助选择抗逆育种提供依据。王智兰等[45]以154份小麦种质资源材料组成的自然群体、4个遗传作图群体、小麦野生近缘种和一套中国春缺四体为材料,将小麦抗旱候选基因TaPP2Aa定位在小麦第5同源染色体群上,其中TaPP2A-D基因开发的功能标记定位区间及其邻近区间检测到一个抗逆性状的QTL;在5B染色体的标记区间检测到分别控制穗长和株高的QTL,在其邻近区间检测到株高。株高旱胁迫系数和株高抗旱指数3个性状共享的QTL区间。
蔗糖非发酵相关蛋白激酶家族2(sucrose non-fermentingl-related protein kinase2,SnRK2)参与逆境条件下植物体内逆境信号传递和能量代谢,在抵御非生物胁迫和调节植物的生长发育等方面发挥重要的作用。张照贵等[55]利用中国春缺体-四体系将TaSnRK2.10定位到小麦第4同源群上,并根据TaSnRK2.10-4A基因序列1 907 bp处的序列差异开发了功能标记TaSnRK2.10-4A-CAPS,将该功能标记与128份材料的农艺性状进行关联分析,结果表明,TaSnRK2.10-4A的两种单倍型(Hap-4A-H和Hap-4A-L)的千粒重、株高和穗长在所有的环境条件下均达到了显著差异。
目前,在小麦抗逆性方面已经挖掘出不少基因,初步建立起了基因与小麦抗逆作用之间的关系,但对小麦抗性研究主要集中在抗性机理和遗传分析及影响因素等方面,而通过分离克隆小麦的抗性相关基因,对其进行基因功能分析及自身调控研究,进而通过分子育种培育抗性小麦的文章还比较少。
2.3 在小麦品质改良中的应用面粉颜色是决定小麦品质的重要指标,对面条及其它相关制品品质有重要影响。小麦籽粒中的多酚氧化酶(polyphenol oxidase,PPO)活性、黄色素含量(kernel yellow pitmen)和籽粒颜色是影响面制品颜色性状的重要指标。多酚氧化酶是导致面制品在加工过程中发生酶促褐变的主要原因,黄色素含量过高将导致面粉黄度增加,同时面粉的白度降低,红色籽粒小麦在磨粉时会随着出粉率的升高造成鼓星混杂使面粉色泽变差,因此合适的酚氧化酶活性、黄素含量和籽粒颜色对小麦品质具有重要意义。Sun等[14]和王晓波等[15]分别根据2A和2D染色体上PPO基因序列开发了籽粒PPO活性的共显性功能标记: PP018和STS01,可以区分2A和2D染色体上PPO基因的等位变异(PPO-2Aa1/bl,PPO-2Da2/b2),为深入了解中国小麦PPO基因的等位类型及其分布提供了可能。He等[24, 25]克隆了普通小麦及其近缘种2A和2D染色体上PPO基因的全序列,并根据PPO-D1位点等位变异开发了一对互补的显性标记PP016和PP029,通过对217份中国冬小麦材料的检测,确定了该互补标记与PPO活性的相关性。以中优9507/CA9632 DH群体为材料,将PP016与PP029被定位在2D染色体的长臂上,并与该区域的主效QTL共分离。
Wei等[18]以TaPod-A1基因的两个等位变异(TaPod-A1a和TaPod-A1b)为依据,开发了一对显性互补的功能标记POD-3A1和POD-3A2。POD-3A1在TaPod-A1a的材料中仅能扩增出291 bp的片段,与低POD活性相关。POD-3A2也只能在TaPod-A1b型的材料中扩增出766 bp的片段,与高POD活性相关。利用此功能标记POD-3A1和POD-3A2检测281份来白3个麦区的小麦材料,不同麦区不同基因型的POD活性差异均达到5%显著水平。此外,还利用豆麦/石4185RIL群体的214个品系对标记进行了验证,4个环境下不同基因型的POD活性差异达到1%显著水平;同时QTL的分析结果表明QPod.caas-3AL即是TaPod-A1。因此,显性互补的标记POD-3A1和POD-3A2可有效地用于小麦POD活性的遗传改良。
八氢番茄红素合成酶(Psy)基因影响小麦谷物的黄色素(YP)含量,并与最终用途产品的质量有关。周渭皓等[75]为研究我国小麦面粉色泽形成的分子机理,利用功能标记YP7A、YP7A-2、YP7B-1、YP7B-2、YP7B-3、YP7B-4、YP7D-1和YP7D-2对来自我国甘肃省的62份春小麦主栽品种Psy1位点的等位变异类型进行了检测,并对其黄色素含量进行了测定。结果表明,拥有Psy-Ala、Psy-B1c和Psy-Dla基因型组合的小麦品种黄色素含量显著高于其他基因型组合,而拥有Psy-Alb、Psy-Blc和Psy-Dla。基因型组合的小麦品种黄色素含量显著低于其他基因型组合,为我国春小麦面粉色泽的遗传改良提供重要信息。董长海等[29]克隆了与黄色素含量紧密相关的基因(TaPds-A1、TaPds-B1、TaLcye-B1和TaLcye-D1),针对TaPds-B1位点的2个等位变异TaPds-B1a和TaPds-B1b,开发了相应的显性标记YP4B-1和YP4B-2;针对TaLcye-B1位点的等位变异TaLcye-B1a和TaLcye-B1b,开发了一个显性标记YP3B-1;针对TaZds-A1位的等位变异TaZds-A1a和TaZds-A1b开发了共显性标记YP2A-1,并可解释11.30%的表型变异,TaZds-A1a基因型与低黄色素含量相关,而TaZds-A1b基因型与高黄色素含量相关。胡萝卜素脱氢酶(Zds)影响小麦面制品色泽品质的关键酶,Zhang等[27]根据TaZds-D1基因在染色体2DL的等位基因TaZds-D1a和TaZds-D1b的差异,开发了功能标记YP2D-1。QTL分析证明这个标记与小麦黄色素含量连锁,并且对表型的贡献率为18.4%。用该功能标记检测了71个DH群体,也证明它与黄色素含量有关,同时又用近300个小麦栽培品种(系)验证了该标记的适用性。
小麦成熟期穗发芽是一种世界性的自然灾害,不仅影响产量,且严重恶化小麦的加工品质和种用价值,给世界及我国各主要小麦产区造成了很大的经济损失。基因Tamyb10属于MYB家族的一种转录因子,决定着小麦种皮的颜色,同时对穗发芽杭性也具有一定影响。Yang等[63]依据普通小麦Vp1基因在穗发芽抗性与敏感品种中的差异开发出一个与穗发芽抗性相关的STS共显性标记Vp1B3,该标记在抗性品种中扩增出845 bp和569 bp的片段,在感性品种中扩增出652 bp的片段,这一标记更适合于白粒品种的穗发芽抗性筛选。Zhang等[22, 70]以水稻控制籽粒休眠和籽粒大小的基因OsSdr4和OsGS3为候选基因,克隆小麦同源基因TaSdr和TaGS。基于TaSdr-A1基因643位点的SNP,开发了CAPS标记Sdr2A,用此标记检测44份中国小麦品种,不同TaSdr-A1等位基因间发芽指数(GI)平均值差异不显著。根据TaSdr-B1基因-11位点的SNP开发了CAPS标记Sdr2B,可解释表型变异的7.8%、6.4%和8.7%。根据TaGS-D1基因第2内含子中40 bp的InDel,开发了1个共显性标记GS7D,最高可解释千粒重表型变异的14.6%,解释粒长表型变异的6.8%。
另外,在小麦品质改良育种中,蛋白含量及其种类也是决定小麦品质的重要因素。在六倍体小麦中,Slade 等[76]利用TILLING 技术在 800 个个体组成的 EMS 诱变群体中鉴定出 246 个 Waxy 基因的等位变异,其中 1/3 的Waxy 基因位点为功能失活突变体,这在一定程度上为低直链淀粉含量小麦功能标记的开发奠定了基础。李冰[71]用二倍体和四倍体小麦对普通小麦品种中的TaGDH1基因的gDNA序列进行所属染色体组划分,分为A、B和D组。根据A组TaGDH1的gDNA序列其中一种单倍型,开发了一种InDel分子标记,命名为TaGDH1a-InDel。利用中国春缺体-四体体系和“泰农18×临麦6号”RIL群体将这个标记定位到5A染色体上,该标记与SNP标记Ku-c47168-562连锁,距离为2.1 cM。该研究开发的标记有助于GDHl在小麦中功能的研究以及TaGDHl基因型的鉴别,为今后结合5A上已知产量性状相关QTL研究TaGDH1基因功能奠定了基础。王昊龙等[43]克隆了抗性淀粉含量不同的小麦品种(系)中淀粉分支酶SBEⅡa基因、SBEⅡb基因和SBEⅡa基因启动子序列,根据SBEⅡb基因ORF2248和2302等位位点AHG的突变产生的差异,设计了AS-PCR特异性引物2248A8、2248A9、224853和2302A8、2302S4和224855。AS-PCR结果显示,2248A8、2248A9和共用引物224853的互补选择可以作为SBEⅡb基因2248位点上A/G的有效鉴定。230254、230255及共用引物2302A8的互补选择可以作为SBEⅡb基因2302位点上A/G的差异鉴定。4对引物的相互补充利用可以有效地用于小麦抗性淀粉含量分子标记辅助选择,为后期小麦高抗性淀粉含量品种(系)的筛选工作提供一种便利的手段。
目前,虽然已经有70个左右的关于小麦加工品质功能标记开发和验证,大大促进了小麦的品质育种进程,但与高产育种相比,品质育种则进展相对较慢,主要原因是品质性状优良的基因资源总体较为缺乏,以后应加强优良种质资源的筛选来加快品质育种的进程。
2.4 在小麦农艺性状培育中的应用在小麦农艺性状培育,千粒重是高产育种重要目标性状之一。刘亚男等[72]以控制水稻穗型结构OsDepl为候选基因,采用同源克隆方法克隆了普通小麦TaDepl基因。根据TaDep1-A1和TaDepl-B1位点不同等位变异的SNP和InDel开发了3对显性互补标记(70A1/A2R和82A1/A2R;95A2/A1R和96A2/A1R;95B3/2R和96B3/2R)和1个共显性标记(dep19),可以准确鉴别不同等位基因;用这些标记对4个群体和430多份小麦品种进行检测,发现不同基因型的株高、穗长、小穗数、穗节间和千粒重均没有显著差异,即小麦的TaDepl基因与产量相关性状没有显著关联。其中,可准确区分TaDep1-B1c与TaDepl-Bla、TaDepl-Blb和TaDepl-B1d的共显性标记Dep 19是根据第5外显子上一个30 bp的InDel开发的。
雷梦林等[73]以六倍体普通小麦及其以野生近缘种的二倍体和四倍体为材料,克隆出小麦DREB转录因子基因W16 的DNA序列,利用DH群体亲本(旱选10号和鲁麦14)W16的单核苷酸多态性,开发了CAPS和AS-PCR(1728F/R)标记,利用该标记在154份六倍体普通小麦材料构成的自然群体中进行关联分析发现,W16的3种单倍型分别与单株穗数、穗粒数、每穗小穗数和籽粒饱满度关联。其中HapⅡ为增加单株穗数和籽粒饱满度的优良单倍型,HapⅢ为提高穗粒数的优良单倍型。吕广德等[47]克隆到了一个抗旱基因(TaOSCA1.4),通过中国春缺体-四体系将该基因定位到小麦第一部分同源群上。根据TaOSCA1.4-1B的SNP(4253bp A-C)位点开发成CAPS标记(TaOSCA1.4-1B-CAPS),将该功能标记与134份小麦品种(系)组成的自然群体12个环境调查数据进行关联分析,结果表明,TaOSCA1.4的两种单倍型Hap-1B-A与Hap-1B-C的总小穗数(TSS)和株高(PH)在不同的个体环境中达到了极显著差异,单倍型Hap-1B-C比Hap-1B-A多0.70个小穗,株高矮3.23 cm,并且该基因对顶部不育小穗数、穗粒数和产量都有一定的影响。
SAP是一类具有A20/AN 1锌指结构域的抗逆相关蛋白,Chang等[74]基于TaSAP1-A1启动子区3个多态性位点InDel5-1810、SNP-2606和InDel39-1637开发了3个分子标记,分别命名为T7AM5、T7AM2606和T7AM39。其中T7AM5和T7AM2606是CAPS标记,T7AM39是等位基因特异PCR标记。关联分析表明3个分子标记T7AM5、T7AM2606和T7AM393与5个农艺性状显著关联,包括穗长、穗下节长、每穗总小穗数、穗粒数和千粒重。
基于大麦的光周期调控基因TaC09基因核酸序列,冉从福等[67]利用同源克隆技术在小麦中克隆了其同源基因TaC09,以序列在距CCT结构域22 bp内含子差异为依据设计了分子标记rF/R,利用中国春缺-四体材料将其定位于小麦1A染色体,命名为TaC09-1A,根据基因TaC09等位变异开发了共显性分子标记F/R,在不同小麦品种中扩增,发现具有碱基插入突变的品种普遍为春性品种,抽穗及开花相对于未突变品种较早,冬性品种未发现突变,该标记与小麦冬春性密切关联,可辅助鉴定品种冬春习性。
迄今为止,重要农艺性状如株高、光周期反应、春化作用、粒重和耐逆境的基因已经开发了30个左右功能标记并在小麦育种中应用。由于农艺性状与品质性状相比更易描述,它们的田间表现可以直接选择,所以在育种中农艺性状的功能标记不如品质性状的标记使用广泛。
2.5 在小麦种质资源中的应用传统小麦基因鉴定方法,技术要求较高,影响因素多,实际操作有局限性,尤其在鉴定和筛选含两个以上基因的材料时更为复杂,难以准确区分基因的具体归属和涉及的基因数目。利用与功能标记追踪基因,可使目的基因的鉴定摆脱上述因素带来的困难且结果更加准确可靠。Yang 等[20]发现大粒小麦TaGW2-6A 基因序列在第 8 外显子 977 bp处相比于中国春有一个T 碱基缺失,这一碱基的缺失导致了TaGW2 基因编码的氨基酸发生变化并应用此位点多态性开发的 AS-PCR分子标记可有效鉴定兰考小麦和中国春杂交后代品系。陈杰等[62]在粗山羊草中克隆了3个新的等位基因,分别命名为Tamybl0-D1c、Tamyb10-D1d和Tamybl0-D1e,根据这3个等位基因序列之间的差异设计了两对共显性的功能标记DD3和DD5。用DD3和DD5对110参试的粗山羊草进行分子检测,试验结果表明: 新疆地区粗山羊草材料的Tamybl0基因型较为丰富,有Tamyb10-D1c、Tamyb10-D1d和Tamyb10-D1e 3种变异类型。而黄河中游地区(河南和陕西)的粗山羊草材料的Tamybl0基因型较为单一,只有Tamyb10-D1d一种变异类型。利用DD3和DDS扩增出的目的片段条带清晰,稳定性好,可以直接用于粗山羊草Tamybl0基因的标记辅助选择。张丽等[77]为建立长穗偃麦草(Lophopyrum elongatum)Ee染色体组特异的分子标记,以普通小麦(Triticum aestivum L.)中国春、中国春-长穗堰麦草二体代换系和附加系为材料,利用获得的STS(STS318、STS241、STS116和STS182)标记对5个长穗堰麦草居群和8个小麦品种进行了鉴定。结果表明,这些STS标记在长穗堰麦草居群中能检测到,但在其它小麦背景中检测不到。说明这些标记可以用于小麦-长穗堰麦草异源附加系和代换系中长穗堰麦草遗传物质的检测。
3 展望DNA分子标记技术的开发是近年来分子生物学领域研究的热点,虽然分子水平遗传标记的发展和利用只有短短的20多年,但它已被广泛应用于遗传育种中。开发分子标记的目的是为了进行生物种质资源鉴定、品种改良及相关遗传基础研究。
建立分子标记辅助育种体系可大幅度提高动植物品种改良的效率和定向性,缩短育种周期和降低育种成本。功能性分子标记的这种通过对基因序列的扩增而与表达序列紧密连锁的特性使其可被广泛而高效地应用于高密度图谱的构建、QTL检测、基因定位、图位克隆及分子标记辅助育种等[10]。
功能性分子标记的开发首先需要鉴定出群体中与表型相关的功能基因的功能性基序的序列,具有明确基因功能的基因分离是功能性分子标记开发的前提。尽管小麦中已有许多功能基因可以用来开发功能性分子标记,但迄今为止,小麦中也仅有20个左右的控制农艺性状的基因被分离出来,比如抗病性基因中的Lr10、Lr21和Pm3等,谷物品质基因中的Pina、Pinb、A2*和Bx7/Bx17等。对小麦中不同群体连锁不平衡程度的信息量的掌握很有限,更多基因并未明确注释功能。另外,得到注释的也是其生物学意义大于其农艺性状意义的,远不能满足农艺性状意义的功能。因此,在进行FMs开发以前不仅要深入研究基因及序列的功能,对所有控制农艺性状上同一位点的全部等位基因都需要检测与鉴定。
| [1] | 刘光兴. 遗传标记技术在海洋桡足类生物多样性和系统发生研究中的应用. 中国海洋大学学报 , 2007, 37 (1) : 33–37. |
| [2] | 周延清. DNA分子标记技术在植物研究中的应用[M]. 北京: 化学工业出版社, 2005 : 56-57. |
| [3] | Pang M, Percy RG, Hughs E, et al. Promoter anchored amplified polymorphism based on random amplified polymorphic DNA(PAAP-RAPD)in cotton. Euphytica , 2009, 167 (3) : 281–291. DOI:10.1007/s10681-008-9850-y |
| [4] | Bagge M, Xia X, Lübberstedt T. Functional markers in wheat. Current Opinion in Plant. Biology , 2007, 10 (2) : 211–216. DOI:10.1016/j.pbi.2007.01.009 |
| [5] | Andersen JR, Lübberstedt T. Functional markers in plants. Trends in Plant Science , 2003, 8 (11) : 554–560. DOI:10.1016/j.tplants.2003.09.010 |
| [6] | 杨景华, 王士伟, 刘训言, 等. 高等植物功能性分子标记的开发与利用. 中国农业科学 , 2008, 41 (11) : 3429–3436. |
| [7] | The genome initiative. analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature , 2000, 408 (6814) : 796–815. DOI:10.1038/35048692 |
| [8] | Sherry A, Thuillet Anne-Céline, Yu JM, et al. Maize association population: a high-resolution platform for quantitative trait locus dissection. The Plant Journal , 2005, 44 (6) : 1054–1064. DOI:10.1111/tpj.2005.44.issue-6 |
| [9] | Kurowska M, Daszkowska-Golec A, Gruszka D, et al. TILLING-a shortcut in functional genomics. Journal of Applied Genetics , 2011, 52 (4) : 371–390. DOI:10.1007/s13353-011-0061-1 |
| [10] | Sunnucks P. Efficient genetic markers for population biology. Trends in Ecology and Evolution , 2000, 15 (5) : 199–203. DOI:10.1016/S0169-5347(00)01825-5 |
| [11] | Brenchley R, Spannag M, Pfeifer M, et al. Analysis of the bread wheat genome using whole genome shotgun sequencing. Nature , 2012, 491 (7426) : 705–710. DOI:10.1038/nature11650 |
| [12] | Bagge M, Xia XC, Lubberstedt T. Funetional markers in wheat. Current Opinion in Plant Biology , 2007, 10 (2) : 211–216. DOI:10.1016/j.pbi.2007.01.009 |
| [13] | Arnér ESJ, Holmgren A. Physiological functions of thioredoxin and thioredoxin reductase. European Journal of Biochemistry , 2000, 267 (20) : 6102–6109. DOI:10.1046/j.1432-1327.2000.01701.x |
| [14] | Sun DJ, He ZH, Xia XC, et al. A novel STS marker for polyphenol oxidase activity in bread wheat. Molecular Breeding , 2005, 16 (3) : 209–218. DOI:10.1007/s11032-005-6618-0 |
| [15] | 王晓波, 马传喜, 何克勤, 等. 小麦2D染色体上多酚氧化酶(PPO)基因STS标记的开发与应用. 中国农业科学 , 2008, 41 (6) : 1583–1590. |
| [16] | He XY, He ZH, Zhang LP, et al. Allelic variation of polyphenol oxidase(PPO)genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat. Theoretical Applied Genetics , 2007, 115 (1) : 47–58. DOI:10.1007/s00122-007-0539-8 |
| [17] | He XY, He ZH, Morris CF, et al. Cloning and phylogenetic analysis of polyphenol oxidase genes in common wheat and related species. Genetic Resources and Crop Evolution , 2009, 56 (3) : 311–321. DOI:10.1007/s10722-008-9365-3 |
| [18] | Wei JX, Geng HW, Zhang Y, et al. Mapping quantitative trait loci for peroxidase activity and developing gene-specific markers for TaPod-A1 on wheat chromosome 3AL. Theoretical and Applied Genetics , 2015, 128 (10) : 2067–2076. DOI:10.1007/s00122-015-2567-0 |
| [19] | Su ZQ, Hao CY, Zhang XY. Identification and development of a functional marker of TaGW2 associated with grain Weight in bread wheat(Triticum aestivum L.). Theoretical and Applied Genetics , 2010, 122 (1) : 211–223. |
| [20] | Yang ZB, Bai ZY, Li XL, et al. SNP identification and allelic-specific PCR markers development for TaGW2, agene finked to wheat kernel weight. Theoretical and Applied Genetics , 2012, 125 (5) : 1057–1068. DOI:10.1007/s00122-012-1895-6 |
| [21] | Jiang QY, Hou J, Hao CY, et al. The wheat(T. aestivum)sucrose synthase 2 gene(TaSus2)active in endosperm development is associated with yield traits. Funct Integr Genomics , 2011, 11 (1) : 49–61. DOI:10.1007/s10142-010-0188-x |
| [22] | Zhang YJ, Liu JD, Xia XC, et al. TaGS-D1, an ortholog of rice OsGS3, is associated with grain weight and grain length in common wheat. Mol Breeding , 2014, 34 (3) : 1097–1107. DOI:10.1007/s11032-014-0102-7 |
| [23] | Ma DY, Yan J, He ZH, et al. Characterization of a cell wall inverta-se gene TaCwi-A1 on common wheat chromosome 2A and develop-ment of functional markers. Mol Breeding , 2012, 29 (1) : 43–52. DOI:10.1007/s11032-010-9524-z |
| [24] | He XY, He ZH, Ma W, et al. Allelic variants of phytoene synthase 1(Psy1)genes in Chinese and CIMMYT wheat cultivars and development of functional markers for flour colour. Mol Breeding , 2009, 23 (4) : 553–563. DOI:10.1007/s11032-009-9255-1 |
| [25] | He XY, Zhang YL, He ZH, et al. Characterization of phytoene synthase 1 gene(Psy1)located on common wheat chromosome 7A and development of a functional marker. Theor Appl Genet , 2008, 116 (2) : 213–221. DOI:10.1007/s00122-007-0660-8 |
| [26] | Wang JW, He XY, He Z, et al. Cloning and phylogenetic analysis of phytoene synthase 1(Psy1)genes in common wheat and related species. Hereditas , 2009, 146 (5) : 208–256. DOI:10.1111/more.2009.146.issue-5 |
| [27] | Zhang CY, Dong CH, He XY, et al. Allelic Variants at the TaZds-D1 locus on wheat chromosome 2DL and their association with yellow pigment content. Crop Sci , 2011, 51 (4) : 1580–1590. DOI:10.2135/cropsci2010.12.0689 |
| [28] | Dong CH, Ma ZY, Xia XC, et al. Allelic variation at the TaZds-A1 locus on wheat chromossome 2A and development of a functional marker in common wheat. Journal of Integrative Agriculture , 2012, 11 (7) : 1067–1074. DOI:10.1016/S2095-3119(12)60099-9 |
| [29] | 董长海. 普通小麦籽粒黄色素含量相关基因的克隆与功能标记开发[D]. 保定: 河北农业大学, 2011. |
| [30] | Geng HW, Xia XC, Ghang LP, et al. Development of functional markers for a lipoxygenase gene Talox-B1 on chromosome 4BS in common wheat. Crop Science of America , 2012, 52 (2) : 568–576. |
| [31] | 吴萍. 小麦籽粒脂肪氧化酶活性功能标记的开发与应用[D]. 合肥: 安徽农业大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10364-1014147856.htm |
| [32] | Guo GA, Song YX, Zhou RH, et al. Discovery, evaluation and distribution of haplotypes of the wheat Ppd-D1 gene. New Phytologist , 2010, 185 (3) : 841–851. DOI:10.1111/j.1469-8137.2009.03099.x |
| [33] | Slierman JD, Yan L, Talbert L, et al. A PCK marker for growth habit in common wheat based on allelic variation Vrn-A1 gene. Crop Science Society of America , 2004, 44 (5) : 1832–1838. DOI:10.2135/cropsci2004.1832 |
| [34] | Zhao XL, Ma W, Gale KR, et al. Identification of SNPs and development of functional markers for LMW-GS genes at Glu-D3 and Glu-B3 loci in bread wheat(Triticum aestivum L.). Molecular Breeding , 2007, 20 (3) : 223–231. DOI:10.1007/s11032-007-9085-y |
| [35] | Liu SX, Chao SM, Anderson JA. New DNA markers for high molecular weight glutenin subunits in wheat. Theor Appl Genet , 2008, 118 (1) : 177–183. DOI:10.1007/s00122-008-0886-0 |
| [36] | Ma W, Zhang W, Gale KR. Multiplex-PCR typing of high molecular weight glutenin alleles in wheat. Euphytica , 2003, 134 : 51–60. DOI:10.1023/A:1026191918704 |
| [37] | Schwarz G, Felsenstein FG, Wenzel G. Development and validation of a PCR-based marker assayfor negative selection of the HMW glutenin allele Glu-B1(Bx-6)in wheat. Theor Appl Genet , 2004, 109 (5) : 1064–1069. DOI:10.1007/s00122-004-1718-5 |
| [38] | Ragupathy R, Naeem HA, Reimer E, et al. Evolutionary origin of the segmentalduplication encompassing the wheat GLU-B1 locus encoding the overexpressed Bx7(Bx70E)high molecular weight glutenin subunit. Theor Appl Genet , 2008, 116 (2) : 283–296. DOI:10.1007/s00122-007-0666-2 |
| [39] | Lei ZS, Gale KR, He ZH, et al. Y-type gene specific markers for enhanced discrimination of high-molecular weight glutenin alleles at the Glu-B1-1d locus in hexaploid wheat. J Cereal Sci , 2006, 43 (1) : 94–101. DOI:10.1016/j.jcs.2005.08.003 |
| [40] | Wang LH, Li GY, Pena RJ, et al. Development of STS markers and establishment of multiplex PCR for Glu-A3 alleles in common wheat(Triticum aestivum L.). J Cereal Sci , 2010, 51 (3) : 305–312. DOI:10.1016/j.jcs.2010.01.005 |
| [41] | Wang LH, Zhao XL, He ZH, et al. Characterization of low-molecular-weight glutenin subunit Glu-B3 genes and development of STS markers in commonwheat(Triticum aestivum L.). Theor Appl Genet , 2009, 118 (3) : 525–539. DOI:10.1007/s00122-008-0918-9 |
| [42] | Mika S, Patricia V, Goro I, et al. A novel codominant marker for selection of the null Wx-B1 allele in wheat breeding programs. Molecular Breeding , 2009, 23 (2) : 209–217. DOI:10.1007/s11032-008-9226-y |
| [43] | 王昊龙, 韩俊杰, 李卫华, 等. 不同抗性淀粉含量的小麦品种(系)SBEⅡa基因启动子序列分析. 石河子大学学报: 自然科学版 , 2015, 33 (1) : 60–66. |
| [44] | 鞠丽萍, 张帆, 蒋雷, 等. 小麦TaFer-A1 基因抗旱相关分子标记的开发. 麦类作物学报 , 2013, 33 (5) : 901–906. |
| [45] | 王智兰, 毛新国, 李昂, 等. 小麦蛋白磷酸酶2A结构亚基基因TaPP2Aa的功能标记作图. 中国农业科学 , 2011, 44 (12) : 2411–2421. |
| [46] | 张帆, 蒋雷, 鞠丽萍, 等. 一个普通小麦Trx超家族新基因TaNRX的克隆与抗旱相关标记开发. 作物学报 , 2014, 40 (1) : 29–36. |
| [47] | 吕广德. 小麦TaOSCA1.4基因的克隆、标记开发和功能分析[D]. 泰安: 山东农业大学. 2015. |
| [48] | Gennaro A, Koebner RMD, Ceoloni C. A candidate for Lr19, an exotic gene conditioning leaf rust resistance in wheat. Funct Integr Genomics , 2009, 9 (3) : 325–334. DOI:10.1007/s10142-009-0115-1 |
| [49] | Helguera M, Vanzetti L, Soria M, et al. PCR markers for Triticum speltoides leaf rust resistance gene Lr51 and their use to develop isogenic hard red spring wheat lines. Crop Sci , 2005, 45 (2) : 728–734. DOI:10.2135/cropsci2005.0728 |
| [50] | 刘兴舟. Vrn、Ppd-D1和Lr34/Yr18基因在山东小麦品种中的分子检测和分布的研究[D]. 泰安: 山东农业大学, 2009. http://www.oalib.com/references/16214436 |
| [51] | Tommasini L, Yahiaoui N, Srichumpa P, et al. Development of functional markers specific for seven Pm3 resistance alleles and their validation in the bread wheat gene pool. Theor Appl Genet , 2006, 114 (1) : 165–175. DOI:10.1007/s00122-006-0420-1 |
| [52] | 伍玲, 夏先春, 朱华忠, 等. CIMMYT 273个小麦品种抗病基因Lr34/Yr18/Pm38的分子标记检测. 中国农业科学 , 2010, 43 (22) : 4553–4561. |
| [53] | Lagudah ES, Krattinger SG, Herrera-Foessel S, et al. Gene-specific markers for the wheat gene Lr34/Yr18/Pm38 which confers resistance to multiple fungal pathogens. Theor Appl Genet , 2009, 119 (5) : 889–898. DOI:10.1007/s00122-009-1097-z |
| [54] | Liu D, Xia XC, He ZH, et al. A novel homeobox-like gene associated with reaction to stripe rust and powdery mildew in common wheat. Phytopathology , 2009, 98 (12) : 1291–1296. |
| [55] | 张照贵. 小麦TaSnRK2_10基因的克隆_标记开发和功能分析[D]. 泰安: 山东农业大学, 2014. |
| [56] | 王倩, 毛新国, 昌小平, 等. 小麦TaSnRK2. 10的多态性及与农艺性状的关联. 中国农业科学 , 2014, 47 (10) : 1865–1877. |
| [57] | Wei B, Jing RL, Wang CS, et al. Dreb1 genes in wheat(Triticum aestivum L.)development of functional markers and gene mapping based on SNPs. Molecular Breeding , 2009, 23 (1) : 13–22. DOI:10.1007/s11032-008-9209-z |
| [58] | Himi E, Noda K. Red gain colour gene(R)of wheat is a myb-type transcription factor. Euphytica , 2005, 143 : 239–242. DOI:10.1007/s10681-005-7854-4 |
| [59] | Himi E, Maekawa M, Miura H, et al. Development of PCR markers for Tamyb10 related to R-1, red grain color gene in wheat. Theor Appl Genet , 2011, 122 (8) : 1561–1576. DOI:10.1007/s00122-011-1555-2 |
| [60] | 李婷, 陈杰, 陈锋, 崔党群. 黄淮麦区地方小麦品种子粒颜色相关基因Tamyb10-1等位变异检测. 植物遗传资源学报 , 2014, 15 (5) : 1089–1095. |
| [61] | 陈杰, 陈锋, 詹克慧, 等. 普通小麦籽粒Tamyb10基因等位变异的分子检测. 麦类作物学报 , 2013, 33 (2) : 224–229. |
| [62] | 陈杰. 小麦籽粒和面粉颜色相关性状的基因型鉴定及其功能标记开发[D]. 郑州: 河南农业大学, 2013. |
| [63] | Yang Y, Zhao XL, Xia LQ, et al. Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting tolerance in Chinese wheats. Theoretical and Applied Genetics , 2007, 115 (7) : 971–980. DOI:10.1007/s00122-007-0624-z |
| [64] | 刘世鑫. 休眠基因Viviparous-1A在中国小麦3A染色体上等位变异的鉴定及STS分子标记的开发[D]. 呼和浩特: 内蒙古农业大学, 2012. http://www.oalib.com/references/18795042 |
| [65] | Chen F, Zhang FY, Xia XC, et al. Distribution of puroindoline alleles in bread wheat cultivars of the Yellow and Huai valley of China and discovery of a novel puroindoline a allele without PINA protein. Mol Breeding , 2012, 29 (2) : 371–378. DOI:10.1007/s11032-011-9553-2 |
| [66] | Ellis M, Spielmeyer W, Gale R, et al. “Perfect” markers for the Rht-B1b and Rht-Dlb dwarfing genes in wheat. Theoretical and Applied Genetics , 2002, 105 (6-7) : 1038–1042. DOI:10.1007/s00122-002-1048-4 |
| [67] | 冉从福, 邵慧, 余静, 等. 小麦CO-like基因TaC09的克隆及结构分析. 麦类作物学报 , 2014, 34 (10) : 1319–1326. |
| [68] | Distelfeld A, Uauy C, Fahima T, et al. Physical map of the wheat high-grain protein content gene Gpc-B1 and development of a high-throughput molecular marker. New Phytologist , 2006, 169 (4) : 753–763. DOI:10.1111/nph.2006.169.issue-4 |
| [69] | Uauy C, Distelfeld A, Fahima T, et al. A NAC gene regulating senescence improves grain protein, zinc, and iron content in wheat. Science , 2006, 314 (5803) : 1298–1301. DOI:10.1126/science.1133649 |
| [70] | Zhang YJ, Miao XL, Xia XC, et al. Cloning of seed dormancy genes(TaSdr)associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker. Theor Appl Genet , 2014, 127 (4) : 855–866. DOI:10.1007/s00122-014-2262-6 |
| [71] | 李冰, 张照贵, 王佳佳, 等. 小麦GDH1基因克隆及其功能标记开发. 山东农业科学 , 2014, 46 (10) : 6–11. |
| [72] | 刘亚男, 夏先春, 何中虎. 普通小麦TaDep1基因克隆与特异性标记开发. 作物学报 , 2013, 39 (4) : 589–598. |
| [73] | 雷梦林, 李昂, 昌小平, 等. 小麦转录因子基因W16的功能标记作图和关联分析. 中国农业科学 , 2012, 45 (9) : 1667–1675. |
| [74] | Chang JZ, Zhang JN, Mao XG, et al. Polymorphism of TaSAP1-A1 and its association with agronomic traits in wheat. Planta , 2013, 263 (6) : 1495–1508. |
| [75] | 周渭皓, 孙建喜, 陈杰, 等. 甘肃春小麦八氢番茄红素基因的等位变异. 麦类作物学 , 2014, 34 (8) : 1036–1043. |
| [76] | Slade AJ, Fuerstenberg SI, Loeffler D, et al. A reverse genetic, nontransgenic approach to wheat crop improvement by TILLING. Nature Biotechnology , 2004, 23 (1) : 75–81. |
| [77] | 张丽, 颜泽洪, 郑有良, 等. 小麦中国春背景下长穗堰麦草Ee染色体组特异AFLP及STS标记的建立. 农业生物技术学报 , 2008, 16 (3) : 465–473. |