红麻(Hibiscus cannabinus L.)属于锦葵科木槿属一年生韧皮纤维作物,传统用途是作为纺织、生产麻绳、麻袋、地毯等的原料。同时,红麻也是一种多用途作物,被广泛应用于造纸、建材、土壤修复、饲料等各种领域[1-2]。
作物细胞质雄性不育(CMS)是作物杂种优势利用的主要途径,利用CMS配制杂交种,克服了人工授粉的种种弊端,大大减少劳动量,同时能够提高杂交种子的纯度,增加作物的产量[3]。作物雄性不育表现为花药(包括花粉)的发育异常。花药的发育是一个受到严格调控的过程,特别是在转录水平的调控尤其重要。转录因子是这一调控过程中的主要参与者,在众多的转录因子中,MYB类转录因子是植物中最大的一类转录因子家族之一。目前众多研究结果表明MYB类转录因子的功能具有多样性,包括参与植物次生代谢调控,激素和环境因子的应答,细胞分化及细胞周期等多种过程[4]。MYB21属于R2R3型MYB类转录因子,Song等[5]在拟南芥中发现AtMYB21基因与AtMYB24能够与JAZ蛋白相互作用而影响茉莉酮酸酯(JA)的代谢,从而调控雄蕊花药的发育。姚润鹏[6]从大白菜花瓣退化突变体的转录组分析中发现了MYB21基因是与花器官发育相关的。Cheng等[7]在研究赤霉素(GA)和茉莉酸(JA)对拟南芥的作用时发现GA能够促进JA的生物合成而调控MYB21基因的表达,从而促进雄蕊花丝的延伸。但是迄今为止还没有看到有关MYB类转录因子调控作物CMS发生的研究报道。本课题组前期通过转录组测序发现红麻MYB21的表达量在CMS系花药中显著下调,故推测MYB21参与了红麻CMS发生的调控。基于此,本研究克隆MYB21基因,研究MYB21在红麻不育系和保持系不同的组织器官的表达模式,并构建MYB21基因的过表达与干扰载体,旨在为研究MYB21基因在红麻花药发育中的功能奠定基础。
1 材料与方法 1.1 材料红麻不育系P3A与保持系P3B(本课题组选育)种植于广西大学实验基地。
主要试剂及菌株:CTAB裂解液、DEPC,DNAaseI,反转录试剂盒,Fastpfu酶,DNA回收试剂盒,T4 DNA连接酶,大肠杆菌感受态细胞DH5α,LB培养基,各种相关限制性内切酶,相关载体,荧光定量试剂盒等。
1.2 方法 1.2.1 红麻花药总DNA和总RNA的提取红麻不育系P3A和保持系P3B,取盛花期时的花药,置于-80℃冰箱保存,采用改良CTAB法[8, 9]提取总DNA和总RNA,利用琼脂糖凝胶电泳和核酸浓度测定仪来检测DNA和RNA的完整性。
1.2.2 反转录用PrimeScript Reverse Transcriptase反转录试剂盒(TaKaRa,日本)进行反转录,并以红麻跨内含子引物COXⅡ检测反转录得到的cDNA中是否含有总DNA。
1.2.3 MYB21基因全长的克隆根据不育系(P3A)和保持系(P3B)花药转录组高通量测序结果[10]设计引物(表 1)扩增红麻MYB21基因全长。PCR扩增选用高保真酶Fastpfu DNA聚合酶,扩增程序为:95℃预变性3 min;95℃ 30 s,53℃ 40 s,72℃ 1 min,32 个循环;72℃延伸10 min。同时以ddH2O为模板设置阴性对照。PCR产物经DNA凝胶回收试剂盒回收并连接到pMD-19T载体上,转化到大肠杆菌感受态DH5α中,挑取阳性克隆送至华大基因测序。
根据已经克隆的MYB21基因开放阅读框序列设计加入相应酶切位点的一对引物ORF-R和ORF-F(表 1),以红麻花药反转录得到的cDNA为模板,采用高保真酶FastPfu DNA 聚合酶进行PCR扩增,凝胶回收PCR产物,然后连接、转化,挑取阳性克隆测序,用限制性内切酶Xba Ⅰ和Kpn Ⅰ双酶切阳性质粒并凝胶回收小片段,同时双酶切PBI121-GFP载体并回收,最后连接、转化,以卡那霉素筛选阳性菌落,菌液测序并提取质粒进行酶切验证。
1.2.5 MYB21基因RNAi干扰载体的构建根据干扰载体序列选取的原则[11],选择MYB21基因的cDNA的428 bp序列作为干扰片段,并根据中间载体PKNANIBAL上的插入位点,设计正向引物与反向引物(表 1)进行克隆。克隆得到的正向片段命名为RNAi-Z,反向片段命名为RNAi-F。
正向片段的插入:用Xho Ⅰ和Kpn Ⅰ双酶切RNAi-Z质粒和PKNANIBAL质粒,经回收,连接、转化,以卡那霉素平板筛选阳性克隆,酶切鉴定连接正确后命名为PK-R1。
反向片段的插入:用Xba Ⅰ和Cla Ⅰ双酶切PK-R1和RNAi-F,经凝胶回收、连接、转化、质粒抽提,质粒酶切确认连接正确后命名为PK-R1-F2;
最后,将PK-R1-F2连接到植物双元表达载体pART27上:采用Not Ⅰ分别酶切PK-R1-F2和pART27,回收、连接、转化之后,以含有壮观霉素的平板来筛选阳性克隆,菌液测序并质粒酶切鉴定后确认RNAi干扰载体构建成功,将此载体命名为pART27-PK-R1-F2。
1.2.6 荧光定量PCR选择红麻甘油醛-3-磷酸脱氢酶GAPDH为内参基因,设计MYB21基因和GAPDH基因的荧光定量的引物(表 1),分别用P3A和P3B的根、叶和花药部分的总RNA反转录的cDNA为模板,TransStart Tip Green qPCR SuperMix荧光定量试剂盒(北京全式金公司)进行荧光定量PCR研究MYB21基因的表达模式。反应体系为15 µL:模板为1.5 µL,样品设3次重复,同时设置以水为模板的阴性对照。以95℃ 30 s,95℃ 5 s,60℃ 20 s,36 cycles的反应程序在荧光定量仪器(Bio-Rad,美国)上进行扩增反应。
2 结果 2.1 红麻核酸质量及反转录检测从琼脂糖凝胶电泳图(图 1-A)可以看出,提取的红麻不育系P3A和保持系P3B花药总RNA条带清晰,完整性较好。Not Ⅰ有DNA污染,以跨内含子引物对COXⅡ-R和COXⅡ-F对反转录的cDNA进行PCR扩增。该引物对以总DNA为模板扩增出来的片段是2 009 bp,以cDNA为模板扩增出来的片段是518 bp,琼脂糖凝胶电泳图结果(图 1-C)显示,反转录得到的cDNA没有总DNA残留。cDNA质量满足实验的需要。
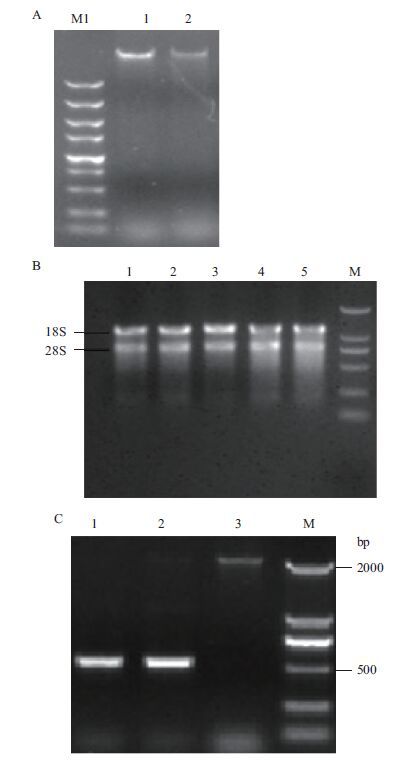
|
| 图 1 红麻花药核酸质量及反转录检测结果 A:花药总DNA琼脂糖凝胶电泳(1:P3B DNA,2:P3A DNA);B:花药总RNA琼脂糖凝胶电泳(1-3:P3A RNA,泳道3-4:P3B RNA);C:反转录检测(1:P3A cDNA扩增;2:P3B cDNA扩增;3:P3B DNA扩增);M1:BM5000 DNA marker;M:BM2000 DNA marker |
分别以P3A和P3B花药的cDNA以及P3B的总DNA为模板,以MYB21-R和MYB21-F为引物,克隆MYB21基因的全长,得到的克隆片段分别命名为P3A-MYB21(RNA),P3B-MYB21(RNA)以及P3B-D-MYB21(图 2)。
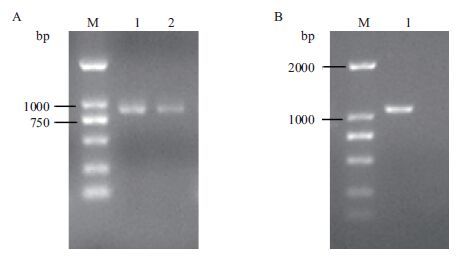
|
| 图 2 MYB21基因扩增 A(1:P3A cDNA;2:P3B cDNA);B(1:P3B gDNA;M:BM2000 DNA marker) |
将MYB21基因的cDNA序列和DNA序列用DNAMAN软件进行比对,发现MYB21基因在cDNA和总DNA水平其核苷酸同源性达到83.21%,其中MYB21基因在不育系P3A和保持系P3B的cDNA水平上序列是一致的,它们的全长均为922 bp,开放阅读框为843 bp,编码280个氨基酸,而总DNA序列则包含3个外显子和两个内含子,其全长为1 108 bp。ATG为起始密码子,由下图可知第1个外显子为155 bp,第2个外显子129 bp,第3个外显子559 bp,3个编码区序列总长为843 bp,第1个内含子89 bp,第2个内含子97 bp,两个非编码区总长为186 bp(图 3)。序列提交到NCBI,提交的DNA序列号为:KT898146。

|
| 图 3 MYB21基因序列 虚线对应的DNA序列为内含子序列 |
利用ORF finder 寻找扩增产物的最长ORF,在NCBI进行保守结构域搜索,结果(图 4)显示所扩增的产物序列包含两个SANT结构域,即MYB超级家族的典型保守结构域,说明所克隆得到MYB21基因是属于R2R3型MYB转录因子基因。

|
| 图 4 MYB21基因保守结构域搜索结果 |
另外,将MYB21基因所编码的氨基酸序列与其他物种中的氨基酸序列进行比对发现,MYB21基因与雷蒙德氏棉的MYB108-like基因以及陆地棉中的MYB5基因同源性较高,序列同源性分别达到67%和63%(图 5)。
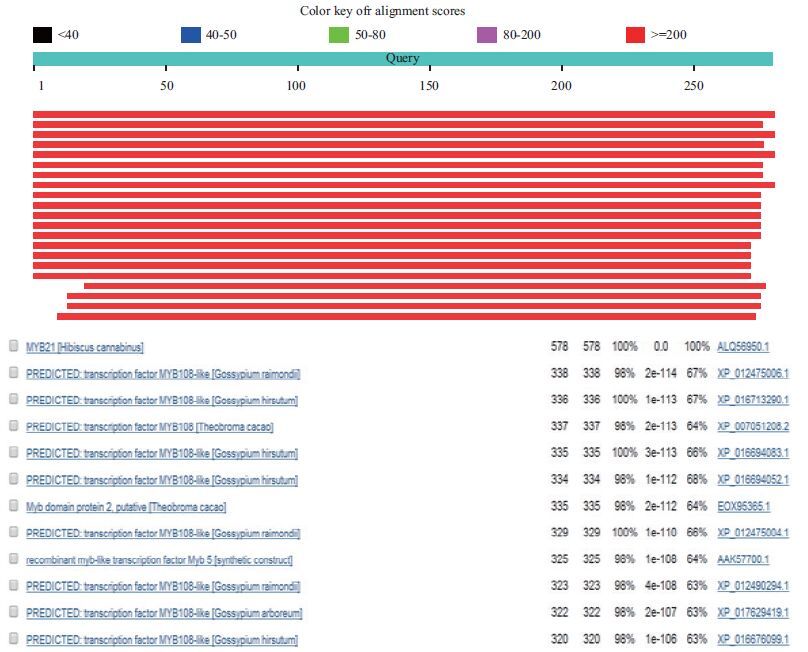
|
| 图 5 MYB21基因与其它物种氨基酸序列比对 |
将用加入酶切位点的MYB21基因引物克隆所得的基因片段与PBI121-GFP载体双酶切之后进行连接,利用PBI121载体序列所设计的引物进行菌液测序测序结果与目的基因序列通过DNAMAN进行比对(图 6),发现测序序列包含完整目的基因序列。

|
| 图 6 测序结果比对(P-1为表达载体菌液测序编号) |
同时进行酶切验证,酶切下来的片段大小与目的片段大小一致(图 7)。证明目的基因片段成功连接到表达载体中,将构建成功的表达载体命名为PBI121-MYB21。
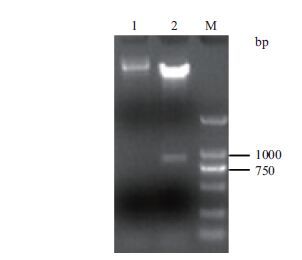
|
| 图 7 表达载体酶切验证结果 1:Xba Ⅰ、Kpn Ⅰ酶切PBI121-MYB21;2:PBI121-GFP质粒;M:BM 2000 DNA marker |
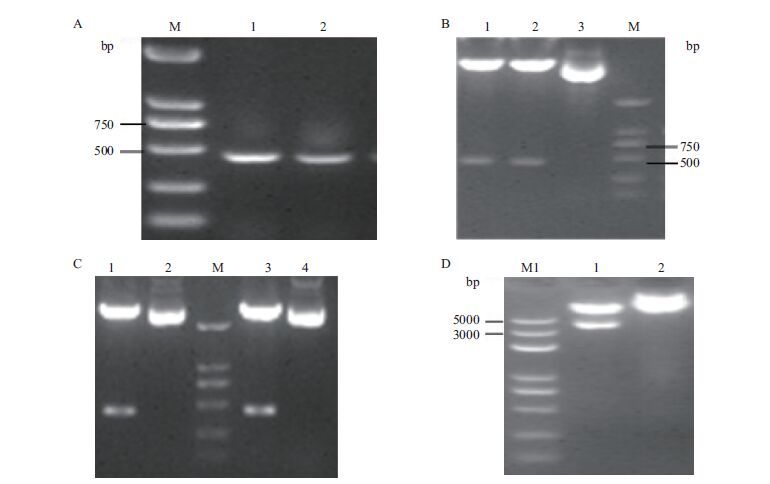
红麻MYB21基因扩增片段大小与所选取的干扰片段大小一致,均在400 bp左右(图 8-A),双酶切RNAi-Z和RNAi-F得到的片段长度(图 8-B)经菌液测序其结果与所选取的正向片段和反向片段序列一致,这充分说明了正向片段与反向片段成功连接到了pMD19-T载体上。对PK-R1和PK-R1-F2分别进行双酶切,所获得的酶切片段与干扰片段长度一致(图 8-C),说明干扰片段连接到中间载体PKANNIBAL成功。最后,对pART27-PK-R1-F2用Not Ⅰ酶切,并以pART27-PK-R1-F2质粒做对照,凝胶电泳图结果(图 8-D)显示酶切下来的片段与目的片段大小一致,同时利用PKANNIBAL载体序列的通用引物进行菌液测序,测序结果(图 9)显示所插入的片段与目的片段碱基序列一致,说明干扰片段成功连接到相应载体上。
|
| 图 8 干扰载体构建图 A:干扰片段扩增(1:正向片段扩增,2:反向片段扩增);B:干扰片段pMD-19T载体酶切结果(1:酶切RNAi-Z,2:酶切RNAi-F,3:质粒对照);C:干扰片段中间载体酶切结果(1:双酶切PK-R1,3:双酶切PK-R1-F2,2、4:PKANNIBAL质粒对照);d:Not Ⅰ酶切pART27-PK-R1-F2(1:Not Ⅰ酶切pART27-PK-R1-F2,2:pART27-PK-R1-F2质粒);M:BM2000 DNA marker;M1:BM5000 DNA marker |

|
| 图 9 干扰载体测序结果比对(PPZF6为干扰载体菌液测序编号) |
本研究从红麻不育系材料P3A和保持系材料P3B的根、叶和花药中提取总RNA,进行反转录,通过荧光定量PCR反应,运用双标准曲线法分析反应数据来研究MYB21基因在两者之间不同组织器官的表达量情况。以管家基因GAPDH和MYB21基因的5个梯度浓度标准品、阴性对照和待测样本分别设置3个重复同时上机,获得GAPDH和MYB21基因的扩增曲线和标准曲线。结果显示阴性对照没有检测到荧光信号,融解曲线峰形单一,管家基因和MYB21基因的标准曲线相关系数的R2>0.999,表明荧光定量反应体系没有污染,引物特异性好,且重复性较高,由此得出的荧光定量的实验数据具有可靠性与真实性。
定量分析结果(图 10-A)表明MYB21基因在不育系花药中的表达量极显著低于保持系,仅为保持系的0.07倍,在根中表达量下调为0.28倍,而在叶片中的表达量略微高于保持系(1.41倍)。比较分析保持系的根、叶和花药中的定量数据,发现MYB21基因主要在花药中表达(图 10-B)。

|
| 图 10 MYB21基因在红麻P3A和P3B花药、叶片及根中的表达量 |
MYB类转录因子是植物中最为重要的一类转录因子,在植物生长发育中扮演着重要作用。Shin等[12]研究发现拟南芥中MYB21基因特异性在花中进行表达,Li等[13]利用RT-PCR技术分析了AtMYB57、AtMYB21、AtMYB24、AtMYB116和AtMYB62在拟南芥根、莲座叶、茎生叶、花和角果中的表达量,其中MYB21基因在拟南芥各个部分都有一定量的表达,但主要是在花中进行表达。Yang等[14]研究发现与AtMYB21氨基酸序列同源性达68.5%的AtMYB24也是主要在花中表达。本研究首次从红麻中克隆到转录因子MYB21,并明确了其序列结构,进一步分析了其表达模式,与前人研究结果相似,发现该基因主要在红麻花药中表达,在根和叶中只有轻微的表达。而且在不育系花药中呈现极显著下调表达模式,因此推测该基因可能参与了红麻花药发育的调控。
Song等[5]研究了MYB21基因在转基因拟南芥中表达量情况,当转基因植株MYB21的表达水平是野生型拟南芥中的20-100倍时,植株出现严重或完全丢失育性,而表达量是野生型1-5倍时,转基因植株其育性改变不明显,这说明了MYB21基因的表达量水平的高低对于雄蕊发育是很重要的。因此后续研究可以将构建的过表达载体和干扰载体进行转基因实验,在鉴定载体构建成功的同时,一方面,将构建的过表达载体通过花粉管通道注射红麻或叶盘法转烟草研究MYB21基因与植物育性的关系,而且构建的过表达载体以本实验室改造过的含有绿色荧光蛋白的PBI121为载体,为后续转基因验证该基因的功能及亚细胞定位提供便利。另一方面,结合RNAi载体所具有的特异性沉默某个基因表达的特性,将构建的干扰载体进行同样的转基因实验,从反向遗传学角度出发充分研究MYB21基因的功能。
另外,转录因子是通过结合到靶基因而发挥作用的,Shin等[12]发现拟南芥MYB21可以直接调节苯丙氨酸裂解酶PAL和交替氧化酶AOX1a的表达,从而发挥调控苯丙氨酸的代谢过程。Song等[5]研究发现MYB21和MYB24与JAZ 蛋白结合影响花药发育和花丝延长,并且推断MYB21和MYB24是与JAZ蛋白分离之后激活下游各种不同的基因来参与这个过程的。因此后续研究拟进一步筛选MYB21靶基因并分析靶基因的表达模式,从而揭示MYB21在调控红麻CMS发生的作用。
4 结论成功克隆了红麻不育系P3A和保持系P3B中的MYB21基因,明确了MYB21基因序列结构;分析了MYB21基因在不育系和保持系各组织器官的表达模式,研究发现MYB21基因主要在花药中进行表达,并且两系之间表达量呈极显著差异;经过酶切和测序验证,过表达载体和干扰载体构建成功,能够用于后续转基因功能研究。
| [1] | 李德芳. 红/黄麻新用途综合开发与国际合作. 中国麻业科学 , 2007 (增刊) : 411–414. |
| [2] | 陶爱芬, 张晓琛, 祁建民. 红麻综合利用研究进展与产业化前景. 中国麻业科学 , 2007 (1) : 1–5. |
| [3] | 胡滨, 陈观平, 施农农, 等. 植物细胞质雄性不育及其在育种中的应用. 浙江林学院学报 , 2006, 23 (6) : 689–693. |
| [4] | Ambawat S, Sharma P, Yadav NR, et al. MYB transcription factor genes as regulators for plant responses:an overview. Physiology and Molecular Biology of Plants , 2013, 19 (3) : 307–321. DOI:10.1007/s12298-013-0179-1 |
| [5] | Song SS, Qi TC, Huang H, et al. The jasmonate-ZIM domain proteins interact with the R2R3-MYB transcription factors MYB21 and MYB24 to affect jasmonate-regulated stamen development in Arabidopsis. The Plant Cell , 2011, 23 (3) : 1000–1013. DOI:10.1105/tpc.111.083089 |
| [6] | 姚润鹏. 大白菜花瓣退化突变体pdm的转录组分析[D]. 沈阳:沈阳农业大学, 2015 http://cdmd.cnki.com.cn/article/cdmd-10157-1015441002.htm |
| [7] | Cheng H, Song SS, Xiao LT, et al. Gibberellin acts through jasmonate to control the expression of MYB21, MYB24, and MYB57 to promote stamen filament growth in Arabidopsis. PLoS Genetics , 2009, 5 (3) : e1000440. DOI:10.1371/journal.pgen.1000440 |
| [8] | 白凤虎, 谢晓美, 李德芳, 等. 改良CTAB法用于提取红麻成熟叶片高质量DNA的研究. 中国麻业科学 , 2007, 29 (3) : 158–165. |
| [9] | 陈美霞, 陈富成, 颜克伟, 等. 红麻叶片高质量RNA提取方法比较分析. 福建农林大学学报:自然科学版 , 2011, 40 (6) : 561–565. |
| [10] | Chen P, Ran SM, Li R, et al. Transcriptome de novo assembly and differentially expressed genes related to cytoplasmic male sterility in kenaf(Hibiscus cannabinus L. ). Molecular Breeding , 2014, 34 (4) : 1879–1891. DOI:10.1007/s11032-014-0146-8 |
| [11] | Wesley SV, Liu Q, Wielopolska A, et al. Custom knock-outs with hairpin RNA-mediated gene silencing. Methods in Molecular Biology , 2003, 23 (6) : 273–286. |
| [12] | Shin B, Choi G, Yi H, et al. AtMYB21, a gene encoding a flower-specific transcription factor, is regulated by COP1. The Plant Journal , 2002, 30 (1) : 23–32. DOI:10.1046/j.1365-313X.2002.01264.x |
| [13] | Li JG, Yang XY, Wang Y, et al. Two groups of MYB transcription factors share a motif which enhances trans-activation activity. Biochemical and Biophysical Research Communication , 2006, 341 (4) : 1155–1163. DOI:10.1016/j.bbrc.2006.01.077 |
| [14] | Yang XY, Li JG, Pei M, et al. Over-expression of a flower-specific transcription factor gene AtMYB24 causes aberrant anther development. Plant Cell Reports , 2007, 26 (2) : 219–228. DOI:10.1007/s00299-006-0229-z |





