2. 农业部黄土高原作物基因资源与种质创制重点实验室, 太原 030031
2. Key Laboratory of Crop Gene Resources and Germplasm Enhancement on the Loess Plateau of Ministry of Agriculture, Taiyuan 030031
中国是世界上位居第二的玉米(Zea mays L.)生产大国,年玉米种植面积3 000多万hm2,玉米产量达亿余吨,占世界上玉米总产量的20%。即便如此,从2009年开始,我国还是成为玉米的净进口国。2013年我国玉米产量虽高达2.13亿t,但玉米进口量也提高到500万t,足见我国玉米市场的潜力以及这种潜力所形成的对玉米生产的压力。诚然我国玉米生产能力和水平都有大幅度提高,但影响和制约玉米生产的诸多因素依然存在,其中,杂草清除无疑是最令人困扰的环节之一。玉米田杂草种类多、数量大,在整个玉米生产期都存在与玉米竞争环境资源、进而影响玉米产量的现象。在我国广大农村,每年都要花费很大的财力和人力来处理田间杂草,造成了资源的极大浪费。随着我国农村深化改革步伐的加快,集约化、规模化的生产方式日趋可待,人工喷雾除草剂清理杂草的时代也将很快过去,因此培育适合农田大规模、机械化喷施除草剂的玉米品种更显得非常重要和十分迫切。
草甘膦是一种广谱性除草剂,它的靶酶是位于质体上5-烯醇丙酮莽草酸-3-磷酸合酶(5-enolpyruvylshikimate-3-phosphate synthase,EPSPS),其作用是阻断氨基酸的合成,最终因营养缺乏而导致杂草等死亡[1]。研究证明,草甘膦价格低廉,土壤吸附性强,对动物无毒性,也无致畸、致癌及遗传毒性,对双子叶和单子叶,草本、木本灌木及乔木均有一定的防除效果[2]。将编码EPSPS的aroA基因突变并导入生物体,可使植物或细菌获得对草甘膦的耐性[3-7]。
目前应用较多的CP4-ESPSPS抗草甘膦基因来源于土壤农杆菌CP4株系[8],自1996年成功培育出了第一批耐草甘膦的耐除草剂作物后[9],相关研究有了很大发展。国外Sidhu 等[10]利用对草甘膦不敏感的CP4 基因转化玉米,获得了耐草甘膦转基因玉米并投入商业化生产;接着耐草甘膦基因在玉米[11]、大豆[12]、苜蓿[13]、油菜[14]、甜菜[15]、烟草[16]、小麦[17]、棉花[18]等作物上也转化成功。国内,谢龙旭等[19]构建了含草甘膦耐性突变基因(aroA-M12)的植物表达载体pCM12-s1m,通过农杆菌介导转化到烟草中,经筛选获得了转基因烟草,对草甘膦有较强的耐性;Tong等[20]通过在体外培养基中逐渐增加草甘膦浓度的离体筛选到耐草甘膦幼苗;余桂荣等[21]利用玉米胚型愈伤组织获得了对草甘膦具有一定耐性的突变体植株;赫福霞等[22]通过基因枪轰击,将构建的pMAGUHM 载体(其上携带有耐草甘膦基因2mG2-epsps 基因)转化到玉米愈伤组织,利用草甘膦筛选得到耐草甘膦植株80 株,其中PCR 检测阳性植株为36 株,转基因阳性率为45%。综上所述,转耐草甘膦作物研究在国内起步早,且取得了较大进展。但转化过程多采用国内外通用的基因枪法、农杆菌介导法等,应用具有国内自主知识产权的转化方法和耐草甘膦基因的报道还较少。
基于以上原因,本研究采用的转化方法和转化用目的基因均具有我国自主知识产权,即利用花粉介导法[23]将耐草甘膦基因aroA-M12导入玉米自交系‘昌7-2’,期望得到耐草甘膦除草剂的转基因玉米植株,并能筛选到目的基因高效表达、草甘膦耐性提高的转基因纯合株系。
1 材料与方法 1.1 材料 1.1.1 植物材料试验植物材料为改良玉米自交系‘昌7-2’(本实验室保存)。该材料具有配合力强、抗病抗虫等特点,适合作为玉米制种亲本广泛应用。
1.1.2 质粒供试质粒为带有耐草甘膦基因的植物表达载体pBI101-aroA-M12,CaMV35S启动子和nosT终止子调控目的基因aroA-M12(由中山大学生物工程中心提供)的表达,宿主菌为大肠杆菌(E. coli)菌株DH5α。图 1是质粒pBI101-aroA-M12的物理图谱。

|
| 图 1 质粒pBI101-aroA-M12的物理图谱 RB、LB:分别为T-DNA的右边界、左边界序列;NosP,35S:起动子,NosT:终止子;aroAM12:编码EPSPS |
质粒DNA按《分子克隆》中碱解法提取[24]。
1.2.1.2 花粉介导法转化转化步骤参见文献[23]并略有改进。称取一定重量的新鲜取回的花粉立刻置于预先加入预冷的15%蔗糖溶液的平底试管中,做第一次超声波处理,此处理的目的使花粉表面的核酸酶失活,并使花粉处于感受态。按1∶50 000的比例加入质粒DNA,并在溶液中加入少量的硼酸(50 mg/L)、GA3(40 mg/L)以促进花粉在授粉后的萌发。进行第二次超声波处理;最后,将处理好的花粉快速授粉于预先套袋并已剪去大部分花丝的雌穗花丝上,套袋,秋后收获种子(T0种子)。
1.2.1.3 田间播种2009年,T0代种子263粒全部播种,4叶期全部取样进行PCR检测,并对PCR检测阳性结果材料做Southern杂交分析,Southern杂交阳性结果植株自交授粉收获T1代种子54穗,依次标记为T1-1、T1-2 … T1-54;2010年,T1代收获的54穗种子各播种5行得T2植株,每5行为一个株系,分别标记为T2-1、T2-2 … T2-54,花期选择分子检测结果阳性、生长健壮、且其它农艺性状优良的10个株系(T2-2、T2-8、T2-9、T2-16、T2-21、T2-24、T2-33、T2-37、T2-43、T2-49)套袋自交收获T2种子;2011年,所选T2代10个株系按各播种5个株系得到T3代植株,每株系5行,按T2代标号从小到大顺序分别标记为T3-1-1、T3-1-2 T3-1-3 T3-1-4 T3-1-5 T3-2-1… T3-10-5,得T3代植株并收获T3种子;2012年,播种来自T3 代种子(T3-3-1、T3-3-2、T3-3-3、T3-3-4、T3-3-5均来自T1-9)各2个株系,每株系5行,以得到的T4植株做父本,以非转化‘昌7-2’植株做母本,杂交得到F1杂种;2013年F1杂种播种250行。
1.2.2 转化植株的分子检测 1.2.2.1 植物DNA提取所有样品按CTAB方法[25]提取植物DNA。
1.2.2.2 PCR扩增PCR扩增引物,上游引物:ATGCCATGGAATCCCTGACGTTACAA,下游引物:GCGGATCCTTAGCAGGCTACTCATTC,扩增产物片段大小为1 000 bp。引物由上海生工生物工程股份有限公司合成。扩增体系20 μL,扩增反应:95℃预变性5 min;95℃变性45 s,55℃退火90 s,72℃延伸45 s,35个循环;72℃延伸10 min。扩增产物电泳分离并照相。
1.2.2.3 Southern杂交分析Southern blot杂交基本参照文献[24]的方法,每个样品25 μg 总DNA 分别用EcoRⅠ单酶切或Hind Ⅲ和SalⅠ双酶切,完全酶切后,酶切产物分别在0.8%琼脂糖凝胶上电泳过夜,然后毛细管法转移到尼龙膜上。杂交探针用Roch公司生产的地高辛标记,按PCR扩增方法制备,杂交产物用CSPD显影照相。
1.2.2.4 ELISA检测试验用试剂盒为Quantiplate ELISA kit for CP4 EPSPS。样品按试剂盒使用说明进行逐步操作,并在酶标仪上读取各反应液的吸光值,最后计算出每克样品鲜重中目的基因的表达量。试验设两次重复。
1.2.3 田间生物学鉴定T3代植株5叶期,用0.25%的除草剂Roundup 喷洒转基因植株和对照植株,7 d 后同浓度重复喷雾一次。再过7 d进行田间调查。调查指标包括:受害植株数、受害程度,调查对象:T3代材料T3-1-1、T3-2-1、T3-3-1、T3-4-1、T3-5-1、T3-6-1、T3-7-1、T3-8-1、T3-9-1、T3-10-1共10个株系以及1个对照株系(除草剂伤害严重但尚未死亡株),同时对这些材料做ELISA杂交分析并测定各植株中目的基因表达量。
植株受害程度的指标,1级:无伤害或个别叶片有轻度伤害(伤害面积占该叶片的30%以下);2级:下部叶片有中度伤害(伤害面积占这些叶片面积的50%-80%),且在2周后伤害程度有所减缓;3级:下部叶片有中度伤害(伤害面积占这些叶片面积的50%-80%)或整株受伤害,随后死亡。
株系耐除草剂等级标准为:高耐:除草剂耐性0-5%;耐:5.1%-40%;低耐:40.1%-70%;敏感:>70.1%。
根据各个株系植株除草剂耐性标准分为敏感、低耐、耐性、高耐4个区间,计算各个区间所有植株的除草剂耐性平均值,由于植株除草剂耐性越高,其受害程度越低,其除草剂耐性值也越低,为了使除草剂抗性性状与蛋白表达量呈正相关,可用100%-该区间除草剂耐性值,所得数值用作该区间数据进行相关分析,计算公式如下:
株系除草剂耐性(%)=该株系所有受害植株的受害等级之和÷受害植株数÷该株系植株总数×100%;
区间所有植株除草剂耐性平均值(%)(y)=100%-∑区间内植株除草剂耐性(%)/区间内植株总数;
区间内所有植株蛋白质标量平均值(ng·g-1 叶片鲜重)(x)=∑区间内植株蛋白质表达量(ng·g-1 叶片鲜重)/区间内植株总数。
利用2007版Excel统计分析工具进行数据分析。
1.2.4 目的基因遗传规律分析(1)目的基因遗传分离分析:在T2代试验田,如1.2.1.3取10个株系的全部样品,进行PCR检测;每个株系随机取样6份,进行ELISA杂交分析,根据检测结果做目的基因分离分析。(2)目的基因世代遗传和表达分析:根据PCR检测、Southern杂交分析、ELISA杂交分析结果以及田间生物学鉴定结果,分析和评估目的基因在转化植株后代中的世代遗传现象和表达规律。
2 结果 2.1 转化植株的获得及各代分子检测结果共转化雌穗349个,收获T0种子263粒(转化雌穗空穗率较多,结实雌穗的结实率也仅为1-3粒/穗)。来年播种,出苗239株(T1),PCR检测得到阳性植株97株,进一步Southern杂交分析,得到转化植株54株,转化率为22.6%。T2代54个株系的PCR检测的阳性结果率为72.4%,T3代10个株系中PCR阳性结果植株数达到98.5%,T2代270份材料和T3代250份材料的Sothern杂交结果均为阳性,F1代植株的PCR扩增和Southern杂交结果均为阳性。结果显示目的基因已导入‘昌7-2’植株并整合到受体基因组中,而且目的基因可以随材料稳定遗传且转基因材料的稳定性也在逐代提高。
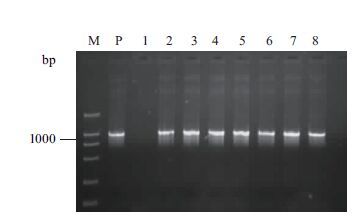
图 2是部分T3转基因植株的PCR扩增检测结果,阴性对照未出现特异条带,转基因植株均扩增出与阳性对照预期大小一致的特异条带。图 3是部分T1和T3代植株的Southern杂交分析结果。图 3-A中2、4、5、6泳道(对应T1代材料T5、T6、T8、T9)显示一条杂交带,1、3泳道出现2条或以上个杂交条带(被淘汰),7泳道未发现杂交条带(淘汰);图 3-B中除阳性对照和阴性对照外,其余材料均来自T9转化事件,且其DNA均经受双酶酶切,所以杂交条带的大小均与阳性对照(质粒DNA)一致,其中阳性对照上样量为2 μL,根据杂交条带的大小和丰度分析,证明目的基因绝大部分是以单拷贝数、单位点整合进转化植株的染色体基因组中的。
|
| 图 2 T3代部分转基因植株的PCR检测结果 M:DL2000 Marker;P:质粒(阳性对照);1:阴性对照;2-8:转基因植株,分别依次来自转化事件T1-2、T1-8、T1-9、T1-21、T1-37、T1-43、T1-49 |

|
| 图 3 转基因植株的Southern杂交结果 A: EcoRⅠ;酶切 P:质粒DNA;-:阴性对照;1-7:T1代转基因植株T4-T10;B: Hind Ⅲ和Sal I双酶切; P:质粒DNA;-:阴性对照;1-9:T3代来自T9的转基因植株 |
60份T3代植株材料的ELISA检测结果均为阳性,证明目的基因能够稳定表达。同时其蛋白质浓度测定结果也表明,所有被测定的转基因植株中,aroA-M12基因都得到表达。部分材料的蛋白质测定结果见表 1,表中蛋白含量数据均为2次重复的平均值。从表 1中可以看出,不同植株间目的基因表达量存在差异,变化幅度介于40.5-112.6 ng/g叶片鲜重之间;不同转化事件间目的基因表达量也有较大变化,T1-37转化事件的目的蛋白浓度的平均值最高,达到87 ng/g 叶片鲜重以上。
转化材料中目的基因在T2代发生了遗传分离,在对如表 2所示的10个株系进行的遗传分离研究中,PCR检测阳性结果率为72.4%,分离比为2.63∶1(χ2=2.000);ELISA检测结果阳性率为71.7%(43/60),分离比2.53∶1(χ2=0.356),与PCR检测结果一致。χ2 测验结果证明目的基因的遗传分离符合3∶1 的孟德尔单因子遗传规律,达到显著水平,即在玉米遗传背景下目的基因表现为单因子显性遗传方式。同一转化事件或不同转化事件间的后代植株,其遗传分离现象基本一致。
转化材料的多代连续分子检测结果证明目的基因能够随转化材料的世代遗传而稳定遗传给下一代植株并在转化植株中得到表达。此外,各代材料的PCR检测、Southern杂交分析以及ELISA分析结果均显示随着世代交替,检测结果的阳性率逐代提高,如PCR检测T2代阳性结果率为72.4%,T3代达到98.5%(表 2);ELISA分析T2代阳性结果率为71.7%(表 3),T3代ELISA检测结果均为阳性;Southern杂交分析T2、T3代的样品结果均为阳性。检测结果阳性率的提高有利于转基因纯合株系的筛选,本研究在T3代获得转基因纯合株系。T3代10个转基因株系中,来自T2-9的株系的aroA-M12基因表达量最低,平均值仅为61 ng/g,来自T2-49的株系的aroA-M12基因表达量最高,平均值为88 ng/g,而来自T2-8、T2-23和T2-37的3个株系的蛋白表达量平均值分别82.6、80.4和85.2 ng/g,单株转化材料中目的基因表达量介于40.5-112.6 ng/g 叶片鲜重之间,存在显著差异,这可能与植株个体差异有关。
结合田间除草剂耐性调查结果,各个转化株系的除草剂耐性与该株系中目的基因表达水平有关,如T2-8、T2-23、T2-37和T2-49四个株系的除草剂耐性值均为高耐水平,其目的基因表达水平也最高,而除草剂耐性较低的T2-9株系,其蛋白表达水平也最低。田间喷雾除草剂(连续两次)试验结果(图 4)显示,转化株系的除草剂耐受性可达0.25%-0.5%左右。此外,根据aroA-M12基因的分子检测及其田间除草剂耐性鉴定结果,证实已检测转化植株及其后代株系中不存在基因沉默现象,但存在为数较少的基因丢失现象,如在对T3代株系的检测中,偶尔会发现某个株系的一些植株丢失了目的基因,在后续的研究中将对基因丢失现象和原因作进一步探讨。

|
| 图 4 喷雾除草剂后田间转基因植株的部分照片 A:第2次喷雾除草剂7 d后对照(左侧)和转基因材料(右侧)对比图,对照植株叶片趋于干枯,转基因材料叶片也微现黄色;B:第2次喷雾除草剂20 d,图中左侧对照植株全部死亡,右侧转基因植株叶片已恢复绿色;C:两次喷雾7 d后转基因植株仅下部两片叶片略受损伤,视为1级抗性苗;D:两次喷雾7 d后转基因植株受伤害严重植株,视为3级抗性苗 |
F1代植株取样进行PCR扩增、Southern杂交和ELISA分析,所有检测结果均为阳性,证明F1代植株含有aroA-M12基因,进而证明目的基因可以通过杂交形式(本研究中转基因植株作为父本)传递给下一代植株。
2.4 转化植株的草甘膦耐性T3代转基因植株和对照植株喷雾除草剂的调查显示,10个转基因株系中,高耐株系4个,耐性株系5个,低耐株系1个,不耐株系0个(表 4)。所有对照植株在喷雾20 d后全部死亡。证明aroA-M12基因的导入和表达提高了转基因植株的除草剂耐性。
通过对来自同一转化事件后代不同植株对草甘膦的耐性及其该植株中目的基因表达量的相关分析,结果显示除草剂耐性性状与目的基因表达量间的相关性达极显著水平,相关系数为r = 0.942 3(P< 0.01),即aroA-M12基因表达量与转基因植株的除草剂耐性呈极显著相关。此外对于来自不同转化事件的转基因材料做相同的分析,结果显示各事件后代植株的草甘膦耐性平均值与其株系中目的基因表达量的平均值间的相关系数r 介于0.841 6-0.961 4(P<0.05),也呈显著相关。
通过分析检测和田间调查筛选,最终得到4个转基因纯合株系,T2-8、T2-23、T2-37和T2-49,其除草剂耐性平均值高于80 ng/g叶片鲜重,但得到的这4个T3代转基因纯合株系中,我们发现仍有一些植株中目的基因的表达量在50 ng/g叶片鲜重或以下,这些植株对草甘膦除草剂的耐受性也偏低,植株有不同程度的除草剂损伤,全面接受这些材料会在今后的生产中引发因除草剂的伤害而影响作物产量,因此在转基因纯合株系中筛选目的基因表达量较高的植株并进一步研究其后代中目的基因表达水平至关重要,以期得到目的基因表达量较高的转基因纯合株系。本研究证明,当目的基因表达量高于70 ng/g鲜重时,喷洒0.25%的除草剂Roundup(喷洒两次)对植株不造成伤害。
3 讨论本实验利用耐草甘膦基因转化玉米自交系获得转基因植株,对转基因植株进行PCR 扩增、Southern blot杂交分析的结果证明,目的基因确已导入到玉米自交系昌7-2中。对转基因植株进行ELISA分析的结果表明,目的基因在转基因植株中得到了表达。田间喷雾草甘膦鉴定结果表明,转基因植株对草甘膦具有明显的耐性;不同转化单株之间耐性的强弱有所不同。转基因植株生物耐性鉴定结果说明,由aroA-M12基因编码的EPSPS蛋白在植物中的表达,确实能使转基因植物具有耐草甘膦功能。最终获得了4个高耐草甘膦的转基因株系。为进一步选育具有耐除草剂功能的玉米新品种奠定了良好的基础。
有关目的基因在转化植物中的遗传规律,Peng等[26]将gusA和neo基因导入水稻,其R1代中这两个基因的表型分离系数为3∶1,同孟德尔的单个显性基因的分离规律一致;Cheng等[27]研究认为外源基因在转基因小麦中呈现3:1分离;本研究结果也证明,外源基因在F2代转基因玉米中表现出3∶1的遗传分离规律。不过也有研究认为,外源基因在转化植物中表现出背离3∶1的分离现象[28],证明外源基因在转化体中的整合方式和整合位点是很复杂的,多拷贝、多位点整合的转化体是很难存在和应用的,因此植物转基因研究除了研究转化技术和基因外,提高目的基因以单拷贝、单位点整合到植物染色体组的转化方法的研究也是十分必要的。幸运的是,目前转基因研究证明大部分转化植物的遗传分离是符合孟德尔的遗传分离规律的。关于外源基因的世代遗传,本研究和其它研究[29-31]已证明目的基因是可以稳定遗传给下一代的,目的基因多以单拷贝、单位点形式插入受体基因组中;本研究与其它研究[32]还证明转化体中的外源基因可以通过杂交传递给下一代。
不过,在随后的分析中发现,同一转化事件内不同株系间目的基因表达量以及对除草剂耐性的差异主要起因于植株个体的差异;不同转化事件间相关系数值、目的基因表达量以及其植株的除草剂耐性值的差异,除不同转化事件的差异外,也与植株个体的差异有关,而植株个体的差异又多表现在转化过程中,目的基因插入的拷贝数和位点的差异,显然目的基因拷贝数的多少、插入位点的效应,都影响着目的基因在转化体中的表达水平,特别是目的基因插入的拷贝数影响较大。本研究虽然通过Southern分析淘汰了部分多拷贝、多位点插入的转化事件,但仍无法精准地了解目的基因的插入拷贝数,其结果是对这些转化事件的分析的准确性以及转化材料的遗传稳定性均会产生影响,所以需进一步对目的基因插入的拷贝数作较精准的分析。对目的基因表达量与目标性状间的相关性分析方法,尤其是有关转基因植株中耐草甘膦基因的表达量与植株的草甘膦耐性性状间的相关分析报道的还很少,如何将基因表达量与目标性转相互对应作更科学合理的分析还值得深思。此处需要注意的是,虽然对照植株最后全部死亡,但在调查期间仍有受除草剂伤害的存活植株,表中所列数据为尚存活植株的数据。总之,对不同转化事件材料应分别对待,并非转化成功的事件就一定是实用的转化事件;虽然T2代后,各转化事件的后代株系的阳性结果率、除草剂耐性、目的基因表达量等虽存在一定差异,但总趋势是一致的,不影响对结果的分析。
花粉介导法[23]、农杆菌介导法与基因枪轰击法结合[33]等在植物遗传转化中的作用,在我国已有一定的研究基础,前者操作简单、转化率高,具有我国自主知识产权,缺点重复性差,后者是以农杆菌介导的遗传转化为基础,外源基因在植物细胞中的拷贝数较低,遗传稳定性好,同时该方法吸收了基因枪轰击法受体类型广泛、可控性好等优点。在具有广阔领域和美好前景的植物基因工程研究中,探讨简洁、快速、高效的转化方法仍是决定植物基因工程研究进展快慢的关键所在。
本研究中所调查的转基因株系(植株)草甘膦耐性是在喷雾除草剂条件下进行的,今后的研究中应将除草剂浓度设计成一个梯度,对同一株系材料分别喷雾不同浓度的除草剂,得出转基因玉米对草甘膦除草剂的最高耐受值或各株系转基因材料的除草剂耐受范围;同时对研究过程中的基因丢失现象、目的基因表达量的高低都应做进一步分析,以确保目的基因在转化材料中的遗传稳定性并减少因重复筛选而增大的工作量;另外对于转基因作物中目的基因的安全性评价试验、转基因对转化个体或群体农艺性状的影响等需做更深入的探讨,为转基因玉米产业化提供安全、可靠的育种资源。
4 结论利用花粉介导法将耐草甘膦基因aroA-M12导入玉米,可以获得转基因植株,并且提高了转化植株的除草剂耐性;转化植株后代可以耐受0.25%-0.5%浓度的草甘膦除草剂,目的基因表达量达到70 ng/g叶片鲜重时,喷施除草剂的植株不受损伤,除草剂耐性性状与目的基因表达量间的相关性达极显著水平,相关系数为r=0.942 3(P<0.01)。通过筛选最终获得T2-8、T2-23、T2-37和T2-49四个转基因纯合株系。
| [1] | 张林生, 俞嘉宁, 曹让, 等. 转基因植物在农业上的应用. 西北植物学报 , 2002, 22 (4) : 1011–1017. |
| [2] | Gianessi LP. Economic and herbicide use impacts of glyphosate-resistant crops. Pest Manag Sci , 2005, 61 (3) : 241–245. DOI:10.1002/(ISSN)1526-4998 |
| [3] | Comai L, Sen LC, Stalker DM. An alter aroA gene product confer resistance to the herbicide glyphosate. Science , 1983, 221 (4608) : 370–371. DOI:10.1126/science.221.4608.370 |
| [4] | Comai L, Facciotti D, Hiatt WR, et al. Expression in plant of a mutant aroA gene from Salmonella typhimurium confer tolerance to glyphosate. Nature , 1985, 317 (6039) : 741–744. DOI:10.1038/317741a0 |
| [5] | Duncan K, Lewendon A, Coggins JR. Mutant EPSP synthase genes from tomato, Arabidopsis thaliana, Brassica napus, Glycine max, E. coli K-12 confer tolerance to glyphosate. FEBS Lett , 1984, 170 : 59–63. DOI:10.1016/0014-5793(84)81368-X |
| [6] | Padgette SR, Kolacz KH, Dekanny X, et al. Development, identification, and characterization of a glyphosate-tolerant soybean line. Crop Sci , 1995, 35 (5) : 1451–1461. DOI:10.2135/cropsci1995.0011183X003500050032x |
| [7] | Nida DL, Kolacz KH, Buehler RE, et al. Glyphosate-tolerant cotton:Gentic characterization and protein expression. J Agr Food Chem , 1996, 44 (7) : 1960–1966. DOI:10.1021/jf9505640 |
| [8] | 敬凌霞. 抗CP4EPSPS单克隆抗体的制备和生物学特性的研究[D]. 重庆:重庆医科大学, 2007. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=30&CurRec=1&recid=&FileName=2007218525.nh&DbName=CMFD2008&DbCode=CMFD&pr= |
| [9] | 陈海伟, 张鲁华, 陈德富, 等. 除草剂及抗除草剂作物的应用现状与展望. 生物技术通报 , 2012 (10) : 35–40. |
| [10] | Sidhu RS, Hammond BG, Fuchs RL, et al. Glyphosate tolerant corn:the composition and feeding value of grain from glyphosate-tolerant corn is equivalent to that of conventional corn(Zea mays). J Agric Food Chem , 2000, 48 (6) : 2305–2312. DOI:10.1021/jf000172f |
| [11] | Howe AR, Gasser CS, Brown SM, et al. Glyphosate as a selective agent for the production of fertile transgenic maize(Zea mays L. )plant. Mol Breeding , 2002, 10 (3) : 153–164. DOI:10.1023/A:1020396708088 |
| [12] | Bonny S. Genetically modified glyphosate-tolerant soybean in the USA:adoption factors, impacts and prospects. A review. Agronomy for Sustainable Development , 2008, 28 (1) : 21–32. DOI:10.1051/agro:2007044 |
| [13] | Joseph TD, Edward CL, David AM. Effects of landscape composition on spread of an herbicide-resistant weed. Landscape Ecology , 2009, 24 (6) : 735–747. DOI:10.1007/s10980-009-9345-9 |
| [14] | Nicola S, Luigi D. Surveying the occurrence of subspontaneous glyphosate-tolerant genetically engineered Brassica napus L. (Brassicaceae)along Swiss railways. Environmental Sciences Europe , 2012 : 24–23. |
| [15] | Nehl SR, Kraus J, Matzk A, et al. Transgenic varieties:sugarbeet. Sugar Tech , 2010, 12 (3-4) : 194–200. DOI:10.1007/s12355-010-0052-2 |
| [16] | Jones JD, Golds Brough PB, Weller SC. Stability and expression of amplified EPSPS genes in glyphosate resistant tobacco cells and plantlets. Plant Cell Reports , 1996, 15 (6) : 431–436. DOI:10.1007/BF00232070 |
| [17] | Zhou H, Arroe Smith JW, Fromm ME, et al. Glyphosate -tolerant CP4 and GOX genes as a selectable marker in wheat transformation. Plant Cell Rep , 1995, 15 (3-4) : 159–163. |
| [18] | Bair DR, Batson W, Watson C, et al. Evaluation of transgenic cotton varieties and a glyphosate application on seedling disease incidence. Mycopathologia , 2004, 158 (3) : 363–368. DOI:10.1007/s11046-004-2303-9 |
| [19] | 谢龙旭, 徐培林, 聂燕芳, 等. 抗草甘膦抗虫植物表达载体的构建及其转基因烟草的分析. 生物工程学报 , 2003, 19 (5) : 545–550. |
| [20] | Tong XH, Daud MK, Sun YQ, et al. Physiological and molecular mechanisms of glyphosate tolerance in vitro selected cotton mutant. Pesticide Biochemistry and Physiology , 2009, 94 (2 /3) : 100–106. |
| [21] | 余桂荣, 杜文平, 宋军, 等. 玉米胚性愈伤组织的遗传转化及耐草甘膦植株再生. 中国农业科技导报 , 2010, 12 (4) : 108–113. |
| [22] | 赫福霞, 郎志宏, 陆伟, 等. 以耐草甘膦2mG2-epsps基因为选择标记的玉米转化体系的建立. 生物技术通报 , 2008 (5) : 93–97. |
| [23] | 孙毅, 崔贵梅, 郝曜山, 等. 超声波辅助花粉介导植物转基因方法:中国ZL 201110041484. 0[P]. 2011-2-18. |
| [24] | Sambroo KJ, Fritsch EF, Maniatis T. Molecular Cloning:A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [25] | 王关林, 方宏筠. 植物基因工程[M]. 北京: 科学出版社, 2005. |
| [26] | Peng JY, Lister RL, Hodges TK, et al. Inheritance of gusA and neo genes in transgenic rice. Plant Mol Biol , 1995, 27 (1) : 91–104. DOI:10.1007/BF00019181 |
| [27] | Cheng M, Joyce EF, Pang SZ, et al. Genetic transformation of wheat mediated by Agrobacterium tumefaciens. Plant Physiol , 1997, 115 (3) : 971–980. DOI:10.1104/pp.115.3.971 |
| [28] | Gao SQ, Xu HJ, Cheng XG, et al. Improvement of wheat drought and salt tolerance by expression of a stress-inducible transcription factor GmDREB of soybean(Glycine max). Chin Sci Bull , 2005, 50 (23) : 2714–2723. |
| [29] | Sangtong V, Moran DL, Chik Wamba R, et al. Expression and inheritance of the wheat Glu-1DX5 gene in transgenic maize. Theor Appl Genet , 2002, 105 (6/7) : 937–945. |
| [30] | Eva S, Sarah W, Duncan K, et al. Molecular characteristics of transgenic wheat and the effect on transgene expression. Transgenic Research , 1998, 7 (6) : 463–471. DOI:10.1023/A:1008833324193 |
| [31] | Barro F, Martin A, CabrerAA. Transgene integration and chromosome alterations in two transgenic lines of tritordeum. Chromosome Research , 2003, 11 (6) : 565–572. DOI:10.1023/A:1024948700938 |
| [32] | 施利利, 王松文, 张欣, 等. 抗除草剂基因atzA在转基因水稻中的遗传. 南开大学学报:自然科学版 , 2008, 41 (6) : 99–102. |
| [33] | 耿立召, 刘传亮, 李付广. 农杆菌介导法与基因枪轰击法结合在植物遗传转化上的应用. 西北植物学报 , 2005, 25 (1) : 205–210. |