2. 中南大学教育部生物冶金重点实验室, 长沙 410083
2. Key Laboratory of Biometallurgy of Ministry of Education, Central South University, Changsha 410083
在我国,铜矿资源多数是以低品位硫化矿的形式存在,这些矿物用传统冶炼工艺提取率低,对环境损害大,而且耗能严重。由于生物冶金技术特别适于贫矿、废矿、外表矿及难采、难选、难冶矿的堆浸和就地浸出,并具有过程简单、成本低、能耗低、对环境污染小等突出优点,已在工业生产中得到广泛应用[1]。常见的冶金微生物可根据其最适生长温度划分为常温微生物(30-40℃)、中度嗜热微生物(40-60℃)和极端嗜热微生物(80℃以上)[2]。目前常温菌和中度嗜热菌在工业上也有一定应用,而极端嗜热微生物应用还较少[3, 4],由于嗜热菌与嗜中温菌相比具有耐高温、提取速率快和浸出率高等特点,在工业应用上有着较大的潜力[5, 6],因此对于嗜热浸矿微生物的相关研究成为目前的热点。
铁和硫氧化活性对微生物的浸矿行为起着决定作用[7],而膜蛋白也与微生物应对环境、适应环境、传递信息等方面密切相关[8]。已有研究表明,胞外亲水蛋白以及膜疏水蛋白分别在微生物对硫的活化以及转运和氧化过程中起到重要作用[9, 10]。胞外硫活化相关蛋白质因易分离,研究相对较多。我们之前基于比较蛋白质组学和基于同步辐射的原位巯基表征,验证巯基(-SH)在硫活化中的重要作用[11]。但是膜蛋白相关的研究有限,而且这些研究主要集中在嗜中温菌,对于嗜热菌尤其是极端嗜热菌的研究相对较少[12]。为了进一步开展极端嗜热菌硫的转运和氧化相关机理的研究,有必要对极端嗜酸热古菌膜蛋白提取条件进行探索和优化。
本文选择研究较多的典型极端嗜酸热古菌Acidianus manzaensis开展实验探索并建立其膜蛋白提取方法。首先比较不同提取剂对膜蛋白的提取效果,接着比较常用沉淀剂对膜蛋白质沉淀的效果,根据提取蛋白的SDS-PAGE结果选择合适的提取剂和沉淀剂;并利用优化的提取方法进一步开展S0,Fe2+ 能源底物培养下膜蛋白质表达差异的研究,旨在为后续对膜蛋白的双向电泳及膜蛋白相关研究奠定基础。
1 材料与方法 1.1 材料主要试剂有苯甲基磺酰氟(PMSF),十二烷基肌氨酸钠,Triton X-110,十二烷基硫酸钠,SDS和Triton X-114,均购自于北京鼎国昌盛生物技术有限责任公司。主要仪器,Mini-PROTEAN® Tetra Cell 系统(Bio-Rad Laboratories)。
1.2 方法 1.2.1 菌株及培养基实验所用菌株A. manzaensis YN-25 由中南大学教育部生物冶金重点实验室提供[13],A. manzaensis YN-25的培养使用9K基础培养基[14][0.5 g/L,MgSO4·7H2O;0.5 g/L,K2HPO4;3.0 g/L,(NH4)2SO4;0.1 g/L,KCl;0.01 g/L,Ca(NO3)2],添加0.02%(W/V)酵母浸出液作为碳源,分别加入10 g/L的S0、22 g/L的FeSO4·7H2O作为能源底物。菌在S0或Fe2+培养时,培养基的初始pH分别调至2.0或1.6。在500 mL三角瓶中添加上述已接种培养基200 mL,置于空气浴摇床中在65℃和170 r/min下培养,待菌生长至对数后期时,8 000×g离心15 min收集细胞,稀硫酸(pH2)洗涤除去杂质,并悬浮菌体,制成在600 nm波长下的吸光值为1的悬液(1 cm比色皿),每份20 mL 分装,8 000×g下离心10 min收集菌体备用。
1.2.2 胞外黏附蛋白粗略去除A. manzaensis与S0和Fe2+的作用过程中胞外会黏附分泌蛋白,形成富含蛋白的荚膜层,对其进行粗略的去除有助于减少膜蛋白分离时的干扰,提高分离的效率。去除胞外黏附蛋白采取80℃水浴加热,弃上清,8 000×g下离心10 min收集细胞,记录处理时间和上清液中蛋白质含量的对应关系,根据上清液中蛋白质的含量确定胞外黏附蛋白的最佳水浴时间。
1.2.3 蛋白质浓度测定使用碧云天生物技术研究所(http://www.beyotime.com)生产的BCA蛋白质浓度测定试剂盒对蛋白质浓度进行检测。
1.2.4 SDS-PAGE上样浓度的确定为得到清晰可分辨的蛋白质条带,对以单质硫为能源培养的A. manzaensis菌膜蛋白质提取液梯度稀释,稀释后蛋白质浓度分别为0.23、1.09、2.19、3.29和4.38 mg/mL,进行SDS-PAGE,根据蛋白质条带的清晰度确定最佳蛋白质上样浓度。
1.2.5 膜蛋白的不同提取方法考虑到实验设备的要求和操作可行性,参考Andreas Veith等[15]和夏金兰等[16]膜蛋白的提取方法进行设计实验。
1.2.5.1 Triton X-110和SDS提取法(1)收集A. manzaensis 细胞,稀硫酸(pH2)洗涤,去除培养基成分。(2)加入1 mL缓冲液A(1 mmol/L PMSF,20 mmol/L PBS(pH7.4),0.5%(W/V)十二烷基肌氨酸钠)悬浮细胞,使细胞裂解。(3)加入1 μL的 DNase I 溶液至步骤 2)中所得悬浮液中。在 45℃下恒温水浴 20 min后,13 000×g下离心10 min。倒掉上清后重复离心一次。(4)把下层沉淀重新悬浮于缓冲液 B[1 mmol/L PMSF,20 mmol/L PBS(pH7.4),0.5%(W/V)SDS]中。并于 45℃下恒温水浴 20 min。离心去掉上层清液。(5)重复步骤(4),直至离心后的上层清液变得澄清。(6)弃上清,在沉淀中加入100 μL去离子水悬浮。
缓冲液B中的SDS更换为Triton X-100,即为SDS提取法。
1.2.5.2 Triton X-114膜蛋白提取法(1)收集A. manzaensis 细胞,稀硫酸(pH2)洗涤,去除培养基成分。(2)将收集并洗涤过的菌体悬浮于 1 mL 提取剂[1 mmol/L PMSF,20 mmol/L PBS(pH7.4),1% Triton X-114。]。(3)4℃恒温2 h并摇动。4℃下8 000×g 离心5 min 去除不溶性的菌体,重复数次直至离心后无沉淀产生。(4)上清在37℃水浴恒温30 min,3 000 r/min低速离心10 min 诱导有机相和水相分层。(5)下层有机相添加PBS缓冲液重复步骤(4)分离操作3次。最后收集分离到的有机相,加入9倍体积的丙酮,-20℃过夜沉淀蛋白质。(6)将(5)中的液体在 13 000×g下离心10 min,弃上清,将沉淀溶于100 μL 去离子水中。
1.2.6 膜蛋白的SDS-PAGE[17]提取的蛋白质样品,透析24 h,真空冷冻干燥,-20℃保存。上样前,用蒸馏水溶解适当蛋白样品并测定浓度,蛋白质样品与上样缓冲液混合后煮沸 10 min 点样。电泳采用12% 的分离胶(1.0 mL 去离子水,2.0 mL 30% Acr-Bis(29∶1),1.9 mL 1 mol/L Tris(pH8.8),0.05 mL 10% SDS,0.05 mL 10% 过硫酸铵,0.002 mL TEMED),5%的浓缩胶(1.2 mL 去离子水,0.33 mL 30% Acr-Bis(29∶1),0.25 mL 1 mol/L Tris(pH 6.8),0.02 mL 10% SDS,0.02 mL 10% 过硫酸铵,0.002 mL TEMED)。浓缩胶15 mA,分离胶25 mA至电泳结束,用加热后的考马斯亮蓝(约60℃)染色1 h,脱色至蛋白质条带清晰。
1.2.7 Triton X-114 最佳浓度的确定配制含1%、5%、10% 及15% Triton X-114的提取剂,对单质硫培养的A. manzaensis进行膜蛋白提取,探究不同浓度Triton X-114 对膜蛋白提取效果的影响,并对其蛋白提取物进行SDS-PAGE比较。
1.2.8 蛋白质沉淀试剂的比较提取的膜蛋白溶于Triton X-114的提取剂中,需要合适的试剂沉淀蛋白质并且除去Triton X-114。实验分别对常用的蛋白质沉淀有机试剂做了比较,即三氯乙酸(TCA)、三氯乙酸丙酮、丙酮、甲醇、乙醇。
1.2.9 S0/Fe2+培养下A.manzaensis 膜蛋白表达差异研究根据探索的提取条件分别对S0和Fe2+培养的A. manzaensis 细胞进行膜蛋白提取。比较两种能源培养下A. manzaensis膜蛋白的表达差异。
2 结果 2.1 粗略除去干扰蛋白时间的确定采用水浴加热对A. manzaensis分泌蛋白进行粗略的去除以减少干扰,对处理时间和去除的上清液中蛋白质含量作图,寻找最佳时间。图 1显示,在一定量细胞条件下,上清液中蛋白质含量随着水浴时间的增加而增加,水浴时间60 min后上清液中蛋白质含量增幅明显下降。为保证膜蛋白不被破坏同时又能对胞外蛋白初步去除,80℃水浴时间应控制在60-70 min。
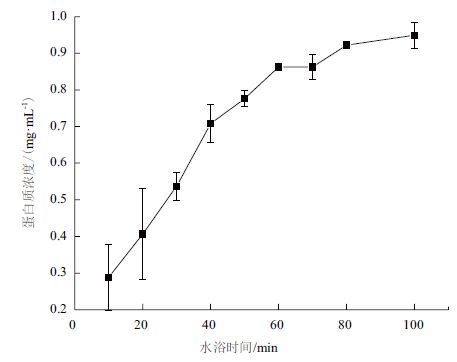
|
| 图 1 80℃水浴时间和上清液蛋白质含量图 |
为得到清晰可分辨的蛋白质条带,对SDS-PAGE上样浓度进行了探索,结果(图 2)表明随着样品浓度的增加,各泳道的蛋白质条带在染色后颜色依次增加。当蛋白质浓度较低时(0.23 mg/mL),蛋白质条带颜色较浅,有的条带不能显现出来;当蛋白质浓度较高时(3.29和4.38 mg/mL),蛋白质条带出现拖尾现象,分子量相近的蛋白质条带出现重叠,难以区分。当蛋白质浓度在1.09和2.19 mg/mL时电泳结果相对较好。
综上所述,在进行SDS-PAGE时,上样蛋白质浓度应该控制在1-2 mg/mL,即每个上样孔10-20 μg 蛋白质以保证电泳结果的清晰程度和分辨能力。
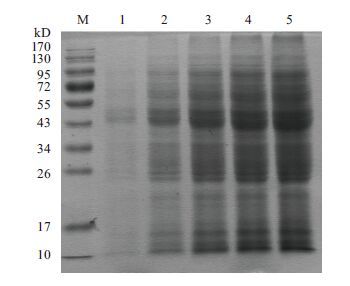
|
| 图 2 不同蛋白质浓度SDS-PAGE结果 M:蛋白Marker;1-5:蛋白质浓度为0.23、1.09、2.19、3.29和4.38 mg/mL 的A. manzaensis 去除胞外黏附蛋白后细胞总蛋白 |
根据3种提取剂(表 1),两种操作方法提取的蛋白质的SDS-PAGE结果如图 3所示。SDS和Triton X-100 提取的膜蛋白含量极低,电泳后没有任何的蛋白质条带出现,Triton X-114 提取的膜蛋白在SDS-PAGE上有很好的反应,不仅蛋白含量高,蛋白质条带也相对清晰。所以,选定方法Triton X-114为本研究的膜蛋白提取方法。
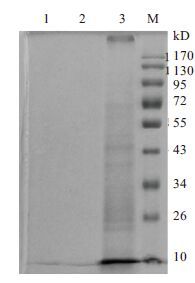
|
| 图 3 不同方法提取膜蛋白的SDS-PAGE结果 M:蛋白Marker;1:SDS 和Triton X-100 提取的膜蛋白样品;2:Triton X-100 提取的膜蛋白样品;3:Triton X-114提取的膜蛋白样品 |
分别配制含1%、5%、10%和15% Triton X-114的提取剂,并对S0培养的A. manzaensis进行膜蛋白提取。在4个浓度下,随着Triton X-114的浓度增加,提取到的膜蛋白含量也随之增加,从图 4-A可以看出,实验所用的细胞量是过量的。由SDS-PAGE结果(图 4-B)可以看出,随着缓冲液中Triton X-114浓度的不同,其提取的膜蛋白种类也有所不同。当Triton X-114浓度较低(1% 和 5%)时,提取的膜蛋白电泳条带较少,应为只提取了膜蛋白中丰度较高的蛋白;当Triton X-114浓度为10%和15%时,两者提取的膜蛋白种类相同。综上所述,含 Triton X-114浓度为10%和15%的缓冲液能提取到较多的膜蛋白,且提取的膜蛋白种类相同。但是在实验时,含15% Triton X-114的提取剂十分黏稠,在悬浮细胞和分离不溶性菌体步骤中不易操作,所以最终选择合适的Triton X-114浓度为10%。
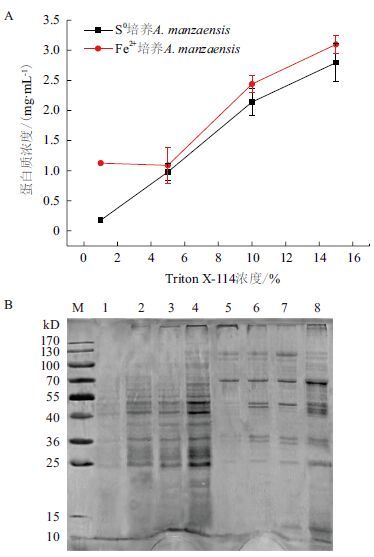
|
| 图 4 不同浓度Triton X-114对膜蛋白质的提取效率的影响(A)及SDS-PAGE结果(B) M:蛋白Marker;1-4:S0培养A. manzaensis 膜蛋白,Triton X-114使用浓度1%、5%、10%和15%;5-8:Fe2+培养A. manzaensis 膜蛋白,Triton X-114使用浓度1%、5%、10%和15% |
不同蛋白沉淀剂[三氯乙酸(TCA)、丙酮、三氯乙酸/丙酮、甲醇和乙醇]对膜蛋白质沉淀的效果如图 5所示。这5种沉淀剂都能有效沉淀蛋白质并除去Triton X-114,对双向电泳有较好应用的三氯乙酸和三氯乙酸丙酮沉淀的蛋白质在25 kD以下发生缺失,而丙酮、甲醇和乙醇差别不明显,实验选择了丙酮作为蛋白质沉淀剂。
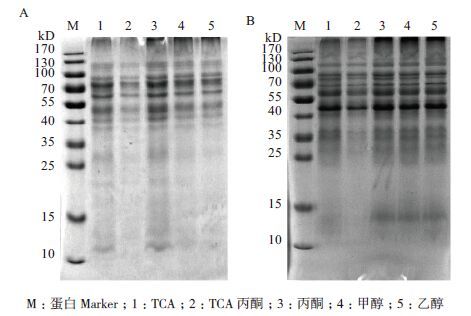
|
| 图 5 单质硫(A)和硫酸亚铁(B)培养的A. manzaensis膜蛋白在不同沉淀试剂处理下的SDS-PAGE结果 M:蛋白Marker;1:TCA;2:TCA丙酮;3:丙酮;4:甲醇;5:乙醇 |
使用优化后的提取方法对分别在S0和Fe2+培养的A. manzaensis细胞膜蛋白进行提取并进行SDS-PAGE,结果(图 6)显示,不同能源底物下培养的A. manzaensis膜蛋白表达种类不完全相同。S0培养的A. manzaensis膜蛋白明显比Fe2+中培养的A. manzaensis膜蛋白多了分子量约35.6 kD的条带,即该蛋白只在S0培养的A. manzaensis中表达;原本在Fe2+中相对表达较高分子量约为72 kD 和26 kD的蛋白在S0中表达明显下调(条带相对于同泳道其他条带变浅);分子量约为16.85 kD的蛋白条带也只出现在S0培养的细胞中。据此可推测在35.6 kD和16.85 kD出现的蛋白很可能为A. manzaensis硫代谢相关的特异性蛋白;而分子量在72 kD 和26 kD的蛋白质可能为铁代谢相关的蛋白。

|
| 图 6 两种能源培养A. manzaensis膜蛋白SDS-PAGE结果 M:蛋白Marker;1:Fe2+为能源培养的A. manzaensis 膜蛋白样品;2:S0为能源培养的A. manzaensis 膜蛋白样品 |
本实验发现A. manzaensis 硫代谢相关的蛋白分子量分别是35.6 kD和16.85 kD;而与A. manzaensis铁代谢相关蛋白质分子量为26 kD和72 kD。目前针对极端嗜热古菌的膜蛋白分离研究较少,研究大多集中于嗜酸氧化亚铁硫杆菌(A. ferrooxidans),张成桂[18]在研究A. ferrooxidans适应与活化元素硫的分子机制时,分离出与元素硫活化相关的差异蛋白质点均在40 kD以下。Ramirez等[19]在元素硫和Fe2+基质中生长的A. ferrooxidans ATCC 19859时,发现以亚铁为能源生长的细菌转接到单质硫中培养时,细胞外膜有一分子量为44 kD的蛋白质明显表达上调。Buonfiglio等[20]的研究则发现分子量为55 kD和47 kD的两种外膜蛋白可能与A. ferrooxidans和还原型硫底物的氧化相关,他们的另一项研究则通过单向电泳发现A. ferrooxidans MSR外膜蛋白中有一分子量为50 kD的外膜蛋白质在以S0为能源生长的细菌细胞中高度表达,以Fe2+为能源生长的细菌细胞中不表达。本实验结果和普遍的TCA/ 丙酮沉淀效果相反,例如,龙峰[21]在研究TCA/ 丙酮沉淀对脑脊液标本中蛋白质双向电泳的影响时,TCA/ 丙酮沉淀效果比丙酮要好,TCA/ 丙酮沉淀后的脑脊液标本蛋白点数高于单纯丙酮沉淀。原因是一般比较TCA/ 丙酮和丙酮沉淀蛋白质效果,蛋白质都溶解于水相,本实验中的蛋白质溶解于表面活性剂的有机相中,有机相对沉淀试剂有一定干扰,而本实验差异蛋白质在凝胶上灰度较浅,属于丰度比较低的蛋白,有机试剂沉淀蛋白质必然会对造成一定损失,最终导致了TCA/ 丙酮效果不如丙酮。本实验发现的A. manzaensis 硫代谢相关的蛋白分子量都相对较小,与生物冶金模式菌A. ferrooxidans相比较,虽然浸矿行为相似,但在相关蛋白的表达缺存在明显差异,这也表明A. manzaensis的硫活化氧化机理可能和常温冶金微生物不尽相同。
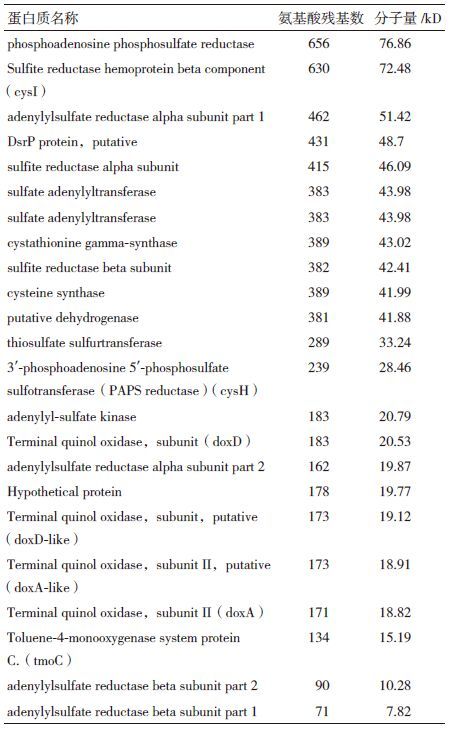
通过检索KEGG数据库中已经公布硫代谢网络途径,查到泉古菌(crenarchaeotes)大类下硫代谢相关蛋白共24个,并计算其分子量,由于嗜酸两面菌属(Acidianus)硫代谢缺乏研究,未找到同属的硫代谢相关蛋白数据(表 2)。考虑到在电泳时蛋白质条带的迁移有一定误差,选取了3个分子量和实验数据相近的蛋白作分析,分别为35.6 kD 附近的cysteine synthase、putative dehydrogenase、thiosulfate sulfurtransferase还有16.85 kD 附近的erminal quinol oxidase,subunit Ⅱ,putative(doxA-like)、Terminal quinol oxidase,subunit Ⅱ(doxA)、Toluene-4-monooxygenase system protein C(tmoC)。有趣的是,分子量在35.6 kD 附近的的3个蛋白在泉古菌大类中较为普遍,而分子量16.85 kD 附近的3个蛋白仅在硫化叶菌属(Sulfolobus)中出现,这表明A. manzaensis与硫化叶菌属在硫代谢上可能存在相似性,但由于分子量的对应关系并未完全符合实验数据,A. manzaensis亦可能存在未知的硫代谢相关蛋白,这方面还有待进一步的实验深入研究。
需要特别指出的是,由于SDS-PAGE分辨率较差,因此很可能同一条带下存在多种蛋白。
4 结论本实验通过比较不同膜蛋白提取剂的提取效果以及不同蛋白沉淀剂的沉淀效果,优化了A. manzaensis 膜蛋白的提取方法。通过优化后的方法,对S0和Fe2+培养的A. manzaensis膜蛋白进行提取和SDS-PAGE比较研究,结果发现不同能源下培养时A. manzaensis膜蛋白的表达种类有明显差异,表明A. manzaensis对不同能源利用的差异性,这些差异表达的蛋白条带很可能与A. manzaensis的硫代谢或者铁代谢相关。
| [1] | 周吉奎, 钮因健. 硫化矿生物冶金研究进展. 金属矿山 , 2015 (4) : 24–30. |
| [2] | 周洪波, 毛峰, 王玉光. 嗜酸微生物与生物冶金技术. 矿物岩石地球化学通报 , 2015 (2) : 269–276. |
| [3] | Rawlings DE. Heavy metal mining using microbes 1. Annual Reviews in Microbiology , 2002, 56 (1) : 65–91. DOI:10.1146/annurev.micro.56.012302.161052 |
| [4] | Yoshida N, Nakasato M, Ohmura N, et al. Acidianus manzaensis sp. nov. a novel thermoacidophilic archaeon growing autotrophically by the oxidation of H2 with the reduction of Fe3+. Current Microbiology , 2006, 53 (5) : 406–411. DOI:10.1007/s00284-006-0151-1 |
| [5] | Gericke M, Pinches A, van Rooyen JV. Bioleaching of a chalcopyrite concentrate using an extremely thermophilic culture. International Journal of Mineral Processing , 2001, 62 : 243–255. DOI:10.1016/S0301-7516(00)00056-9 |
| [6] | Konishi Y, Asai S, Tokushige M, et al. Kinetics of the bioleaching of chalcopyrite concentrate by acidophilic thermophile acidianus brierleyi. Biotechnology Progress , 1998, 15 (4) : 681–688. |
| [7] | 彭安安. 嗜酸硫氧化细菌元素硫活化氧化机制研究[D]. 长沙:中南大学, 2012. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=10&CurRec=1&recid=&FileName=1013358403.nh&DbName=CDFD1214&DbCode=CDFD&pr= |
| [8] | Mj O. Structure and biosynthesis of the bacterial cell wall. Annual Review of Biochemistry , 1969, 38 . |
| [9] | Friedrich CG, Bardischewsky F, Rother D, et al. Prokaryotic sulfur oxidation. Current Opinion in Microbiology , 2005, 8 (3) : 253–259. DOI:10.1016/j.mib.2005.04.005 |
| [10] | Quatrini R, Appia-Ayme C, Denis Y, et al. Extending the models for iron and sulfur oxidation in the extreme Acidophile Acidithiobacillus ferrooxidans. Bmc Genomics , 2009, 10 (9) : 507–521. |
| [11] | Xia JL, Liu HC, Nie ZY, et al. Synchrotron radiation based STXM analysis and micro-XRF mapping of differential expression of extracellular thiol groups by Acidithiobacillus ferrooxidans grown on Fe(2+)and S(0. ). Journal of Microbiological Methods , 2013, 94 (3) : 257–261. DOI:10.1016/j.mimet.2013.06.030 |
| [12] | 杨益. 极端嗜热菌Sulfolobus metallicus介导下硫元素形态与转化研究[D]. 长沙:中南大学, 2010. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=14&CurRec=1&recid=&FileName=2010187758.nh&DbName=CMFD2011&DbCode=CMFD&pr= |
| [13] | 丁建南. 几种高温浸矿菌的分离鉴定及其应用基础与浸矿潜力研究[D]. 长沙:中南大学, 2008. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=18&CurRec=1&recid=&FileName=2008166196.nh&DbName=CDFD9908&DbCode=CDFD&pr= |
| [14] | Chen ML, Zhang L, Gu GH, et al. Effects of microorganisms on surface properties of chalcopyrite and bioleaching. Transactions of Nonferrous Metals Society of China , 2008, 18 (6) : 1421–1426. DOI:10.1016/S1003-6326(09)60019-4 |
| [15] | 李彦臻, 刘畅, 杨利国. 奶牛 Y 精子膜蛋白的提取与分析. 生物技术通报 , 2008 (S1) : 258–263. |
| [16] | 夏金兰, 欧阳叙东, 张成桂, 等. 大肠杆菌外膜蛋白的分离及其双向电泳图谱的建立. 现代生物医学进展 , 2009, 9 (2) : 201–204. |
| [17] | 奥斯伯. 精编分子生物学实验指南[M]. 北京: 科学出版社, 1998. |
| [18] | 张成桂. 嗜酸氧化亚铁硫杆菌适应与活化元素硫的分子机制研究[D]. 长沙:中南大学, 2008. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=22&CurRec=1&recid=&FileName=2009208364.nh&DbName=CDFD0911&DbCode=CDFD&pr= |
| [19] | Ramirez P, Guiliani N, Valenzuela L, et al. Differential protein expression during growth of Acidithiobacillus ferrooxidans on ferrous iron, sulfur compounds, or metal sulfides. Applied & Environmental Microbiology , 2004, 70 (8) : 4491–4498. |
| [20] |
Buonfiglio V, Polidoro M, Soyer F, et al.
A novel gene encoding a sulfur-regulated outer membrane protein in Thiobacillus ferrooxid-ans. Journal of Biotechnology , 1999, 72 (1-2) : 85–93. DOI:10.1016/S0168-1656(99)00097-8 |
| [21] | 龙峰. TCA/丙酮沉淀对脑脊液标本中蛋白质双向电泳的影响分析. 四川医学 , 2010, 31 (4) : 532–533. |