生物乙醇被认为是传统燃料的重要替代品[1]。酿酒酵母(Saccharomyces cerevisiae)凭借较高的糖发酵能力、乙醇耐受性及生物安全性,已成为生产燃料乙醇的首选微生物[2]。大规模工业化生产常通过降低发酵体系的pH值来控制杂菌污染,但酿酒酵母的最适pH值为4.0-5.0,较低的pH会影响酵母的生长及发酵能力[2]。此外,木质纤维素已成为燃料乙醇生产的重要原料。利用其制备燃料乙醇通常包括木质纤维素的预处理、纤维素水解,以及糖类发酵产乙醇3个关键步骤[1]。而木质纤维素经稀酸预处理后的水解液pH较低,导致后续过程中酵母的生长及发酵受到抑制[2, 3]。调节水解液pH值会增加木质纤维素资源化的成本,同时也易提高发酵体系遭受外源微生物污染的风险[4]。选育优良的耐酸性酿酒酵母是提高乙醇产量并控制杂菌污染的必然选择。此外,絮凝性酵母具有的高微生物密度能提高其乙醇耐受性,且易与产物分离的特性更适用于工业发酵过程[5-7]。因此,培育多优良性状的絮凝性酿酒酵母在乙醇工业上具有广阔的应用前景。
微生物选育的方法包括定向进化,基因工程及原生质体融合等。酵母的耐酸机制较为复杂,目前报道较多的有质子泵、胞内碱性物质的产生、大分子的保护和修饰、细胞膜组分的变化、代谢途径的改变和其它调节因子的作用等[4]。因此,通过基因工程的手段,如仅改变某个或某些基因,难以实现优良耐酸菌株的筛选;依靠选择压力下微生物自然变异的定向进化技术又存在耗时费力的缺点[8]。针对机理尚不明确的微生物育种,源于基因组重组的原生质体融合技术是一种理想方法。它指通过物理(如电融合)、化学(如聚乙二醇)或生物(如仙台病毒)的诱导作用,将遗传性状不同的两个细胞的原生质体进行融合,以获得兼有双亲遗传性状的稳定重组子的过程,具有无需了解控制性状的机理及遗传物质交换完整等优势[9]。利用原生质体融合技术提高酿酒酵母的性能,多数研究集中在耐温高产乙醇菌株的选育,对耐酸菌的报道相当有限[10]。因此,本研究旨在利用原生质体融合技术,构建具有高效产乙醇能力的耐酸絮凝性酿酒酵母,为乙醇工业生产提供优良的微生物菌株资源。
1 材料与方法 1.1 材料 1.1.1 出发菌株絮凝性高效产乙醇酿酒酵母RHZ-1及耐酸耐温酿酒酵母SEB2均由本实验室选育保存。
1.1.2 培养基2% YPD培养基(g/L):葡萄糖20,酵母浸出粉10,蛋白胨20;MM培养基(g/L):无氨基酵母氮源1.7,酵母粉10,葡萄糖 20,2% YPDU培养基(g/L):蛋白胨2,硫酸铵1,葡萄糖20;尿嘧啶0.04;15% YPDU培养基:2% YPDU培养基中葡萄糖浓度为150 g/L。山梨醇高渗再生培养基(YEPDS):在2% YPD培养基中加入0.9 mol/L山梨醇。在配制固体培养基时加入2%的琼脂粉,所有培养基均在121℃条件下灭菌15 min后使用。
1.1.3 试剂无氨基酵母氮源、PEG4000购自Sigma公司;山梨醇、巯基乙醇、以及用于营养缺陷类型鉴定的营养物质购自Amresco公司;Zymolyase-20T购自MP Biomedicals公司;其它试剂均为国产分析纯。
1.2 方法 1.2.1 紫外诱变选育亲本营养缺陷型标记菌株 1.2.1.1 最佳紫外诱变时间的确定将菌株RHZ-1及SEB2分别转入2% YPD液体培养基中,30℃活化16 h。菌液经无菌水稀释后涂布到YPD平板上,将平板置于25 W已预热过的紫外灯下20 cm处照射不同时间后,于30℃静置培养。通过比较紫外诱变前后平板长出的菌落数,计算菌株的存活率,以确定最佳的紫外诱变时间。
1.2.1.2 营养缺陷型标记菌株的筛选经紫外诱变50 s后的亲本菌株于30℃静置培养2 d,将平板长出的菌落影印至MM平板,30℃过夜培养。对比YPD及MM平板长出的菌落,从YPD平板上挑选出无法在MM平板生长的菌落,即营养缺陷型标记菌。将这些菌株反复接种到YPD及MM平板上培养验证,获得稳定的营养缺陷型标记菌株。随后将这些菌株涂布到含不同营养物质(包括20种天然氨基酸、尿嘧啶、肌醇及腺嘌呤硫酸盐)的MM平板上,根据其在平板上的生长能力,鉴定营养缺陷类型。同时,对营养缺陷型标记菌株进行絮凝性,耐酸能力及发酵性能的评价,以获得最佳的亲本营养缺陷型标记菌株。
1.2.2 原生质体的制备与再生取2个亲本的营养缺陷型标记菌株,分别接种至100 mL的2% YPD培养基中,于30℃,160 r/min下培养12 h;将适量培养液装入50 mL离心管中,3 000 r/min离心5 min收集菌体;菌体经0.1 mol/L磷酸缓冲液清洗后,加入20 mL 预处理液(60 mmol/L EDTA-0.1 mol/L磷酸缓冲液和40 μL巯基乙醇),于30℃均匀振动30 min,3 000 r/min离心5 min收集菌体;添加20 mL终浓度为0.025 mg/mL的酵母细胞壁溶解酶(Zymolyase-20T),于30℃轻轻振荡1.5 h后,3 000 r/min离心5 min收集菌体;加入20 mL的0.6 mol/L KCl-0.1 mol/L磷酸缓冲液清洗菌体,2 000 r/min离心5 min后收集菌体,并将菌体悬浮于5 mL的0.9 mol/L山梨醇-0.1 mol/L磷酸缓冲液中备用。
原生质体形成率及再生率测定方法如下:取溶解酶处理前的菌悬液,经无菌水稀释后,涂布在2% YPD平板上,于30℃下培养2 d,记录酶解前菌落数(A);取溶解酶处理后的菌悬液,经无菌水稀释后涂布到2% YPD平板上,于30℃下培养2 d,记录未破壁菌落数(B);取原生质体菌悬液,涂布于YEPDS平板上,在30℃下培养2 d,记录再生菌落数(C);根据A、B、C值计算原生质体的形成率及再生率。
原生质体的形成率=(A-B)/A×100%
原生质体的再生率=(C-B)/(A-B)×100%
1.2.3 原生质体细胞的融合取2个亲本菌株的原生质体悬浮液(2×107/mL),按1∶1体积比(各取0.5 mL)混合后放置于1.5 mL离心管中,2 000 r/min离心5 min收集菌体;加入0.6 mol/L KCl-0.1 mol/L磷酸缓冲液清洗菌体2次;加入35% PEG4000-50 mmol/L CaCl2溶液,悬浮菌体,并于30℃静置1 h后,2 000 r/min离心5 min收集菌体;将菌体悬浮于0.6 mol/L KCl-0.1 mol/L磷酸缓冲液中;取悬浮液稀释后涂布到MM平板上,于30℃培养2-3 d,从长出的菌落中筛选出同时具有絮凝性,耐酸能力且发酵性能最佳的融合子。
1.2.4 菌株的性能评价 1.2.4.1 絮凝性评价将菌株接种至2% YPDU培养基(pH自然)中培养16 h。分别取5 mL菌体培养液于试管中,漩涡振荡均匀,静置不同时间后观察菌株的絮凝性。
1.2.4.2 耐酸能力评价(1)絮凝性酵母:取5 mL发酵液振荡均匀,取出500 μL,加入适量0.1 mmol/L EDTA打散菌体,再加超纯水稀释至适当倍数,利用紫外分光光度计测定酵母浓度(OD660);(2)非絮凝性酵母:将菌株接种至pH3.0和pH2.7的2% YPDU培养基中,并在35℃下于小型试管培养仪(ADVANTEC,日本)中培养,仪器自动记录不同时间菌体生长的OD660值。
1.2.4.3 发酵性能评价将菌株分别接种至2%YPDU培养基(pH自然)中,并于30℃,160 r/min预培养16 h。再按10%接种量接种至不同pH的15% YPDU培养基中发酵,定时取样检测总细胞数、葡萄糖浓度和乙醇浓度。菌株的性能评价实验均重复3次。
1.2.5 化学分析取5 mL发酵液于4℃、10 000 r/min条件下离心2 min,上清经0.45 μm的滤膜过滤,用于葡萄糖和乙醇浓度分析。利用LC-10AD VP高效液相色谱仪(Shimadzu,日本)分析葡萄糖浓度,检测器为RF-10AXL,炉温为150℃,柱温为65℃;利用GC 353B气相色谱仪(GL sciences,日本)测定乙醇浓度,以异丙醇为内标,氦气为载气,氢气为燃气,炉温为50℃,注射器和检测器温度均为180℃。
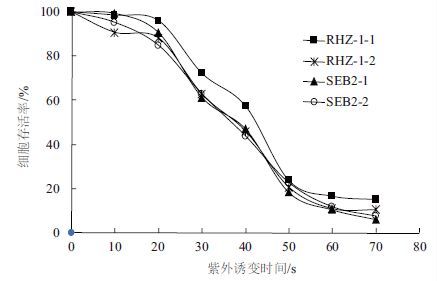
2 结果 2.1 营养缺陷型标记菌株的筛选利用紫外诱变的方法获得亲本菌株的营养缺陷型标记菌株。考察了紫外诱变时间对菌株存活率的影响。图 1显示,延长紫外诱变时间会降低菌株的细胞存活率。一般认为细胞存活率在20%-25%时获得的突变菌株比较适合,可以保障菌株性能不受太大影响。因此,确定两个亲本菌株的最佳紫外诱变时间均为50 s。在该诱变条件下经过4次反复筛选验证,最终获得3株RHZ-1和5株SEB2的营养缺陷型标记菌株,每株挑选2个克隆,分别命名为RHZ-A1(A2)、RHZ-B1(B2)、RHZ-C1(C2);SEB-A1(A2)、SEB-B1(B2)、SEB-C1(C2)、SEB-D1(D2)和SEB-E1(E2)。
|
| 图 1 紫外诱变时间的优化 菌株RHZ-1-1、RHZ-1-2和SEB2-1、SEB2-2分别为亲本菌株RHZ-1和SEB2的两个克隆 |
将上述16株突变菌株涂布到含不同营养物的MM平板上,通过其生长能力来鉴定营养缺陷类型(图 2)。RHZ-A1(A2)和SEB-D1(D2)为尿嘧啶缺陷型菌株(Ura-);RHZ-B1(B2)为赖氨酸缺陷型菌株(Lys-);RHZ-C1(C2)为半胱氨酸缺陷型菌株(Cys-);SEB-B1(B2)为腺嘌呤缺陷型菌株(Ade-);SEB-E1(E2)为组氨酸缺陷型菌株(His-)。而SEB-A1(A2)和SEB-C1(C2)在所有MM平板上均不生长,表明这4株菌为两种或多种不同营养缺陷型菌株,无法用于原生质体融合的遗传标记筛选,后续不再对其进行考察。

|
| 图 2 亲本突变菌株的营养缺陷类型鉴定 a:亲本菌株RHZ-1的营养缺陷型菌株;RHZ-A1(A2),RHZ-B1(B2),RHZ-C1(C2);b:亲本菌株SEB2的营养缺陷型菌株:SEB-A1(A2),SEB-B1(B2),SEB-C1(C2),SEB-D1(D2),SEB-E1(E2);P.C.:阳性对照菌 |
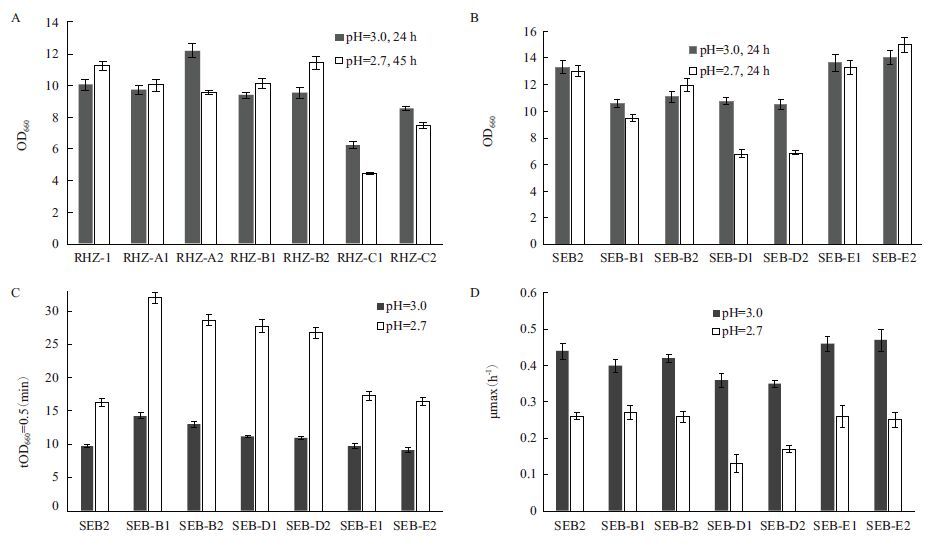
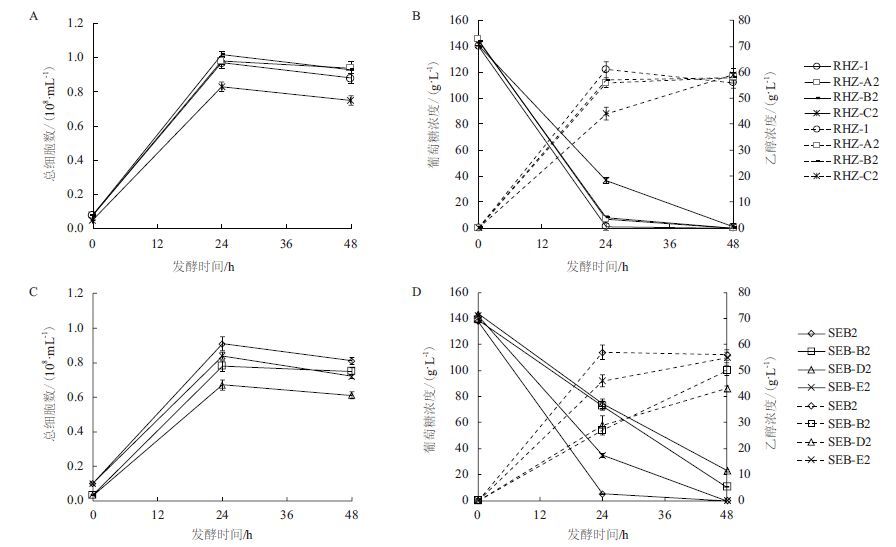
对亲本RHZ-1的营养缺陷型标记菌株进行了絮凝性测试,结果显示所有突变菌株都具有良好的絮凝性。考察了这些菌株在35℃的耐酸能力。如图 3-A所示,在不同pH条件下,菌株RHZ-B1(B2)的生长能力与亲本RHZ-1基本接近;在pH3.0条件下,菌株RHZ-A2的生长明显优于亲本菌株;酸性条件对菌株RHZ-C1(C2)的生长均存在抑制,菌株RHZ-C1的生长在pH2.7条件下被严重抑制。因此,选择菌株RHZ-A2、RHZ-B2和RHZ-C2进行发酵实验筛选。发酵结果(图 4)显示,菌株RHZ-B2(Lys-)具有较高的发酵性能,其在细胞生长、乙醇产生量、葡萄糖消耗方面,均接近出发菌株RHZ-1。因此,选择RHZ-B2(Lys-)作为后续原生质体融合的亲本菌株。
|
| 图 3 酸性条件下亲本营养缺陷型菌株的生长能力评价(35℃,2%YPDU) A:亲本RHZ-1的营养缺陷型菌株;B-D:亲本SEB2的营养缺陷型菌株 |
|
| 图 4 亲本营养缺陷型菌株的发酵能力评价(35℃,15% YPDU,pH2.7) |
以出发菌株SEB2作为对照,比较不同pH条件下营养缺陷型标记菌株间的OD660、最大生长速率μmax(h-1),以及OD660达到0.5所需时间tOD660=0.5(min),以判断各菌株的耐酸能力(图 3-B,C,D)。可以看出,在pH3.0和pH2.7条件下,只有菌株SEB-E1(E2)的生长能力接近亲本菌株SEB2,其它菌株的生长均受到一定抑制;当pH为2.7时,抑制情况更加明显。选择菌株SEB-B2、SEB-D2、SEB-E2进行发酵实验筛选。发酵结果(图 4)显示,SEB-E2(His-)在细胞生长、乙醇产生量、葡萄糖消耗方面,均比另外两个菌株具有更好的性能。因此,选择SEB-E2(His-)作为后续原生质体融合的亲本菌株。
2.3 原生质体细胞的融合以菌株RHZ-B2(Lys-)和SEB-E2(His-)作为亲本,进行原生质体细胞的融合。考察了酵母细胞壁裂解酶浓度对原生质体制备过程的影响。如表 1所示,受试裂解酶浓度均可获得100%的原生质体形成率,表明酵母细胞破壁较为理想,但对再生率的影响较大。酵母裂解酶浓度为0.025 mg/mL时,菌株RHZ-B2(Lys-)和SEB-E2(His-)可获得最好的原生质体再生率,分别为4.0%和7.5%,有利于下一步融合。
将融合后的菌悬浮液涂布到平板上,对长出的融合子进行筛选,共获得16株融合子,命名为RS-1-RS-16。考察了融合菌株的絮凝性,结果显示所有融合菌株RS均具有与亲本RHZ-1同等程度的絮凝性。在30℃,pH2.2,15%YPD条件下的发酵结果(图 5)显示,融合菌株RS-1、RS-6及RS-10的葡萄糖消耗速率及乙醇产生量均优于亲本RHZ-1,其中菌株RS-1的发酵性能最佳。发酵24 h时,菌株RS-1的残糖量为31.88 g/L[糖消耗速率为4.9 g/(L·h)],乙醇产生量为47.87 g/L,基于糖消耗的乙醇收率为0.41 g/g;亲本RHZ-1残糖量为52.7 g/L[糖消耗速率为4.1 g/(L·h)],乙醇产生量为35.93 g/L,基于糖消耗的乙醇收率为0.37 g/g。与RHZ-1相比,RS-1的糖消耗速率和乙醇收率分别提高了19.5%和9.8%。

|
| 图 5 30℃条件下融合菌株的发酵能力评价(15% YPDU,pH 2.2) |
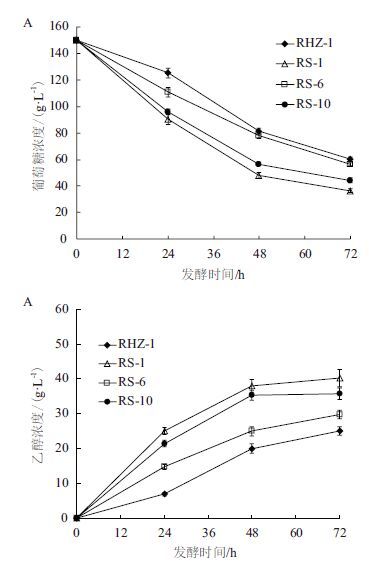
进一步比较了融合菌株在更高温度(35℃)条件下的发酵能力。如图 6所示,与亲本RHZ-1相比,融合菌株在高温下的耐酸性能大大提高,菌株RS-1的发酵性能仍然最佳。发酵48 h时,融合菌株RS-1的残糖量为48.04 g/L[糖消耗速率为2.1 g/(L·h)],乙醇产生量为38 g/L,基于糖消耗的乙醇收率为0.37 g/g。亲本RHZ-1的残糖量为81.3 g/L[糖消耗速率为1.43 g/(L·h)],乙醇产生量为20.07 g/L,基于糖消耗的乙醇收率为0.29 g/g。与RHZ-1相比,RS-1的糖消耗速率和乙醇收率分别提高了46.8%和21.6%。因此,本研究以絮凝性菌株RHZ-1和耐酸性菌株SEB2为出发菌株,通过原生质体细胞融合,最终获得一株兼有双亲遗传性状,且具有优秀乙醇发酵性能的耐酸絮凝性酿酒酵母菌株RS-1。
|
| 图 6 35℃条件下融合菌株的发酵能力评价(15% YPDU,pH 2.2) |
酿酒酵母是乙醇生产中最常用的发酵菌株。在实际的乙醇生产工艺中,木质纤维素原料的预处理以及杂菌污染的控制过程均会降低发酵体系的pH值[4]。如巴西的乙醇生产过程中,酵母细胞需经pH2.0-2.5的稀硫酸洗涤1-2 h以去除杂菌污染,再返回到发酵池进行重复发酵[11]。但酿酒酵母在低pH值下往往难以维持较高的存活率及发酵性能,尤其在其它胁迫压力(如高温、高糖、高乙醇浓度等)共存时情况会更加严峻[12]。因此,同时拥有多种优良性状的酿酒酵母在提高乙醇产量及降低发酵成本方面更具有应用前景。
酿酒酵母对环境压力的耐受原理非常复杂,耐酸及耐温机制尚不清楚。全基因组表达分析显示约2/3的酵母基因参与环境胁迫的应答机制,且不同菌株之间的响应区别较大[13, 14]。因此,传统的育种技术如物理化学突变、原生质体融合、基因组改组等更适用于遗传背景不清楚的工业酵母的育种,尤其适于多种优良性状菌株的整合。潘静等[15]利用紫外诱变和3轮原生质体融合技术相结合的方法,有效选育出能同时耐受48℃,19% vol乙醇和pH2.6 的高产酵母菌株。Mitsumasu等[16]和Benjaphokee等[17]分别利用交配的方法获得了酿酒酵母二倍体菌株,它们在41℃、pH3.5条件下的乙醇产量比原始菌株均有提高。关妮等[18]通过双亲灭活的原生质体融合技术,获得一株耐受高浓度乙醇的絮凝性酿酒酵母。但乙醇工业上真正具有多种优良性状的菌株仍然较少。
本研究以絮凝性酿酒酵母RHZ-1及耐酸耐温酿酒酵母SEB2为亲本,应用原生质体融合技术,获得一株优秀的耐酸絮凝性酿酒酵母菌株RS-1。由于现有研究多采用不同选育方法获得有机酸耐受酿酒酵母(如甲酸、乙酸等),而对耐受低pH无机酸的相关报道有限,因此可用于与本研究获得的菌株进行比较的同类菌株很少[19]。Ortiz-Muñiz等[20]从糖蜜发酵液中分离出性能优良的野生菌株ITV-01,在30℃、pH2.5条件下利用15% YPD发酵,发酵36 h后残糖量为72.2 g/L,乙醇收率为0.39 g/g。而本研究获得的菌株RS-1,在30℃、pH2.2条件下利用15% YPD发酵,24 h后的残糖量仅为31.88 g/L,乙醇收率为0.41 g/g。且菌株ITV-01在温度高于35℃、pH低于3.5的条件下难以生长,表明其无法耐受高温及低pH值的协同压力。本实验室前期通过逐步降低发酵体系pH长期驯化的方式,获得了一株耐酸性能优良的酿酒酵母SCiK12-BC4[21]。在35℃,pH2.5条件下利用15%YPD发酵48 h后,SCiK12-BC4基于糖消耗的乙醇收率(0.41 g/g)与菌株RS-1(35℃,pH2.2,0.37 g/g)接近。但整个过程耗时,工作量大,且耐酸能力不如菌株RS-1。原生质体融合技术具有在较短周期内选育优良菌株的优势。对融合菌株RS-1进行了长期反复传代培养(传代34次),验证了其耐酸性能的稳定性。此外,杜昭励等[22]发现絮凝基因FLO1 及FLO1c 的高表达可有效提高工业酿酒酵母的乙酸耐受性及发酵性能。因此,今后将进一步探索以提高菌株RS-1的耐乙酸及耐温性能,为燃料乙醇工业化生产提供优秀的多耐性微生物菌株资源。
4 结论以絮凝性酿酒酵母RHZ-1及耐酸耐温酿酒酵母SEB2为亲本,通过原生质体融合技术选育出一株优秀的耐酸絮凝性酿酒酵母RS-1。发酵结果显示,菌株RS-1在30℃及35℃的酸性条件下(pH2.2),均能高效发酵葡萄糖产乙醇,且该菌株的糖消耗速率和基于糖消耗的乙醇收率均比亲本菌株RHZ-1有较大提高。结果表明原生质体融合技术是快速获得耐酸絮凝性酿酒酵母的有效手段。
| [1] | Morales M, Quintero J, Conejeros R, et al. Life cycle assessment of lignocellulosic bioethanol:Environmental impacts and energy balance. Renewable and Sustainable Energy Reviews , 2015, 42 : 1349–1361. DOI:10.1016/j.rser.2014.10.097 |
| [2] | Madhavan A, Srivastava A, Kondo A, et al. Bioconversion of lignoc-ellulose-derived sugars to ethanol by engineered Saccharomyces cerevisiae. Critical Reviews in Biotechnology , 2012, 32 (1) : 22–48. DOI:10.3109/07388551.2010.539551 |
| [3] | Carrere H, Antonopoulou G, Affes R, et al. Review of feedstock pretreatment strategies for improved anaerobic digestion:From lab-scale research to full-scale application. Bioresource Technology , 2016, 199 : 386–397. DOI:10.1016/j.biortech.2015.09.007 |
| [4] |
Cotter PD, Hill C.
Surviving the acid test:Responses of gram-positive bacteria to low pH. Microbiology and Molecular Biology Revi-ews , 2003, 67 (3) : 429–453. DOI:10.1128/MMBR.67.3.429-453.2003 |
| [5] | Choi GW, Um HJ, Kang HW, et al. Bioethanol production by a flocculent hybrid, CHFY0321 obtained by protoplast fusion between Saccharomyces cerevisiae and Saccharomyces bayanus. Biomass and Bioenergy , 2010, 34 (8) : 1232–1242. DOI:10.1016/j.biombioe.2010.03.018 |
| [6] | Zhao XQ, Bai FW. Yeast flocculation:New story in fuel ethanol production. Biotechnology Advances , 2009, 27 (6) : 849–856. DOI:10.1016/j.biotechadv.2009.06.006 |
| [7] | 胡纯铿, 白凤武, 安利佳. 絮凝特性对自絮凝颗粒酵母耐酒精能力的影响及作用机制. 生物工程学报 , 2005, 21 (1) : 123–128. |
| [8] | 巩继贤, 郑辉杰, 郑宗宝, 等. 微生物进化工程育种技术进展与展望. 生物加工过程 , 2010, 8 (2) : 69–76. |
| [9] | 赵春苗, 徐春厚. 原生质体融合技术及在微生物育种中的应用. 中国微生态学杂志 , 2012, 24 (4) : 379–382. |
| [10] | 叶世超, 薛婷, 王晓斐, 等. 酿酒酵母耐高温提高技术的研究进展. 中国农学通报 , 2013, 29 (21) : 126–130. |
| [11] | Bassi AP, da Silva JC, Reis VR, et al. Effects of single and combined cell treatments based on low pH and high concentrations of ethanol on the growth and fermentation of Dekkera bruxellensis and Saccharomyces cerevisiae. World Journal of Microbiology & Biotechnology , 2013, 29 (9) : 1661–1676. |
| [12] | de Melo HF, Bonini BM, Thevelein J, et al. Physiological and molecular analysis of the stress response of Saccharomyces cerevisiae imposed by strong inorganic acid with implication to industrial fermentations. Journal of Applied Microbiology , 2010, 109 (1) : 116–127. |
| [13] | Causton HC, Ren B, Koh SS, et al. Remodeling of yeast genome expression in response to environmental changes. Molecular Biology of the Cell , 2001, 12 (2) : 323–337. DOI:10.1091/mbc.12.2.323 |
| [14] | Garay-Arroyo A, Covarrubias AA, Clark I, et al. Response to different environmental stress conditions of industrial and laboratory Saccharomyces cerevisiae strains. Applied Microbiology and Biotechnology , 2003, 63 (6) : 734–741. |
| [15] | 潘静, 王昌禄, 李风娟, 等. 多耐性酒精酵母菌的选育及特性研究. 中国酿造 , 2011, 30 (5) : 113–116. |
| [16] | Mitsumasu K, Liu ZS, Tang YQ, et al. Development of industrial yeast strain with improved acid- and thermo-tolerance through evolution under continuous fermentation conditions followed by haploidization and mating. Journal of Bioscience and Bioengineering , 2014, 118 (6) : 689–695. DOI:10.1016/j.jbiosc.2014.05.012 |
| [17] | Benjaphokee S, Hasegawa D, Yokota D, et al. Highly efficient bioethanol production by a Saccharomyces cerevisiae strain with multiple stress tolerance to high temperature, acid and ethanol. New Biotechnology , 2012, 29 (3) : 379–386. DOI:10.1016/j.nbt.2011.07.002 |
| [18] | 关妮, 杨登峰, 米慧芝, 等. 多优良性状工业化酿酒酵母的选育及其特性研究. 中国酿造 , 2010, 29 (9) : 45–48. |
| [19] | Sanda T, Hasunuma T. Repeated-batch fermentation of lignocellulosic hydrolysate to ethanol using a hybrid Saccharomyces cerevisiae strain metabolically engineered for tolerance to acetic and formic acids. Bioresource Technology , 2011, 102 (17) : 7917–7924. DOI:10.1016/j.biortech.2011.06.028 |
| [20] | Ortiz-Mu?iz B, Carvajal-Zarrabal O, Torrestiana-Sanchez B, et al. Kinetic study on ethanol production using Saccharomyces cerevisiae ITV-01 yeast isolated from sugar cane molasses. Journal of Chemical Technology & Biotechnology , 2010, 85 (10) : 1361–1367. |
| [21] | 罗珠, 汤岳琴, 孙照勇, 等. 基于连续发酵驯化的耐酸性酿酒酵母的育种. 四川大学学报:自然科学版 , 2014, 51 (4) : 821–828. |
| [22] | 杜昭励, 程艳飞, 朱卉, 等. 絮凝基因FLO1及FLO1c高表达提高工业酿酒酵母乙酸耐受性及发酵性能. 生物工程学报 , 2015, 31 (2) : 231–241. |