在生物体中,蛋白激酶在接受信号、感知信号并传递给效应基因的过程中起着重要作用。植物类受体激酶(receptor-like kinase,RLK)是信号通路上的保守成分,由数量庞大的不同种类的蛋白质组成。RLKs可调节植物很多生理过程,包括植物的生长发育、激素的感知、植物的应激反应和生物及非生物胁迫的应答等。典型的RLK包含一个信号肽(signal peptide),一个可变的胞外结构域(extracellular domain),跨膜结构域(transmembrane domain)和胞内的激酶结构域(intracellular protein kinase domain)。一般情况下,根据细胞外的配体结合结构域(ligand-binding domain)将类受体激酶分成不同的亚类。其中有一大类RLKs,其胞外结构域中含有一个或多个功能未知结构域26(domain of unknow function 26,DUF26),由于DUF26中含有富含半胱氨酸的模体(C-X8-C-X2-C motif),这一大类RLKs也是富含半胱氨酸的类受体激酶(cysteine-rich receptor-like kinases,CRKs)。在拟南芥中RLKs是最大的基因家族之一,其包含有610多个亚家族成员,占拟南芥编码蛋白基因的2.5%[1]。目前,在拟南芥中已发现至少44个CRK成员,并且大多数CRK成员均串联排列于4号染色体上[2]。近十年来的研究表明,拟南芥中一些CRKs在生物与非生物胁迫、植物的生长发育及细胞信号转导中起着至关重要的作用。在其他植物中也有相关报道,如大麦、小麦、水稻和番茄等。本文就CRKs结构与功能等方面的最新研究进展做一综述。总结已发现的植物CRK蛋白的结构特征以及其在生物胁迫、非生物胁迫及生长发育中的功能,并对CRK未来的研究进行了展望,以期为后续阐明CRK的功能和分子机制提供参考。
1 CRKs结构特征典型的CRK包含信号肽、富含半胱氨酸的胞外结构域、跨膜域和胞内的激酶结构域,如图 1所示。

|
| 图 1 典型的富含半胱氨酸类受体激酶结构示意图 |
典型的CRKs蛋白在胞外一般含有一个信号肽和富含有半胱氨酸的一个或是两个DUF26结构域,其保守模式为C-X8-C-X2-C也被称之为富含半胱氨酸的重复序列(cysteine-rich repeats moif,CRR motif)。植物特异性的CRR一般含有13-15个氨基酸序列。CRR的重复次数一般为两次。每个DUF26结构域中包含4个保守的半胱氨酸,其中有3个构成C-8X-C-2X-C模体(motif)。图 2为拟南芥、小麦、短柄草、水稻和玉蜀黍CRKs的CRR序列比对结果[3]。DUF26的确切功能还不知道,但结构域中保守的半胱氨酸残基可能通过形成二硫键,作为巯基氧化还原调控的潜在位点,以及活性氧(reactive oxygen species,ROS)的传感器起作用[4]。C-X2-C还可能是过渡金属的结合位点[5]。
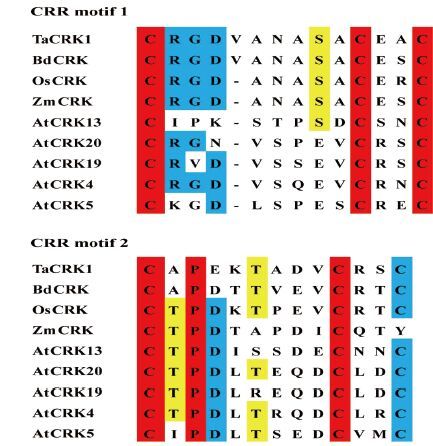
在绿色植物中,有520类蛋白质具有DUF26结构域。其中水稻中有263类蛋白质具有DUF26结构域[3]。拟南芥中有97类蛋白质具有DUF26结构域,其中46个为CRK。拟南芥44个CRKs命名与具有DUF26结构域的RLKs对应关系,如表 1所示[4]。剩余的2个基因中,At4g11500(DUF26 44)在当前的拟南芥基因组中属于假基因,At4g23170(CRK9)没有可辨认的胞外结构域、信号肽和完整的激酶结构域[4]。
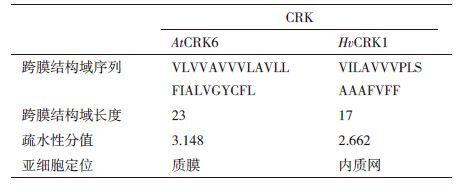
典型的CRK具有一个跨膜结构域,跨膜结构域一般含有10-30个氨基酸残基。现有研究表明,CRK有的定位在质膜上,还有的定位在内质网(endoplasmic reticulum,ER)上。跨膜结构域中单个核苷酸的改变,就可能使原本定位在质膜上蛋白质定位到内质网上[6]。拟南芥AtCRK6(At4g23140)跨膜结构域含有23个氨基酸残基,疏水性分值为3.148,经亚细胞定位分析其定位在质膜上。大麦HvCRK1跨膜结构域含有17个氨基酸残基,疏水性分值为2.662,分析其定位在内质网上[6]。拟南芥AtCRK6与大麦HvCRK1的跨膜结构域比较(表 2)[6]发现,定位在质膜上的拟南芥AtCRK6与定位在内质网上的大麦HvCRK1,最显而易见的不同是拟南芥AtCRK6中有亮氨酸-缬氨酸-甘氨酸(leucine-valine-glycine,LVG),而大麦HvCRK1则是3个丙氨酸的重复(alanine-alanine-alanine,AAA),据推测这个差异可能导致疏水性的差异,进而影响蛋白质的亚细胞定位[6]。研究表明,AtCRK4、AtCRK6 和AtCRK36是质膜定位的蛋白[7]。小麦TaCRK1也是膜蛋白,定位在质膜上[3]。
一般在CRK的C末端存在有一个激酶结构域。CRK的激酶结构域基本上都属于丝氨酸/苏氨酸型。激酶结构域的突变会影响激酶活性。植物丝氨酸/苏氨酸激酶域的亚细胞结构一般包含11个保守的子区域,称为激酶域的亚结构域。其中亚结构域Ⅰ、Ⅱ、Ⅲ主要承担ATP的结合和催化,亚结构域Ⅶ、Ⅷ被称为活化环(或称A环)。很多激酶在激活时,这个区域会被磷酸化,从而形成一个可以与底物结合的稳定结构。蛋白激酶结构域的特征带有催化位点。如图 3所示,小麦TaCRK1的激酶结构域,其中由罗马数字Ⅰ-Ⅺ标记的是植物丝氨酸/苏氨酸激酶域的11个保守的亚结构域[3]。
2 生物学功能植物中类受体蛋白激酶可以调节植物发育、抵抗病原菌的侵害、激素信号感知等保守信号组分。富含半胱氨酸的类受体激酶是类受体蛋白激酶中最大的亚家族之一。CRKs在植物的生物与非生物胁迫、生长发育及细胞信号转导中起着至关重要的作用。
2.1 CRKs在生物胁迫应答中的功能植物体在生长发育过程中不断接受外界环境及体内细胞间的各种刺激信号,从而引发一系列的信号转导途径,并做出相应的反应。胞外信号只有首先被受体识别和接受之后,才能将胞外信号跨膜转化为胞内信使,通过胞内信使的传递引起细胞的生理生化反应。植物生长发育过程中被病原菌侵染是不可避免的,植物在抵抗病原菌侵染的过程中进化出两种类型的免疫系统: 第一种通过模式识别受体(pattern recognition receptors,PRRs)感知微生物相关的或病原菌相关的分子模式(microbe/pathogen-associated molecular patterns,MAMPs/PAMPs),产生病程相关分子模式诱导免疫(MAMP/PAMP triggered immunitiy,MTI/PTI)。PTI是植物的初级先天免疫反应,是植物免疫系统的第一道防线。病原菌在侵染植物被初级先天免疫抑制之后,会释放出效应蛋白(effector)来抵抗PTI。早期PTI应答会导致突发性氧化物(reactive oxygen species,ROS)的爆发[4, 8]。晚期PTI应答的典型特征为胼胝质的累积[7, 9];第二种免疫反应通过植物细胞内的抗性蛋白(resistance protein,RP)识别这些特殊的效应蛋白,引发效应蛋白诱导免疫(effector triggered immunity,ETI),是植物的次级免疫反应。植物的次级免疫反应发生时,水杨酸(salicylic acid,SA)在被侵染细胞中迅速积累,甲基水杨酸作为信号分子可以运输到远端的组织,可诱导植株远端未侵染部位对后续多种病原菌侵染表现出抗性,被称为系统获得抗性(systemic acquired resistance,SAR)。SAR是一种以病程相关蛋白的表达为特征的具有广谱性抗性的免疫。大部分这样的相互作用导致病原感染部位宿主细胞死亡,此现象称为过敏反应(hypersensitive response,HR)。HR是指由于病原物侵染而引起的局部、快速的细胞程序化死亡(programmed cell death,PCD),从而阻止了病原物进一步扩散。
有关CRK参与植物抗病防御反应的研究还不是很多。现已知CRK可被氧化性胁迫、病原菌侵染及喷施SA诱导表达[1, 2, 4, 10-12]。拟南芥AtCRK17受SA的诱导表达[13]。Chen等[12]的研究发现,过量表达AtCRK5可增强对病原菌Pst DC3000(Pseudomonas syringae pv. tomato DC3000)抗性,快速诱导PR1基因的表达,并触发过敏反应导致细胞程序化死亡。而在Burdiak等[14]的研究中却得出atcrk5突变体可以增强细胞死亡的效应,认为AtCRK5是细胞死亡的负调控因子[14]。用诱导型启动子过量表达AtCRK4、AtCRK19 和AtCRK20都能引起过敏反应致细胞程序化死亡[1]。接种Pst DC3000会诱导AtCRK13快速表达,并且过量表达AtCRK13的拟南芥植株可激活病原菌防御反应,包括组织快速死亡,积累高水平的防御相关基因PR1、PR5和ICS1的转录物及积累SA,而且这些植物对病原菌的抑制效果比对照高20倍。AtCRK13对病原菌的抑制作用是依赖于SA的[15]。拟南芥AtCRK6和AtCRK7参与介导了胞外ROS的产生[16]。拟南芥AtCRK20受病原菌、SA及臭氧(ozone)在转录水平的诱导,接种Pst DC3000的AtCRK20突变体,病原菌的生长显著降低,说明AtCRK20能够促进病原菌Pst DC3000在拟南芥中的生长[17]。拟南芥AtCRK45 过表达植株表现出对丁香假单胞菌更强的抗性,并且在依赖水杨酸的抗病信号途径中,AtCRK45 位于 NPR1 的下游,在转录水平上受到转录因子 NPR1 和 WRKY70 的调控[8]。
2014年的研究发现,拟南芥中响应于 L-植物凝集素受体激酶Ⅵ.2(L-type lectin receptor kinase-Ⅵ.2,LecRK-Ⅵ.2)的AtCRK4、AtCRK6、AtCRK36能够增强PTI反应,过量表达AtCRK4、AtCRK6和AtCRK36的品系不仅对有毒的丁香假单胞杆菌DC3000抵抗作用增强,而且过量表达AtCRK4、AtCRK6及AtCRK36改变了早期、中期和晚期的PTI应答。ROS的爆发是一种早期的PTI反应[18],过量表达AtCRK4、AtCRK6和AtCRK36的品系经MAMP flg22处理后,可使ROS的爆发增强。受PTI响应的FRK1(FLS22-INDUCED RECEPTOR-LIKE1,FRK1)的表达水平是一种中期的PTI反应[19],经flg22处理3 h后,在过量表达AtCRK4和AtCRK6 的品系中,FRK1的表达显著上调。而flg22诱导1 h后,AtCRK36的过量表达即可增加FRK1 mRNA的积累,说明AtCRK36对FRK1的表达具有直接的效应。胼胝质的沉积是一种典型的晚期PTI反应[20],过量表达AtCRK4和AtCRK6 不会影响胼胝质的沉积,而AtCRK36的过量表达可以积累更多的胼胝质。AtCRK4、AtCRK6及AtCRK36的过量表达植株可增强气孔免疫。作为PTI反应的一部分,当拟南芥接触到细菌时会关闭气孔,像Pst DC3000这类的毒性细菌,为了进入到叶片中,会以依赖冠菌素(coronatine)的方式诱导气孔重新开放[9, 21]。在过量表达AtCRK4和AtCRK36的品系中,Pst DC3000诱导的气孔重新开放被抑制,而过量表达AtCRK6可使气孔持续关闭,说明AtCRK6是一种很强的调节气孔关闭的正调节蛋白。双分子荧光互补(bimolecular fluorescence complementation,BiFC)和免疫共沉淀(co-immunoprecipitation,Co-IP)实验均表明,质膜定位的AtCRK4、AtCRK6 和AtCRK36可以与模式识别受体FLAGELLIN SENSING2(FLS2)结合[7]。
除了在拟南芥中有对CRK的研究,菜豆根中分离的CRK基因PvPK20-1也可以被病原菌、共生体(symboint)和结瘤因子(nodulation factor)调控表达[22]。在小麦中也发现,TaCRK1对丝核菌属的病原菌禾谷丝核菌有抵抗作用[3, 23]。从银杏种子胚乳中分离出一个新的抗真菌蛋白Gnk2(ginkbilobin-2,Gnk2),包含一个保守的C-X8-C-X2-C的模体,能够抑制植物病原真菌尖孢镰刀菌(Fusarium Oxysporum)的生长[19]。水稻OsCRK1 基因沉默后影响了水稻对白叶枯病的抗性,进一步证明该基因与白叶枯病抗性密切相关[24]。
2.2 CRKs参与非生物胁迫应答目前的研究表明,有些CRK也参与了植物对非生物胁迫的应答。拟南芥AtCRK45又称为ACRK1,atcrk45突变体在种子萌发和幼苗早期生长中对 ABA 表现出较野生型更不敏感的表型,而 AtCRK45 过表达植株却与之相反;在高盐条件下 AtCRK45 过表达植株与野生型相比表现出更敏感的表型,相反地,Atcrk45突变体却更不敏感;在干旱胁迫条件下,AtCRK45过表达植株的抗旱能力较野生型更强。基因分析表明,在AtCRK45过表达植株中,响应于盐胁迫的代表性的逆境响应基因的表达显著增强,且ABA生物合成的基因,如NCED3、NCED5、ABA2及 AAO3的表达也持续升高。上述结果表明,AtCRK45通过调节ABA的生物合成而调控着拟南芥对非生物胁迫的应答[8, 25]。AtCRK36受非生物胁迫的诱导[26],在细胞内AtCRK36与AtCRK45 在质膜结合,体外实验中,AtCRK36可使AtCRK45 磷酸化,进而引发下游逆境胁迫相关基因的表达。因此,AtCRK45 与AtCRK36 在植物细胞内共同作用,并参与应答ABA 和渗透胁迫信号的负调控反应[8, 22]。拟南芥AtCRK18对ABA敏感[27],AtCRK29在ABA的影响下会显著下调[28]。AtCR-K3、AtCRK11、AtCRK13、AtCRK14、AtCRK15、At-CRK17、AtCRK20、AtCRK28和AtCRK36对O3应答起正调节作用[16]。此外还发现AtCRK5能够增强拟南芥对紫外线的耐受性[14]。
2.3 CRKs影响植物的生长发育据最新的研究表明,AtCRK5通过影响植物的光合作用来影响植物的生长发育。AtCRK5能够增强植物对CO2的同化作用,AtCRK5突变植株的光抑制作用明显增强。其捕光能力减弱。AtCRK5通过影响植物的蒸腾作用提高植物对水的利用效率。AtCRK5突变体植株的生物合成量明显减少,并伴随着气孔导度下降。AtCRK5突变体还可以加剧拟南芥的衰老,尤其在持续黑暗和氧化胁迫的环境中更明显[14]。
研究发现,番茄SlCRK1的表达具有组织特异性,SlCRK1在花中的表达量要高于根、叶、果实和种子其他组织。进一步研究发现在花这一器官中SlCRK1的表达是具有花粉特异性的。SlCRK1的启动子区域含有花粉特异性顺式作用元件[29]。
3 CRKs是细胞信号转导途经的组成部分类受体蛋白激酶是一类具有酶活性的受体。RLKs 既是一种跨膜蛋白,同时有受体及蛋白激酶的活性,对外界信号的接收、跨膜转导及向胞内传递,RLKs 完全能独立完成[30]。富含半胱氨酸的类受体蛋白激酶参与细胞信号转导途经。拟南芥富含半胱氨酸的类受体激酶家族成员之一AtCRK45参与了拟南芥中水杨酸介导的抗病信号途径[8]。此外,在基因表达公共数据库(gene expression omnibus databa-se,GEO)中检索也显示拟南芥CRK45可能参与了植物对光、紫外辐射、真菌激发子、盐胁迫、氧化胁迫、干旱、水杨酸、脱落酸和赤霉素等的响应[8]。
4 展望富含半胱氨酸的类受体激酶是整个类受体蛋白激酶中最大的亚家族之一。已经发现,它们在植物对病原菌的防卫、细胞程序性死亡、应对非生物胁迫及生长发育中起着重要的作用。进一步了解植物中CRK的整个信号传导路径,将对了解植物生长发育及应对逆境机制的研究有很大的帮助,进一步用于农业生产,可以增强农作物对不良环境的抗性,提高作物的产量,优化作物种子质量。但对于CRKs介导的信号转导途径的分子机制还不是很清楚,还有以下几个方面有待于我们进一步去探索。
对CRKs亚结构域功能的研究。目前克隆了大量的CRK基因,但对这些基因亚结构域的功能研究很少,通过定点突变、结构域缺失、区域交换等方法可进一步了解各亚结构域在信号转导中的相互作用;同时结合生物信息学和蛋白质组学的方法,最终会使开发大规模、高通量的信号转导元件成为可能。
CRKs 生物学功能的研究。对CRKs的生物学功能了解得还不够深入。随着生物技术的不断发展和转基因技术的成熟,对某些特定CRKs基因过表达或敲除,从而进一步解析其所介导的不同信号传导途径,在调控植物生命过程中的精细作用。
CRKs 介导的信号转导途径研究。信号的识别、传递和相关基因的表达在植物体内形成了复杂的网络。CRKs 在信号转导途经中的位置如何,其上游元件及下游元件分别是什么,CRKs与上下游元件之间的作用机制,信号传递是如何进行的,以及信号转导网络中未知的元件如何鉴定等问题还有待于进一步研究。
将CRKs应用于植物基因工程以改良物种。应用基因工程手段,将有应用价值的CRKs转入植物体内,以改良品种造福人类。另外,可通过合成植物信号配基分子调控植物相关的反应,使植物抵抗逆境的能力更强。总之,随着生物信息学的发展,可以更为精确地预测CRKs的结构,为CRKs结构的预测及其亲缘关系的分析提供了有力的工具;分子生物学和生物化学及其他传统生物学研究手段的综合运用也将会更深入、精确地诠释CRKs在不同信号转导路径中的作用,从而阐明植物CRKs相关的分子机制。
| [1] | Chen K, Fan B, Du L, et al. Activation of hypersensitive cell death by pathogen-induced receptor-like protein kinases from Arabidopsis. Plant Mol Biol , 2004, 56 (2) : 271–283. DOI:10.1007/s11103-004-3381-2 |
| [2] | Chen Z. A superfamily of proteins with novel cysteine-rich repeats. Plant Physiol , 2001, 126 (2) : 473–476. DOI:10.1104/pp.126.2.473 |
| [3] | Yang K, Rong W, Qi L, et al. Isolation and characterization of a novel wheat cysteine-rich receptor-like kinase gene induced by Rhizoctonia cerealis. Scientific Reports , 2013, 3 : 3021. |
| [4] | Wrzaczek M, Brosche M, Salojarvi J, et al. Transcriptional regulation of the CRK/DUF26 group of Receptor-like protein kinases by ozone and plant hormones in Arabidopsis. BMC Plant Biology , 2010, 10 : 95. DOI:10.1186/1471-2229-10-95 |
| [5] | Nam KH, Li J. BRI1/BAK1, a receptor kinase pair mediating brassinosteroid signaling. Cell , 2002, 110 (2) : 203–212. DOI:10.1016/S0092-8674(02)00814-0 |
| [6] | Cbgowda R, Michael J, Fabian M, et al. Regulation of basal resistance by a powdery mildew-induced cysteine-rich receptor-like protein kinase in barley. Molecular Plant Pathology , 2012, 13 (2) : 135–147. DOI:10.1111/mpp.2012.13.issue-2 |
| [7] | Yeh YH, Chang YH, Huang PY, et al. Enhanced Arabidopsis pattern-triggered immunity by overexpression of cysteine-rich receptor-like kinases. Frontiers in Plant Science , 2015, 6 : 322. |
| [8] | Zhang X, Han X, Shi R, et al. Arabidopsis cysteine-rich receptor-like kinase 45 positively regulates disease resistance to Pseudomonas syringae. Plant Physiol Biochem , 2013, 73 (3) : 83–91. |
| [9] | Melotto M, Underwood W, Koczan J. Plant stomata function in innate immunity against bacterial in vasion. Cell , 2006, 12 (6) : 969–980. |
| [10] | Montesano M, Köiv V, Mäe A, et al. Novel receptor-like protein ki-nases induced by Erwinia carotovora and short oligogalacturonides in potato. Molecular Plant Pathology , 2001, 2 (6) : 339–346. DOI:10.1046/j.1464-6722.2001.00083.x |
| [11] | Czernic P, Visser B, Sun W, et al. Characterization of an Arabidopsis thaliana receptorlike protein kinase gene activated by oxidative stress and pathogen attack. Plant J , 1999, 18 (3) : 321–327. DOI:10.1046/j.1365-313X.1999.00447.x |
| [12] | Chen K, Du L, Chen Z. Sensitation of defense responses and activa-tion of programmed cell death by a pathogen-induced receptor-like protein kinase in Arabidopsis. Plant Mol Biol , 2003, 53 : 61–74. DOI:10.1023/B:PLAN.0000009265.72567.58 |
| [13] | Ohtake Y, Takahashi T, Komeda Y, et al. Salicylic acid induces the expression of a number of receptor-like kinase genes in Arabidopsis thaliana. Plant Cell Physiol , 2000, 41 : 1038–1044. DOI:10.1093/pcp/pcd028 |
| [14] | Burdiak P, Rusaczonek A, Witon? D, et al. Cysteine-rich receptor-like kinase CRK5 as a regulator of growth, development, and ultraviolet radiation responses in Arabidopsis thaliana. Journal of Experimental Botany , 2015, 66 (11) : 3325–3337. DOI:10.1093/jxb/erv143 |
| [15] | Biswa R, Surabhi R, Shahina B, et al. Overexpression of CRK13, an Arabidopsis cysteine-rich receptor-like kinase, results in enhanced resistance to Pseudomonas syringae. The Plant Journal , 2007, 50 (3) : 488–499. DOI:10.1111/j.1365-313X.2007.03064.x |
| [16] | Idanheimo N, Gauthier A, Salojarvi J, et al. The Arabidopsis thaliana cysteine-richreceptor-likekinases CRK6 and CRK7 protect against apoplastic oxidative stress. Biochem Biophys Res , 2014, 44 (5) : 457–462. |
| [17] | Ederli L, Madeo L, Calderini O, et al. The Arabidopsis thaliana cysteine-rich receptor-like kinase CRK20 modulates host responses to Pseudomonas syringae pv. tomato DC3000 infection.. Journal of Plant Physiology , 2011, 168 (15) : 1784–1794. DOI:10.1016/j.jplph.2011.05.018 |
| [18] | Yasuhiro K, Jan S, Paul D, et al. Direct regulation of the NADPH Oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity. Molecular Cell , 2014, 54 : 43–55. DOI:10.1016/j.molcel.2014.02.021 |
| [19] | Asai T, Tena G, Plotnikova J, et al. MAP kinase signaling cascade in Arabidopsis innate immunity. Nature , 2002, 41 (5) : 977–983. |
| [20] | Gómez-Gómez L, Felix G, Boller T. A single locus determines sensitivity to bacterial flagellinin Arabidopsis thaliana. PlantJ , 1999, 18 : 277–284. DOI:10.1046/j.1365-313X.1999.00451.x |
| [21] | Zeng W, Melotto M, He S. Plant stomata:a checkpoint of host immunity and pathogen virulence. Curr Opin Biotechnol , 2010, 21 : 599–603. DOI:10.1016/j.copbio.2010.05.006 |
| [22] | Lange J, Xie Z, Broughton WJ, et al. A gene encoding a receptor-like protein kinase in the roots of common bean is differentially regulated in response to pathogens, symbionts and nodulation factors. Plant Science , 1999, 14 (2) : 133–145. |
| [23] | 杨坤. 小麦应答禾谷丝核菌的3个激酶基因的分离及功能分析[D]. 北京:中国农业科学院, 2014. http://cdmd.cnki.com.cn/article/cdmd-82101-1014326428.htm |
| [24] | 张明伟. 水稻抗白叶枯病相关基因OsCRK1的鉴定和克隆[D]. 北京:中国农业科学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-82101-1015378772.htm |
| [25] | 张秀娟. 拟南芥类受体激酶CRK45对生物和非生物胁迫的响应[D]. 呼和浩特:内蒙古农业大学, 2013. |
| [26] | Tanaka H, Osakabe Y, Katsura S, et al. Abiotic stress-inducible receptor-like kinases negatively control ABA signaling in Arabidopsis. The Plant Journal , 2012, 70 (4) : 599–613. DOI:10.1111/tpj.2012.70.issue-4 |
| [27] | Zipfel C, Felix G. Plants and animals:a different taste for microb-es?. Current Opinion in Plant Biology , 2005, 8 : 353–360. DOI:10.1016/j.pbi.2005.05.004 |
| [28] | Nemhauser JL, Hong F, Chory J. Different plant hormones regulate similar processes through largely nonoverlapping transcriptional responses. Cell , 2006, 126 (3) : 467–475. DOI:10.1016/j.cell.2006.05.050 |
| [29] | Woong B, So Y, Sang K, et al. Identification of a pollen-specific gene, SlCRK1(RFK2)in tomato. Genes & Genomics , 2014, 36 (3) : 303–311. |
| [30] | 曹玉婷, 丁艳菲, 朱诚. 类受体蛋白激酶与植物非生物胁迫应答. 中国生物化学与分子生物学报 , 2014 (3) : 241–247. |