近些年,葡萄因具有较高的营养价值和经济价值,其产业发展迅速,其中鲜食葡萄产量居世界第一位,酿酒葡萄居世界第五位。我国很多地区,如山东的烟台和青岛、新疆玛纳斯、宁夏贺兰等,均具有种植葡萄得天独厚的自然条件,但日趋严重的干旱、土壤盐渍化、冷害等非生物胁迫逆境严重限制了这些地区的葡萄产业发展。在自然进化和人工杂交驯化育种过程中,为了个体的生长发育,也为了后代稳定的延续,筛选出许多具有多种胁迫耐性的品种来抵抗和适应其生长的逆境。如中国东北的野生山葡萄(Vitis amurensis Rupr.)具有较强的耐寒性,能耐受零下40℃-50℃的严寒,且冬季无需埋土就可以过冬[1]。北美葡萄种群河岸葡萄(Vitis riparia Michaux)和沙地葡萄(Vitis rupestris Scheele)具有较好的抗旱性。1616C、贝达等砧木品种具有很好的耐盐性。这些抗性品种自身在结构、生理和分子等水平上表现出对胁迫的耐受性和适应性,如诱导胁迫耐性基因或者胁迫应答基因的表达,这种诱导又来源于对逆境因子的感知、一系列信号分子的转导和信号通路的传递[2]。转录因子能与不同的非生物胁迫相关的响应基因的启动子相互结合,从而转录调控基因表达[3],诱导产生相应的生理和分子调节机制以应对胁迫。因此,转录因子在植物应对非生物胁迫中发挥的作用受到越来越多的关注。
WRKY转录因子是植物体内一类成员庞大的基因家族,在参与调控植物抗旱、耐盐、耐冷等非生物胁迫中的功能和作用机制受到科学研究者们越来越多的关注[4]。1994年Ishiguro等[5]从甘薯中分离得到第一个WRKY基因SPF1,Rushton等[6]从欧芹中分离得到WRKY1、WRKY2和WRKY3,发现这些基因N-端都含有7个保守的氨基酸残基WRKYGQR,因此将此类转录因子命名为WRKY。研究表明,七肽序列和锌指结构基序对于WRKY转录因子结合下游基因启动子上的W-box(TTGAC)来说是至关重要的[4]。WRKY转录因子根据WRKY结构域的数量和锌指结构基序的特征分为3个亚家族。第一个亚家族有2个WRKY结构域;第二个亚家族含有和第一个亚家族类似的Cys2-His2模式的锌指基序C-X4-5-C-X22-23-H-X1-H,同时含有一个WRKY结构域如PcWRKY3、AfABF2;第三亚家族含有一个不同于上述两个亚家族的Cys2-His/Cys Cys2-His2模式的锌指基序C-X7-C-X23-H-X1-C,并且有一个WRKY结构域[7, 8]。目前研究发现WRKY家族成员在模式植物拟南芥中有74个[9],黄瓜中有55个[10],水稻中有109个[11],高粱中有68个[12],大豆中有197个[13],葡萄中有59个[14]。
本文将主要从葡萄WRKY家族蛋白介绍、葡萄WRKY转录因子分别在干旱、盐、冷胁迫中的功能研究进展和耐逆机制探讨等方面进行阐述,旨在解析WRKY转录因子调控葡萄应对非生物胁迫的分子机制,为葡萄耐逆境培育提供理论指导。
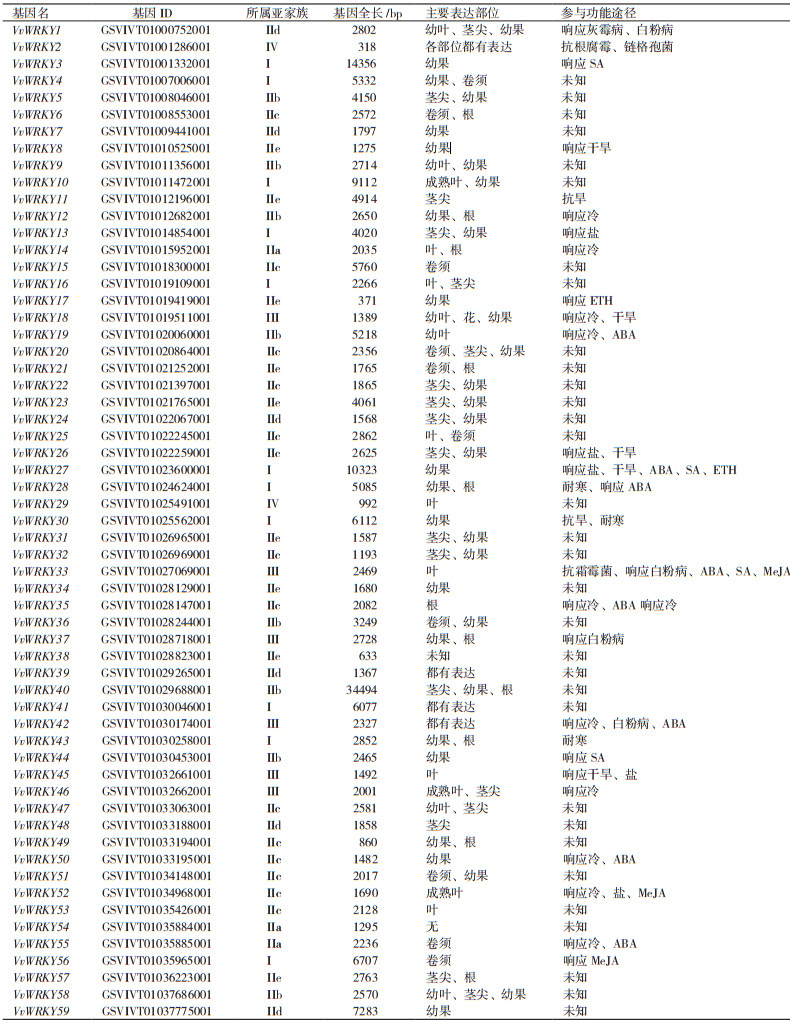
1 葡萄WRKY家族蛋白的种类和研究进展人们对葡萄WRKY家族基因的亚家族分类、主要表达部位和参与的功能等进行研究(表 1)。最早对葡萄WRKY家族蛋白进行生物信息学分析来自于北京大学生命科学学院罗静初研究团队和Velasco等[15, 16],他们通过构建和更新植物转录因子数据库PlantTFDB 2.0,从49个物种中挖掘了53 319个转录因子基因家族,并对所有家族转录因子的基本信息、结构特征、进化分类和表达模式等进行了详细注释,其数据库收集到葡萄的WRKY转录因子有98个成员。2010年辽宁师范大学侯和胜研究团队[17]在全基因组测序的基础上,对葡萄基因组的WRKY家族蛋白进行分析,同时去掉冗余序列,得到56条葡萄WRKY蛋白,通过电子表达谱分析表明葡萄WRKY基因在很多组织中,如芽、培养的细胞、花瓣、果实、花序、叶、花梗、根和莲中都有表达,并且不同的葡萄基因表达部位不同,表达量也各不相同。2014年河南农业大学冯建灿研究团队[18]分析发现葡萄中有80个WRKY,其中16个参与水杨酸SA介导的葡萄白腐病抵御过程。2014年中科院植物研究所李绍华研究团队[19]以欧亚种葡萄(Vitis vinifera L.)‘黑比诺’基因组序列为基础,根据拟南芥中基因编码的氨基酸序列和同源比对,重新对WRKY基因家族进行鉴定得到59个WRKY家族成员,这些成员不均匀地分布在葡萄染色体上。根据结构域和系统进化分析将这59个WRKY蛋白分成了4组,第Ⅰ组有12个成员,均含有两个WRKY结构域;第Ⅱ组有39个成员,又分出5个亚群;第Ⅲ组有6个成员,含有一个WRKY结构域,且锌指结构以HXC结尾;第Ⅳ组成员最少,只有2个,缺少完整的锌指结构。另外,他们对欧亚种葡萄‘玫瑰香’(V. vinifera cv ‘Muscat Hamburg’)的幼叶、成熟叶、卷须、茎尖、幼果、成果和根共7种组织中的WRKY家族基因进行了转录水平的检测,发现WRKY家族成员广泛参与多种生物和非生物胁迫应答过程,表明WRKY基因可能在葡萄整个生命周期以及各种胁迫应答过程都起着重要作用。同年,西北农林科技大学王西平研究团队[20]也对葡萄WRKY家族蛋白进行了系统分析,确定出59个WRKY成员,并将其分成了3组。转录表达特性分析发现有4个WRKY基因在葡萄根或叶中有大量的表达,有55个WRKY不同水平上在至少响应一种非生物胁迫,有38个响应霜霉病侵染,大部分基因在脱落酸(abscisic acid,ABA)和水杨酸(salicylic acid,SA)的处理后下调表达。
目前葡萄中对WRKY家族的研究主要停留在基因挖掘和转录表达模式分析上,克隆和功能分析的VvWRKY基因仅有14个,且对其功能研究主要集中在葡萄生长发育和生物胁迫方面。如Terrier等[21]2005年进行了葡萄浆果生长过程基因表达的研究,初步推测转录因子WRKY家族在这其中发挥重要作用。刘新研究团队[22]发现WRKY71参与了硫化氢(hydrogen sulfide,H2S)和过氧化氢(hydrogen peroxide,H2O2)介导的葡萄抗霜霉病过程。异源表达VpWRKY3则能提高烟草对茄科雷尔式菌抵抗力[23],而葡萄WRKY在非生物胁迫应答方面的功能研究仍比较少。
2 葡萄WRKY家族蛋白与干旱胁迫植物受到干旱胁迫时,其细胞膜系统通常最先受到伤害,体内活性氧代谢失衡,胞内物质如电解质、渗透调节物质外渗,导致细胞失水,最终导致植物脱水死亡。WRKY家族蛋白参与植物抗旱的分子机制主要有:(1)作为转录因子通过调控干旱胁迫应答基因、植物抗旱信号通路基因和自身基因的表达来启动植物对干旱胁迫的应答。如水稻OsWRKY47能够与钙结合蛋白CaBP和富含半胱氨酸分泌蛋白CRRSP基因启动子区的顺式作用元件(G/T)TTGACT结合来启动干旱胁迫信号传递通路,正向调控水稻抗旱[24];金桔的FcWRKY70通过与精氨酸脱氢酶FcADC启动子区的W-Box结合,以提高植物抗旱性[25]。(2)与其他蛋白互作调控自身活性来控制干旱胁迫应答网络。水稻OsWRKY30能与MAPKs互作并被其磷酸化,参与调控抗旱过程[26]。(3)通过调控ABA信号途径参与抗旱。如拟南芥AtWRKY1能够与ABA信号通路中基因MYB2、ABCG40、DREB1A和ABI5的启动子W-Box结合调控气孔运动,从而抗旱[27];菊花中的CmWRKY1通过下调PP2C、ABI1和ABI2,上调PYL2、SnRK2.2、ABF4、MYB2、RAB18和DREB1A这些ABA信号通路中的基因,参与菊花耐旱[28]。
葡萄WRKY家族蛋白参与对干旱的响应,如葡萄辅酶因子蛋白VvVQ能与多个VvWRKYs结合响应干旱胁迫[25, 29];2011年Liu等[30]从‘北峰’葡萄品种中克隆得到一个大小为1 255 bp的WRKY11转录因子VvWRKY11,能够与AtRD29A和AtRD29B启动子的W-box结合,从而提高拟南芥抵御甘露醇诱导的干旱胁迫能力。2013年刘新研究团队[31]从‘左优红’葡萄品种中克隆到两个受干旱胁迫强烈诱导表达基因VvWRKY18和VvWRKY45,其中VvWRKY18大小为954 bp,属于第Ⅱ类WRKY家族蛋白,在花、花芽和叶中的表达量较高;VvWRKY45大小为2 514 bp,启动子含有响应ABA、赤霉素(gibberellic acid,GA)、茉莉酸(jasmonate acid,JA)顺式作用元件,在干旱胁迫6 h时表达量上调10倍。2016年本研究室又从抗性葡萄品种‘Vidal Blanc’(Vidal256)中克隆到一个大小为1 095 bp的多种逆境胁迫诱导表达基因VvWRKY30,该基因的表达能够增强大肠杆菌对干旱的耐受性,且异源表达拟南芥植株发现VvWRKY30能通过减少气孔开度,减少地上部分的水分散失,同时提高渗透调节物质脯氨酸(proline,Pro)和可溶性糖含量维持自身的渗透平衡;通过提高超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)的活性来清除细胞内的活性氧,提高植株的耐旱性[32]。
3 葡萄WRKY家族蛋白与盐胁迫土壤盐渍化影响植物的生长和发育。盐胁迫下,原有的离子平衡被打破,高浓度的Na+会破坏细胞膜的完整性,从而影响细胞膜的正常生理功能[33]。其次,由于外界环境中盐分浓度过高,土壤的水势下降,造成植物吸水困难,甚至能引起植物体内水分的外渗,导致水分的亏损,从而对植物形成渗透胁迫[34]。植物通过一系列的机制来应对盐胁迫,如调节离子平衡、合成渗透调节物质、激活抗氧化酶系统等。WRKY家族蛋白通常以多个成员一起协同调控的方式参与这些途径响应盐胁迫。如棉花中有109个WRKY,其中有28个响应盐胁迫,且GhWRKY17、GhWRKY41和GhWRKY104通过降低丙二醛含量、提高抗氧化酶活性来提高植物的耐盐性[35, 36];利用微阵列分析发现在拟南芥的根部有18个WRKY受到NaCl诱导[37],其中过表达AtWRK-Y25和AtWRKY33后能提高拟南芥的耐盐性[38]。
目前对葡萄WRKY家族蛋白参与耐盐胁迫的研究比较少,主要集中在西北农林科技大学王跃进团队和青岛农业大学刘新团队。王跃进等[39]从中国野生葡萄品种‘Baihe-35-1’中克隆得到3个WRKY基因,分别命名为VpWRKY1、VpWRKY2和VpWRKY3,大小分别为1 157 bp、1 607 bp和1 280 bp。其中VpWRKY1和VpWRKY2的过表达拟南芥植株具有较好抗盐性,VpWRKY3能提高转基因烟草的耐盐性[23]。刘新等从‘左优红’葡萄品种中筛选到VvWRKY13、VvWRKY18和VvWRKY45,从‘Vidal Blanc’葡萄品种中筛选到VvWRKY30和VvWRKY54都能受盐胁迫大量诱导表达[31, 40]。其中VvWRKY30的过量表达能够增强大肠杆菌对盐的耐受性;盐胁迫下,VvWRKY30异源表达拟南芥通过提高脯氨酸和可溶性糖含量、抗氧化酶如SOD、POD和CAT的活性增强其耐盐性[32]。另外,中国农业大学卢江研究团队[41]从葡萄品种‘Noble’中克隆得到MrWRKY30,其基因序列与刘新研究室克隆得到的VvWRKY30相似性为47.3%。MrWRKY30在拟南芥中的超量表达通过ROS途径提高了植物对盐胁迫的敏感性。
4 葡萄WRKY家族蛋白与冷胁迫植物体内WRKY家族蛋白抗寒分子机制的研究主要是通过ABA信号转导途径的双重抑制机制调控对低温的响应。如茶树中有50个WRKY家族基因,大部分都受冷胁迫诱导,其中CsWRKY2通过调控ABA信号通路参与植物抗冷[42]。目前葡萄响应冷胁迫的分子机制还不清楚,主要通过杂交育种和越冬埋土技术来提高植物的抗寒性,但该方法耗时费力,无法满足目前葡萄产业需求。有报道,WRKY家族蛋白在植物耐冷中发挥重要作用。2014年,李绍华研究团队完成了欧亚种葡萄‘玫瑰香’(V. vinifera cv ‘Muscat Hamburg’)和山葡萄(V. amurensis Rupr.)整个WRKY家族成员在冷胁迫下的表达变化分析和比较研究,获得15个冷胁迫相关的WRKY基因,其中过表达WRKY28和WRKY43的转基因植株耐寒能力增加[19, 43]。卢江团队[41]从葡萄品种‘Noble’中克隆的MrWRKY30通过诱导拟南芥抗寒基因CBF1、CBF3、COR47和ICE1的表达,增强了转基因拟南芥的耐寒性。此外,从中国野生葡萄中克隆得到的VpWRKY1和VpWRKY2过表达拟南芥植株具有较好抗冷性[39]。
5 展望干旱、盐渍和低温等非生物胁迫是限制葡萄产业发展的重要问题,探究葡萄在非生物胁迫条件下的应答机理,对于筛选和培育抗性优良品种,提高葡萄产量具有重要的理论意义。植物对逆境胁迫的响应是一个复杂的信号传导过程,包括胁迫信号的感知、信号的转导、不同的生理和代谢反应的激活。作为植物最大的转录因子成员之一的WRKY家族,它们在植物应答非生物胁迫中发挥着至关重要的作用,是逆境胁迫信号转导通路中控制基因表达的关键节点[44]。WRKY转录因子通常与其他蛋白或者顺式作用元件结合而发挥其功能。目前的研究发现WRKY能够与MAPKs、CDPKs等蛋白酶结合,从而激活或者抑制其自身的活性,进而调控与胁迫相关基因的启动子区W-Box的结合,来参与植物对非生物胁迫的应答。另外,不同的激素如SA、ABA等及气体信号物质一氧化氮(nitric oxide,NO)、H2S、H2O2均可作为信号分子参与植物应答逆境胁迫的过程。如干旱、盐和冷胁迫都能启动ABA信号通路,响应并传递胁迫信号。有研究表明,ABA诱导表达的基因参与非生物胁迫应答也依赖于MAPKs、CDPKs等的活性。因此,对于WRKY家族蛋白参与葡萄耐逆的分子机制研究可以从分析葡萄WRKY结合的伴侣蛋白、调控的下游基因、协同的信号分子通路等方面着手,综合探究葡萄WRKY抗逆的调控网络。此外,近年来WRKY家族蛋白在基因转录过程的负调控作用也得到了广泛关注,如水稻WRKY13作为转录抑制子,结合并抑制下游干旱响应基因SNAC1的转录,从而使转基因水稻表现出干旱敏感症状[39];拟南芥WRKY70在防御反应中通过激活水杨酸响应基因,抑制茉莉酸响应基因,从而平衡互相拮抗的信号通路[39];但是目前尚未有葡萄中发挥负调控作用相关WRKY蛋白的报道,这可能为进一步丰富并完善葡萄WRKY抗逆调控网络提供一定思路。
作为功能强大的基因家族,同一个WRKY转录因子往往参与多种抗逆过程。如从葡萄品种‘Noble’中克隆的MrWRKY30即增强了转基因拟南芥的耐寒性,同时提高了转基因南芥对霜霉菌的抗性[41];从‘Vidal Blanc’葡萄品种中筛选到的VvWRKY30提高了植物的耐盐和耐旱能力[32];从野生葡萄中克隆的VpWRKY2同时提高了植物对盐胁迫、冷胁迫和霜霉病害的抗性[39]。通过基因工程手段将这些WRKY基因导入葡萄,培育和筛选出同时具有多种胁迫耐受性的新品种,对推动葡萄产业经济的发展具有重要的理论及实践意义,同时利用生物措施改良土地,对于改善我国土地生态系统和提高土地资源利用率具有重要意义。
| [1] | 张文娥, 王飞, 潘学军. 葡萄属12个种45份种质资源抗寒性综合评价. 中国南方果树 , 2009 (3) : 17–19. |
| [2] | Chinnusamy V, Schumaker K, Zhu JK. Molecular genetic perspectives on cross-talk and specificity in abiotic stress signalling in plants. J Exp Bot , 2004, 55 (395) : 225–236. |
| [3] | Agarwal PK, Agarwal P, Reddy MK, et al. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants. Plant Cell Rep , 2006, 25 (12) : 1263–1274. DOI:10.1007/s00299-006-0204-8 |
| [4] | Eulgem T, Rushton PJ, Robatzek S, et al. The WRKY superfamily of plant transcription factors. Trends Plant Sci , 2000, 5 (5) : 199–206. DOI:10.1016/S1360-1385(00)01600-9 |
| [5] | Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and beta-amylase from sweet potato. Mol Gen Genet , 1994, 244 (6) : 563–571. |
| [6] | Rushton PJ, Torres JT, Parniske M, et al. Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes. EMBO J , 1996, 15 (20) : 5690–5700. |
| [7] | Bakshi M, Oelmuller R. WRKY transcription factors: Jack of many trades in plants. Plant Signal Behav , 2014, 9 (2) : e27700. DOI:10.4161/psb.27700 |
| [8] | Wang Y, Feng L, Zhu Y, et al. Comparative genomic analysis of the WRKY Ⅲ gene family in populus, grape, Arabidopsis and rice. Biol Direct , 2015, 10 : 48. DOI:10.1186/s13062-015-0076-3 |
| [9] | Eulgem T, Somssich IE. Networks of WRKY transcription factors in defense signaling. Curr Opin Plant Biol , 2007, 10 (4) : 366–371. DOI:10.1016/j.pbi.2007.04.020 |
| [10] | Ling J, Jiang W, Zhang Y, et al. Genome-wide analysis of WRKY gene family in Cucumis sativus. BMC Genomics , 2011, 12 : 471. DOI:10.1186/1471-2164-12-471 |
| [11] | Zhang Y, Wang L. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants. BMC Evol Biol , 2005, 5 : 1. DOI:10.1186/1471-2148-5-1 |
| [12] | Pandey SP, Somssich IE. The role of WRKY transcription factors in plant immunity. Plant Physiol , 2009, 150 (4) : 1648–1655. DOI:10.1104/pp.109.138990 |
| [13] | Schmutz J, Cannon SB, Schlueter J, et al. Genome sequence of the palaeopolyploid soybean. Nature , 2010, 463 (7278) : 178–183. DOI:10.1038/nature08670 |
| [14] | Wang M, Vannozzi A, Wang G, et al. Genome and transcriptome analysis of the grapevine(Vitis vinifera L.)WRKY gene family. Hortic Res , 2014, 1 : 14016. DOI:10.1038/hortres.2014.16 |
| [15] | Velasco R, Zharkikh A, Troggio M, et al. A high quality draft consensus sequence of the genome of a heterozygous grapevine variety. PLoS One , 2007, 2 (12) : e1326. DOI:10.1371/journal.pone.0001326 |
| [16] | Zhang H, Jin J, Tang L, et al. PlantTFDB 2. 0: update and improvement of the comprehensive plant transcription factor database. Nucleic Acids Res , 2011, 39 (Database issue) : D1114–D1117. |
| [17] | 贾翠玲.葡萄WRKY基因超家族的进化分析[D].大连:辽宁师范大学, 2010. |
| [18] | Zhang Y, Feng JC. Identification and characterization of the grape WRKY family. BioMed Research International , 2014, 2014 : 1–14. |
| [19] | Xin H, Zhu W, Wang L, et al. Genome wide transcriptional profile analysis of Vitis amurensis and Vitis vinifera in response to cold stress. PLoS One , 2013, 8 (3) : e58740. DOI:10.1371/journal.pone.0058740 |
| [20] | Guo C, Guo R, Xu X, et al. Evolution and expression analysis of the grape(Vitis vinifera L.)WRKY gene family. J Exp Bot , 2014, 65 (6) : 1513–1528. DOI:10.1093/jxb/eru007 |
| [21] | Terrier N, Glissant D, Grimplet JM, et al. Isogene specific oligo arrays reveal multifaceted changes in gene expression during grape berry(Vitis vinifera L.)development. Planta , 2005, 222 (5) : 832–847. DOI:10.1007/s00425-005-0017-y |
| [22] | 侯丽霞, 王文杰, 刘新. 葡萄VvWRKY71转录因子的生物信息学分析. 中国农学通报 , 2013 (31) : 123–128. |
| [23] | Zhu Z, Shi J, Cao J, et al. VpWRKY3, a biotic and abiotic stress-related transcription factor from the Chinese wild Vitis pseudoreticulata. Plant Cell Rep , 2012, 31 (11) : 2109–2120. DOI:10.1007/s00299-012-1321-1 |
| [24] | Raineri J, Wang S, Peleg Z, et al. The rice transcription factor OsWRKY47 is a positive regulator of the response to water deficit stress. Plant Mol Biol , 2015, 88 (4-5) : 401–413. DOI:10.1007/s11103-015-0329-7 |
| [25] | Gong X, Zhang J, Hu J, et al. FcWRKY70, a WRKY protein of Fortunella crassifolia, functions in drought tolerance and modulates putrescine synthesis by regulating arginine decarboxylase gene. Plant Cell Environ , 2015, 38 (11) : 2248–2262. DOI:10.1111/pce.12539 |
| [26] | Shen H, Liu C, Zhang Y, et al. OsWRKY30 is activated by MAP kinases to confer drought tolerance in rice. Plant Mol Biol , 2012, 80 (3) : 241–253. DOI:10.1007/s11103-012-9941-y |
| [27] | Qiao Z, Li C, Zhang W. WRKY1 regulates stomatal movement in drought-stressed Arabidopsis thaliana. Plant Mol Biol , 2016, 91 (1-2) : 53–65. DOI:10.1007/s11103-016-0441-3 |
| [28] | Fan Q, Song A, Jiang J, et al. CmWRKY1 enhances the dehydration tolerance of Chrysanthemum through the regulation of ABA-associated genes. PLoS One , 2016, 11 (3) : e150572. |
| [29] | Wang M, Vannozzi A, Wang G, et al. A comprehensive survey of the grapevine VQ gene family and its transcriptional correlation with WRKY proteins. Front Plant Sci , 2015, 6 : 417. |
| [30] | Liu H, Yang W, Liu D, et al. Ectopic expression of a grapevine transcription factor VvWRKY11 contributes to osmotic stress tolerance in Arabidopsis. Mol Biol Rep , 2011, 38 (1) : 417–427. DOI:10.1007/s11033-010-0124-0 |
| [31] | 侯丽霞, 王文杰, 郭秀萍, 等. 三个葡萄WRKYs基因的克隆及表达特性分析. 植物生理学报 , 2013 (3) : 289–296. |
| [32] | 肖培连.葡萄VvWRKY30在应答渗透胁迫中的作用机制研究[D].青岛:青岛农业大学, 2016. |
| [33] | Oh DH, Lee SY, Bressan RA, et al. Intracellular consequences of SOS1 deficiency during salt stress. J Exp Bot , 2010, 61 (4) : 1205–1213. DOI:10.1093/jxb/erp391 |
| [34] | 付畅, 孙玉刚, 傅桂荣. 盐生植物耐盐分子机制的研究进展. 生物技术通报 , 2013 (1) : 1–7. |
| [35] | Chu X, Wang C, Chen X, et al. The cotton WRKY gene GhWRKY41 positively regulates salt and drought stress tolerance in transgenic Nicotiana benthamiana. PLoS One , 2015, 10 (11) : e143022. |
| [36] | Fan X, Guo Q, Xu P, et al. Transcriptome-wide identification of salt-responsive members of the WRKY gene family in Gossypium aridum. PLoS ONE , 2015, 10 (5) : e126148. |
| [37] | Jiang Y, Deyholos MK. Comprehensive transcriptional profiling of NaCl-stressed Arabidopsis roots reveals novel classes of responsive genes. BMC Plant Biol , 2006, 6 : 25. DOI:10.1186/1471-2229-6-25 |
| [38] | Jiang Y, Deyholos MK. Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses. Plant Mol Biol , 2009, 69 (1-2) : 91–105. DOI:10.1007/s11103-008-9408-3 |
| [39] | Li H, Xu Y, Xiao Y, et al. Expression and functional analysis of two genes encoding transcription factors, VpWRKY1 and VpWRKY2, isolated from Chinese wild Vitis pseudoreticulata. Planta , 2010, 232 (6) : 1325–1337. DOI:10.1007/s00425-010-1258-y |
| [40] | 肖培连, 冯睿杰, 侯丽霞, 等. 葡萄WRKY18基因的克隆及表达特性分析. 植物生理学报 , 2015 (3) : 391–398. |
| [41] | Jiang W, Wu J, Zhang Y, et al. Isolation of a WRKY30 gene from Muscadinia rotundifolia(Michx)and validation of its function under biotic and abiotic stresses. Protoplasma , 2015, 252 (5) : 1361–1374. DOI:10.1007/s00709-015-0769-6 |
| [42] | Wu Z, Li X, Liu Z, et al. Transcriptome-wide identification of Camellia sinensis WRKY transcription factors in response to temperature stress. Mol Genet Genomics , 2016, 291 (1) : 255–269. DOI:10.1007/s00438-015-1107-6 |
| [43] | Wang L, Zhu W, Fang L, et al. Genome-wide identification of WRKY family genes and their response to cold stress in Vitis vinifera. BMC Plant Biol , 2014, 14 : 103. DOI:10.1186/1471-2229-14-103 |
| [44] | 颜君, 郭兴启, 曹学成. WRKY转录因子的基因组水平研究现状. 生物技术通报 , 2015, 31 (11) : 9–17. |