2. 信阳师范学院,信阳 464000;
3. 云南大学,昆明 650091;
4. 云南省农业科学院生物技术与种质资源研究所,昆明 650223
2. Xinyang Normal University, Xinyang 464000;
3. Yunnan University, Kunming 650091;
4. Biotechnology & Genetic Resources Institute, Yunan Academy of Agriculture Sciences, Kunming 650223
在植物的抗病信号传导途径中,水杨酸(SA)介导的抗病信号传导途径和茉莉酸(JA)介导的抗病信号传导途径是研究得比较深入的两条途径。SA是植物体内自我合成的小分子酚类化合物,在植物生长发育过程中主要起调节生理生化的作用,是植物抗病信号传导过程中极为重要的内源抗病信号分子[1]。研究表明,当植物体被病原菌侵染后,植物体内的SA含量水平升高,与侵染部位靶细胞的SA受体结合形成复合物,该复合物将信息从胞外传递至胞内第二信使,第二信使再经过一系列的信号转导引起过敏反应(hypersensitive respones,HR),最终使植株产生局部获得性抗性(local acquired resistance,LAR);随后SA由感染部位通过韧皮部运输到整个植株的各个部位,使整个植株产生系统获得性抗性(systemic acquired resistance,SAR)[2, 3]。茉莉酸(JA)和茉莉酸甲酯(MeJA)是近几年研究发现的高等植物体内自我合成的内源生长调节物质,在植物体内起调节生长发育、抗病信号传导、参与防御反应等作用,如发芽、根的伸长、果实成熟、花粉发育和植株衰老等,因此近年来得到了广泛的关注[4]。Orozco-Cardenas等[5]在研究番茄植物对病原菌侵染后H2O2作为第二信使诱导防御基因表达的过程中发现,JA诱导基因的表达有先后顺序,较早表达的基因主要参与抗性信号的传导,较晚表达的基因主要参与植物的防御反应,H2O2在JA介导的信号传导途径可能作为第二信使。Wasternack等[6]研究番茄中JA对伤害的反应表明,茉莉酸类物质可以诱导花青素、芦丁等黄酮类物质的表达,从而植物UV-B的胁迫,说明JA的生物合成途径与植物防御系统的发生有密切关系。
SA途径和JA途径两条途径是交叉存在而非独立存在的,两者或相互抑制或相互协同,其中SA途径主要介导植物对致病性强的病原菌的抗病信号转导,而JA途径主要介导植物对致病性较弱的病原菌的抗病信号传递[7]。植物感染病原菌后,体内细胞分裂素和小GTP结合蛋白的含量会增加,它们可能起信号开关的作用;当细胞分裂素含量较低时,植物将初始信号传递给JA,诱导碱性相关蛋白基因表达,进一步启动相关抗病基因的表达;当细胞分裂素含量较高时,植物将伤信号传递给SA,诱导产生酸性相关蛋白基因表达,进一步启动相关抗病基因的表达[8]。目前虽然已证实植物对外界损伤会使SA途径和JA途径产生协同作用,但具体协同机制还不清楚,只是初步发现植物细胞分裂素在调控SA途径和JA途径的相互关系中起“信号转换开关”的作用[9]。
本实验比较研究疣粒野生稻胚性细胞和叶片细胞在受白叶枯病原菌处理胁迫后,其抗病信号物质水杨酸(SA)和茉莉酸(JA)的含量变化,及其抗白叶枯病相关基因ME207和ME281的表达情况,了解疣粒野生稻抗白叶枯病能力产生的时期,从而为揭示高抗-免疫白叶枯病机制提供科学依据。
1 材料与方法 1.1 材料云南景洪疣粒野生稻植株和愈伤组织。白叶枯病菌菌悬液。
1.2 方法 1.2.1 白叶枯病菌侵染疣粒野生稻的胚性细胞和叶片采用剪叶法对温室培养的疣粒野生稻植株叶片进行接菌,对照用无菌水进行剪叶;采用悬浮慢速震荡法对愈伤组织进行接菌,然后转移到MS继代培养基上培养,对照直接转移到MS继代培养基上培养。
1.2.2 疣粒野生稻胚性细胞和叶片的SA和JA含量的检测称取对照处理和白叶枯病菌处理24、48和72 h的愈伤组织和叶片0.1 g分别置于2.0 mL的离心管中,然后分别加入90 μL PBS缓冲液充分研磨后在漩涡振荡器上混成匀浆,3 000 r/min离心20 min,收集上清液,最后用上海江莱生物科技有限公司的SA酶联免疫分析试剂盒和JA酶联免疫分析试剂盒分别对处理的各时间点进行SA的定量检测。
1.2.3 疣粒野生稻胚性细胞和叶片的抗病基因半定量RT-PCR分析 1.2.3.1 抗病基因的引物设计用Primer Primer5.0软件,对2个疣粒野生稻中与抗白叶枯病相关的基因ME207基因和ME281基因设计RT-PCR的扩增引物,引物编号及其PCR扩增产物的长度见表 1。
称取对照处理和白叶枯病菌处理24、48和72 h的疣粒野生稻愈伤组织和叶片0.1 g分别置于1.5 mL的离心管中,然后用上海捷瑞生物工程有限公司的RnaExTM总RNA提取试剂盒分别提取总RNA。
1.2.3.3 cDNA第一链的合成以提取的不同时间点白叶枯病菌处理的愈伤组织和叶片的总RNA分别为模板,用北京天根生物技术有限公司的FastQuant cDNA第一链合成试剂盒合成cDNA第一链。
1.2.3.4 半定量RT-PCR检测抗病基因的表达量PCR反应体系:10×PCR Buffer(with Mg2+)2.5 µL;dNTPmixture(10 µmol/L)0.5 µL;primer1(10 µmol/L)1 µL;primer2(10 µmol/L)1 µL;Taq酶(5 U/ µL)0.5 µL;cDNA 1 µL;加ddH2O补足至25 µL。
PCR反应条件为:ME207基因:94℃ 3 min;94℃ 3 s,51℃ 30 s,72℃ 30 s,共40个循环;72℃ 10 min。ME281基因:94℃ 3 min;94℃ 3 s,59℃ 30 s,72℃ 30 s,共40个循环;72℃ 10 min。β-actin基因:94℃ 3 min;94℃ 3 s,52℃ 30 s,72℃ 30 s,共40个循环;72℃ 10 min。
用ME207基因RT-PCR引物、ME281基因RT-PCR引物和β-actin基因引物分别对对照和PXO99处理后24 h、48 h和72 h的疣粒野生稻愈伤组织和叶片的cDNA进行PCR扩增。PCR反应结束后,所有PCR产物均上样5 µL,用1.5%琼脂糖凝胶以120 V/cm电泳进行检测。
2 结果 2.1 疣粒野生稻胚性细胞和叶片SA含量检测正常情况下,胚性细胞和叶片细胞的内源SA含量分别为1 904.03 pmol/L和1 099.86 pmol/L;用PXO99胁迫处理后,胚性细胞和叶片细胞的内源SA含量均先升高在24 h达到最高,然后下降,但48-72 h内的含量都高于对照(图 1)。每个时间点的3次重复数据用SPSS软件(19.0版本)的Duncan2进行显著性分析,SA含量在胚性细胞和叶片细胞中的不同时间点含量差异显著(P < 0.05),说明PXO99胁迫处理后疣粒野生稻胚性细胞和叶片细胞中的内源SA含量变化均明显。
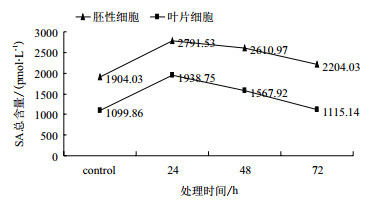
|
| 图 1 PXO99处理对胚性细胞和叶片的SA含量的影响 |
正常情况下,胚性细胞和叶片细胞的内源JA含量分别为1681.50 pmol/L和1249.28 pmol/L;用PXO99胁迫处理后,胚性细胞的内源JA含量先上升在24 h达到最高,后下降,且48-72 h内的含量都高于对照;叶片细胞的内源JA含量先上升在24 h达到最高,后下降,但48-72 h内的含量都低于对照(图 2)。每个时间点的3次重复数据用SPSS软件的Duncan2进行显著性分析,JA含量在胚性细胞和叶片细胞中的不同时间点含量差异不显著(P > 0.05),说明PXO99胁迫处理后疣粒野生稻胚性细胞和叶片细胞中的内源JA含量变化均不明显。
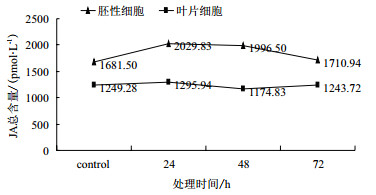
|
| 图 2 PXO99处理对胚性细胞和叶片细胞的JA含量的影响 |
提取的总RNA经紫外分光光度计测定各时间点总RNA OD260/OD280的比值均在1.86-2.02之间。琼脂糖凝胶电泳图(图 3)显示,叶片和愈伤组织的总RNA的28S RNA和18S RNA的条带明显、清晰、无杂带,且28S RNA:18S RNA的亮度接近2:1,说明用RnaExTM试剂盒所提取的总RNA质量较好、较完整,符合下一步RT-PCR的要求。
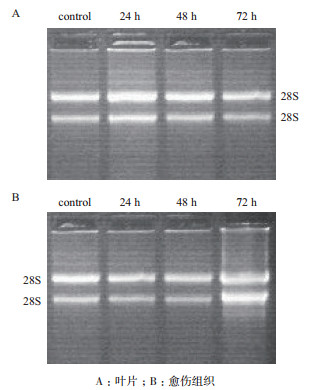
|
| 图 3 疣粒野生稻叶片(A)和愈伤组织总RNA电泳图(B) |
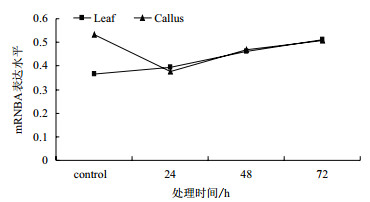
电泳结果(图 4)显示,ME207基因mRNA的表达量在愈伤组织和叶片胁迫处理后各时间点均有所表达,初步说明该基因在疣粒野生稻细胞特异化前后均是组成型表达基因而非诱导型表达基因。计算对照、24 h、48 h和72 h各处理时间点的ME207基因与β-actin基因的RT-PCR产物电泳条带光密度比值分别为0.364、0.395、0.462和0.513。该比值随着胁迫处理时间的增加而逐渐增大(图 5),说明叶片中的ME207基因在受到白叶枯病原菌胁迫后的表达量逐步增高;而愈伤组织的光密度比值分别为0.531、0.375、0.469和0.507,该比值在24 h时先下降,48 h后逐步升高,且72 h时的表达量较对照表达水平有所降低,说明愈伤组织中ME207基因在受到白叶枯病原菌胁迫后的表达量先下降后升高。进一步说明ME207基因是在疣粒野生稻细胞特异化前后均是组成型表达基因而非诱导型表达基因。
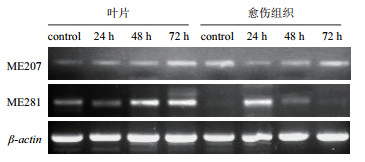
|
| 图 4 基于RT-PCR的差异表达基因在PXO99处理下的表达 |
|
| 图 5 ME207基因的mRNA的表达水平 |
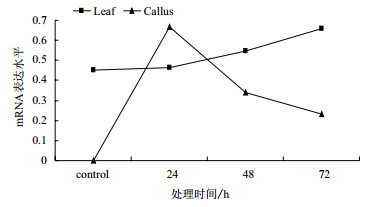
从电泳图(图 4)可看出,ME281基因mRNA的表达量在叶片胁迫处理前后各时间点均有所表达,而在愈伤组织中胁迫处理前无表达、胁迫处理后有表达,初步说明该基因在疣粒野生稻细胞特异化前是诱导型表达基因而非组成型表达基因,在细胞特异化后是组成型表达基因而非诱导型表达基因。计算对照、24 h、48 h和72 h各处理时间点的ME281基因与β-actin基因的RT-PCR产物电泳条带光密度比值分别为0.450、0.463、0.546和0.660,该比值随着胁迫处理时间的增加而逐步增大(图 6),说明叶片中的ME281基因在受到白叶枯病原菌胁迫后的表达量逐步增高;而愈伤组织的光密度值分别为0、0.665、0.34和0.233,该比值在胁迫处理后24 h急剧增加到最高,但在48 h后又急剧下降,说明愈伤组织中的ME281基因在受到白叶枯病原菌胁迫后的表达量先升高后下降。进一步说明ME281基因在疣粒野生稻细胞特异化前后是不同类型的表达基因。
|
| 图 6 ME281基因的mRNA的表达水平 |
通过对愈伤组织和叶片的SA和JA定量检测发现,愈伤组织的SA和JA含量无论是未处理还是处理后均高于叶片细胞,这可能与愈伤组织没有特异化、细胞壁较薄致使病原菌易侵入有关。为了防止病原菌的侵害而产生高的表达量,同时说明疣粒野生稻抗白叶枯病能力是在原胚细胞就已具备,PXO99胁迫处理后的愈伤组织和叶片细胞的SA的含量在24 h时含量大幅增加,说明可能引起了SA介导的抗病信号传导途径;而JA的含量在72 h内均无较大变化,说明可能未引起JA介导的抗病信号传导途径,也可能JA介导的抗病信号传导途径与SA介导的抗病信号传导途径发生拮抗作用,致使JA含量无较大变化。作为植物防御反应中的重要信号分子,SA与JA介导的途径相对独立,并在某些位点存在拮抗[10]。Mur等[11]在烟草研究中发现,创伤诱导叶片的JA含量可被SA抑制,并且随着SA浓度的增加,抑制效果增强。但SA和JA在调控植物防御反应过程中也并非完全独立,仍存在交叉点,Spoel等[12]发现SA通过调节蛋白NPR1的表达来抑制JA基因的表达。总之,SA和JA两个抗病信号传导途径是一个复杂的网络,目前的研究已经表明很多外源或内源诱导因子都能引发SA和JA的生物合成,激活防御反应系统,从而增强植物的抗性。在今后的研究中,应进一步明确SA和JA的相互作用和关键基因,为揭示抗病机制提供科学依据。
本研究中的ME207基因是一个编码泛素结合酶的基因。泛素结合酶(E2)通过参与泛素-蛋白酶体途径,即泛素活化酶(E1)、泛素结合酶(E2)和泛素-蛋白连接酶(E3)与靶蛋白结合形成泛素链,使靶细胞被泛素化后能够被26S蛋白酶识别和降解。该途径广泛存在于真核生物中,在控制植物生长发育、维持细胞功能、参与细胞信号传导、抵御环境胁迫、激素响应等方面发挥重要作用。本研究发现ME207基因在疣粒野生稻细胞特异化前后均有表达,说明该基因在叶片和愈伤组织中均参与了抗病信号的传导途径,且在叶片接菌处理后表达水平明显随处理时间的增加而逐步增高,在愈伤组织接菌处理后表达水平先降低再升高,其在叶片和愈伤组织中的表达水平均不一致,可能是因为在细胞特异化前后对病原菌的抗病能力有所差异有关,这与现在研究发现的泛素-蛋白酶体途径参与蛋白降解从而调控植物抗病性相符合。
本研究中的ME281基因是一个具有NBS-LRR(Nucleotide binding site and leucine rich repeat)典型抗病结构域的基因。NBS-LRR类抗病基因具有共同的结构域NBS和LRR,NBS结构域一般比较保守,包括P-loop、kinase-2和kinase-3三个保守结构域,能够结合ATP或GTP参与抗病信号的传导;LRR结构域变化比较大,但也具有保守结构单位xxLxLxx,结构域中的β转角能与病原无毒蛋白相互作用参与病原物的识别[13]。本研究发现ME281基因则在细胞特异化前是诱导型表达基因、特异化后是组成型表达基因,可能是ME281基因在叶片和愈伤组织中的表达时间点不同,在细胞特异化前不是植物的主要抗病基因,在细胞特异化后是植物的主要抗病基因,同时也充分证明了基因表达的时空性,为以后研究同一植物的不同生长时期的抗病性提供更多的参考依据。
本研究中,胚性细胞中的SA和JA含量在经PXO99胁迫处理后均显著升高,ME207基因在愈伤组织接菌处理后表达水平先降低再升高,可能是SA或JA的高表达量对该基因表达的一个短暂抑制,而ME281基因在愈伤组织中胁迫处理前无表达、胁迫处理后有表达,可能是SA或JA的抗病信号传导通路促进了该基因的表达。叶片细胞中的SA含量经PXO99处理后显著升高,而JA含量经PXO99处理后无变化,ME207基因和ME281基因的表达量在经PXO99处理后均显著升高,说明这两个抗病基因的表达可能与SA介导的抗病信号通路相关。
4 结论通过对疣粒野生稻的胚性细胞(即愈伤组织,非特异化)和叶片细胞(已特异化)进行白叶枯病原菌胁迫处理后,分别检测其抗病信号物质及抗白叶枯病相关基因的表达情况发现,愈伤组织的SA和JA含量无论是未处理还是处理后均高于叶片细胞;抗病基因ME207在疣粒野生稻细胞特异化前后均有表达,而抗病基因ME281则在细胞特异化前是诱导型表达基因、特异化后是组成型表达基因。
| [1] | 胡向阳.激发子诱导植物防御反应过程中的信号分子[D].北京:中国科学院, 2013. http://d.wanfangdata.com.cn/Thesis/Y541219 |
| [2] | 乔禹, 丁国华. NPR在SA信号通路中的研究进展. 中国农学通报 , 2016, 32 (8) : 37–43. |
| [3] | 何金环, 王延方. 水杨酸诱导植物抗病性作用机制研究. 郑州牧业工程高等专科学校学报 , 2015, 35 (3) : 8–11. |
| [4] | 朱家红, 彭世清. 茉莉酸及其信号传导研究进展. 西北植物学报 , 2006, 26 (10) : 2166–2173. |
| [5] | Orozco-Cardenas ML, Narvaez-Vasquez J, Ryan CA. Hydrogen peroxide acts as a second messenger for the induction of defense genes in tomato plants in response to wounding, systemin, and methyl jasmonate. Plant Cell , 2001, 13 : 179–191. DOI:10.1105/tpc.13.1.179 |
| [6] | Wasternack C, Stenzel I, Hause G, et al. The wound response in tomato-Role of jasmonic acid. Journal of Plant Physiology , 2006, 163 (3) : 297–306. DOI:10.1016/j.jplph.2005.10.014 |
| [7] | 余朝阁, 李天来, 杜妍妍, 等. 植物诱导抗病性及其信号传导途径. 北方园艺 , 2007 (7) : 73–76. |
| [8] | 刘艳, 蔡贵芳, 成宇. 茉莉酸类物质在植物伤反应中的信号功能. 内蒙古农业大学学报 , 2011, 32 (4) : 354–359. |
| [9] | 彭金英, 黄勇平. 植物防御反应的两种信号转导途径及其相互作用. 植物生理与分子生物学学报 , 2005, 31 (4) : 347–353. |
| [10] | 陆雯, 潘露琪, 王雪艳. 水杨酸及茉莉酸介导植物抗病性的研究进展. 贵州农业科学 , 2013, 41 (10) : 40–43. |
| [11] | Mur LA, Kenton P, Atzorn R, et al. The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy, antagonism, and oxidative stress leading to cell death. Plant Physiol , 2006, 140 (1) : 249–262. |
| [12] | Spoels SH, Koornneef A, Claessens SM, et al. NPR1 modulates crosstalk between salicylate and jasmonate-dependent defence pathways through a novel function in the cytosol. Plant Cell , 2003, 15 (3) : 760–770. DOI:10.1105/tpc.009159 |
| [13] | 刘静, 畅志坚, 郭慧娟, 等. 植物NBS类R基因的分类、进化、调控及应用. 山西农业科学 , 2016, 44 (3) : 423–426. |




