烟草花叶病毒(Tobacco mosaic virus,TMV)和马铃薯Y病毒(Potato virus Y,PVY)均为RNA病毒,寄主广泛,可危害烟草、马铃薯、番茄和辣椒等多种茄科作物,造成巨大经济损失[1]。
WRKY(WRKY transcription factors,WRKY TFs)等多种转录因子参与植物对生物逆境的防卫[2]。WRKY转录因子的氨基端包含保守的WRKY结构域,该结构域约含有60个氨基酸,由1个七肽WRKYGQR序列和一个锌指结构组成,WRKY结构域能够与靶基因启动子上的W-box元件[(C/T)TGAC(C/T)序列]特异性结合,实现对靶基因的调控作用[3]。根据WRKY结构域数目和锌指结构特征,将WRKY转录因子家族分为类型Ⅰ、Ⅱa+Ⅱb、Ⅱc、Ⅱd+Ⅱe和Ⅲ[4]。在拟南芥中的研究表明,WRKY40是一个负调控植物白粉病抗性的转录因子,它的表达会抑制抗病信号通路EDSl和抗病物质亚麻荠素(camalexin)的合成[5]。在烟草中过表达苜蓿的WRKY基因,能够显著诱导NtPR2(endo-1,3-beta-glucanase)基因的表达,增强转基因烟草对烟草花叶病毒抗性反应[6]。在烟草中,WRKY8与植物的免疫相关[7, 8],WRKY3和WRKY6参与JA(茉莉酸)信号调控的防御反应,将这两个基因单独或同时沉默,茉莉酸的合成显著下降,加重烟草天蛾的侵害[9]。也有报道指出,烟草的WRKY1和WRKY2基因能够迅速响应机械损伤和真菌侵害[10, 11]。研究表明,病原物相关分子模式触发的免疫(PTI)和效应子触发的免疫(ETI)可以诱导大部分WRKY转录因子在转录水平上的表达,例如烟草的WRKY7、8、9、11[12]。我们曾发现,当烟草花叶病毒(Tobacco mosaic virus,TMV)、马铃薯Y病毒(Potato virus Y,PVY)和黄瓜花叶病毒(Cucu-mber mosaic virus,CMV)侵染普通烟草后,烟草幼叶的一种WRKY基因的表达激增[13]。因此,进一步研究该基因在烟草应答病毒侵染过程中的作用,对阐明植物抗病信号转导途径及其作用机制具有重要作用。
近年来发展的人工miRNA(artificial miRNA,amiRNA)的技术,以生物体内源miRNA前体作为天然骨架,以人为选定的靶基因的特定片段取代天然miRNA成熟序列,构建amiRNA以达到抑制生物体内靶基因表达的目的,实现特定基因的沉默,特别是用于共同抑制多个基因的表达[14, 15]。这种技术以其特异性、高效性受到了普遍的关注,在动植物代谢工程、生长发育调控以及抵抗外源病毒等方面起着重要的作用[16]。但是由于难以明确所有amiRNA在体内都能按预期被加工产生而具有显著的抑制功能。因此,有必要对相关因素进行进一步的研究。
为此,本研究在克隆获得NtWRKY cDNA之后,建立该基因过表达转基因烟草,并以TMV为毒源,以明确该基因在烟草应答病毒侵染过程中的作用。此外,为探索应用人工miRNA的抗病毒技术,以烟草天然miR167e前体为骨架、PVY病毒外壳蛋白基因的一段反向互补序列为成熟序列,构建35S启动子驱动的植物表达载体35S∷amiRNA-PVY并转化烟草,以抑制PVY病毒,旨在为植物基因表达的调控及其应用技术提供科学依据。
1 材料与方法 1.1 材料 1.1.1 植物材料实验所用烟草品种为云烟85,为本实验室培养的无菌苗。
1.1.2 病毒材料烟草花叶病毒(TMV)和马铃薯Y病毒普通株系(PVYO系)繁殖并保存于云烟草85上,由安徽农业大学江彤副教授提供。
1.2 方法 1.2.1 DNA提取烟草叶片DNA的提取采用CTAB法,DNA样品经RNase I酶(TaKaRa)处理以去除RNA污染。DNA浓度用NanoDrop 2000超微量分光光度计(Thermo)测定。
1.2.2 RNA提取及cDNA的合成烟草叶片总RNA(Total RNA)和小RNA(Small RNA)提取分别使用RNAiso Plus试剂盒(TaKaRa)和RNAiso Plus for Small RNA试剂盒(TaKaRa)并按使用说明提取。总RNA样品经DNase I酶(TaKaRa)处理以去除DNA污染。RNA浓度用NanoDrop 2000超微量分光光度计(Thermo)测定,RNA的完整性通过1%琼脂糖凝胶电泳检测。cDNA第一链合成分别使用PrimeScript RT reagent Kit(TaKaRa)和SYBR PrimeScript miRNA RT-PCR Kit(TaKaRa)并按说明书进行。
1.2.3 生物信息学分析在拟南芥信息资源网站TAIR上下载拟南芥WRKY家族的部分基因编码蛋白的序列,包括AtWRKY1(AT2G04880)、AtWRKY4(AT1G13960)、AtWRKY6(AT1G62300)、AtWRKY9(AT1G68150)、AtWRKY10(AT1G55600)、AtWRKY14(AT1G30650)、AtWRKY15(AT2G23320)、AtWRKY17(AT2G24570)、AtWRKY36(AT1G69810)、AtWRKY40(AT1G80840)、AtWRKY56(AT1G64000)、AtWRKY57(AT1G69310)、AtWRKY60(AT2G25000)、AtWRKY61(AT1G18860)、AtWRKY63(AT1G66600)、AtWRKY64(AT1G66560)、AtWRKY65(AT1G29280)、AtWRKY67(AT1G66550)、AtWRKY71(AT1G29860),在NCBI数据库下载其他植物WRKY家族基因编码蛋白的序列,其中包括棉花的GhWRKY1(KF669831)、GhWRKY2(KF669759)、GhWRKY3(KF669771)、GhWRKY4(KF669822)、GhWRKY5(KF669781)、GhWRKY12(KF669853)、GhWRKY19(KF669784)、GhWRKY34(KF669842)、GhWRKY40(AGX24945.1),大豆的GmWRKY25(ABS18427.1)、GmWRKY40(ABC26914.1)、GmWRKY53(ABC26915.1)。运用MEGA5.10软件基于邻位归并法(NJ法)构建系统进化树。
运用DNAMAN软件,对普通烟草(Nicotiana tobacum)NtWRKY40(AB024510.1)、绒毛状烟草(N. tomentosiformis)NtoWRKY40(XM_009612054.1),美花烟草(N. sylvestris)NsWRKY40(XM_009782127.1)和番茄(Solanum lycopersicum)SlWRKY40(NM_001317914.1)进行多重序列比对。应用WoLF PSORT(http://wolfpsort.org/)在线软件对NtWRKY40进行亚细胞定位预测。
1.2.4 质粒的构建以烟草cDNA为模板,NtWRKY40基因上下游引物进行克隆,获得烟草NtWRKY40基因全长序列,通过引物上的Xba I和Sac I酶切位点,连接到植物双元表达载体pBI121上,获得pBI121-NtWRKY40植物表达载体。
以病毒外壳蛋白为靶基因,以烟草天然miR167e为骨架[17],在网站WMD3[18](Web miRNA Designer,http://wmd3.weigelworld.org/)上设计amiRNA引物,通过重叠PCR(overlapping PCR)的方法,以烟草DNA为模板,先以amiR167-F与amiR167-Ⅰ、amiR167-Ⅱ与amiR167-Ⅲ和amiR167Ⅳ与amiR167-R这3对引物进行分段扩增,回收3段目的片段,以这3段回收片段为模板,用引物amiR167-F和amiR167-R进行融合PCR扩增,即得到amiR167-PVY序列。然后通过BamH I和Sac I酶切位点,连接到植物双元表达载体pBI121上,获得pBI121-amiR167-PVY植物表达载体。
1.2.5 基因的定量分析检测NtWRKY40基因、病毒相关基因和amiRNA前体(pre-amiR167-PVY)基因表达的实时荧光定量PCR是以总RNA反转录产物为模板,所用基因专一性引物,见表 1。内参基因为Ntubc2[19],荧光定量PCR用TransStart Top Green qPCR Mix试剂盒(TransGen)并按照说明书配制反应体系,在Bio-Rad荧光定量PCR仪上扩增。反应条件为:95℃预变性30 s;95℃变性5 s,55℃退火25 s,72℃延伸20 s,40个循环;72℃延伸5 min。数据读取由实时荧光定量PCR仪自动完成,供试基因的扩增效率均在85%以上。基因表达水平计算采用2-ΔΔCt方法。试验进行3次技术重复,采用t检验进行显著性差异分析。
实时荧光定量PCR检测amiRNA成熟序列。以小RNA反转录产物为模板,专一性引物:一条为试剂盒内的通用引物Uni-miR qPCR Primer,另一条为amiR167-PVY的成熟序列(转基因烟草)或烟草天然miR167成熟序列(野生型烟草),内参基因为烟草miR159成熟序列[20]。荧光定量PCR用SYBR PrimeScript miRNA RT-PCR Kit试剂盒(TaKaRa)并按照说明书配制反应体系,在Bio-Rad荧光定量PCR仪上扩增。反应条件为:95℃预变性10 s;95℃变性5 s,60℃退火20 s,72℃延伸20 s,40个循环;72℃延伸5 min。数据读取由实时荧光定量PCR仪自动完成,供试基因的扩增效率均在85%以上。基因表达水平计算采用2-ΔΔCt方法。试验进行3次技术重复,采用t检验进行显著性差异分析。
1.2.6 农杆菌介导转化烟草获得转基因植株将构建正确的植物双元表达载体转化到农杆菌GV3101中,挑取单菌落摇菌,经PCR验证正确后以1:100的比例扩大培养。参照Horsc等[21]的方法进行农杆菌介导转化烟草,获得转基因植株。
1.2.7 病毒侵染将保存的带有病毒毒源的烟草叶片研磨,加入PBS缓冲液稀释(1 g:10 mL),对烟草的倒数第2、3片叶进行摩擦接毒,取样部位为侵染叶的非接毒区和非侵染叶(倒数第4片叶)。在病毒侵染前期,我们以叶片中病毒外壳蛋白基因(Coat protein,CP)和移动蛋白基因(Move protein,MP)的表达水平判断病毒含量;在侵染后期,以烟草植株上的病毒症状判断染病情况。
2 结果 2.1 烟草NtWRKY40对病毒侵染的响应 2.1.1 NtWRKY40的生物信息学分析克隆获得的受病毒诱导的烟草WRKY基因cDNA长777 bp,编码258个氨基酸,在NCBI比对相似度最高的为绒毛状烟草NtoWRKY40(XM_009612054.1)(95%),其次是美花烟草NsWRKY40(XM_009782127.1)(93.0%),番茄SlWRKY40(NM_001317914.1)(83.0%),故将该基因命名为NtWRKY40,GenBank登录号为AB024510.1。
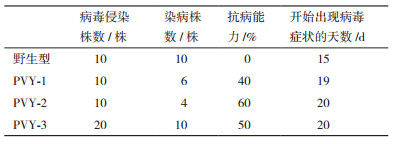
参照模式植物拟南芥WRKY家族的分类、进化关系,NtWRKY40属于WRKY家族基因Ⅱa亚族成员(图 1-A),多重序列比对显示NtWRKY40具有该家族完整的结构,包括一个典型的WRKY结构域和一个假定的锌指结构(C-X4-5-C-X22-23-H-X1-H,图 1-B)。在线软件WoLF PSORT预测NtWRKY40定位在细胞核中,序列分析表明,NtWRKY40含有3个可能的核定位信号(82RKRK85,104PKRPREI110,163PVKKKVQ169,图 1-B)。
|
| 图 1 NtWRKY40基因系统进化树(A)和氨基酸序列分析(B) A :NtWRKY40基因新进化树,矩形框中代表NtWRKY40。B :NtWRKY40氨基酸序列分析,黑色底纹代表氨基酸序列100%一致,双向箭头代表WRKY结构域,矩形框中代表该结构域中高度保守的WRKYGQK序列,黑色圆点代表锌指结构(C-X4-5-C-X22-23-H-X1-H)中的C和H残基,NLS代表可能的核定位信号 |
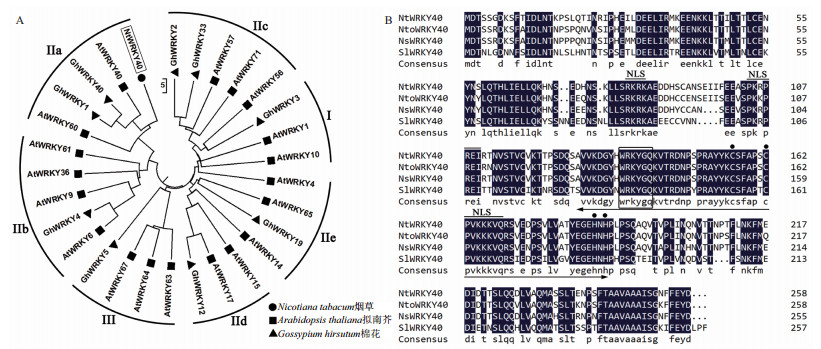
为了进一步研究烟草NtWRKY40在应答病毒侵染中的作用,通过双酶切的方法将目的基因插入植物表达载体pBI121,并置于花椰菜花叶病毒35S启动子(35S)之后。再通过农杆菌GV3101介导,获得35S∷NtWRKY40转基因烟草植株。经过PCR鉴定,获得7个不同的转基因株系(W-1-W-7)。NtWRKY40在不同独立的转基因株系中的表达水平与野生型烟草相比,有不同程度的提高(图 2-A)。
|
| 图 2 35S∷NtWRKY40过表达烟草中NtWRKY40的表达(A)及病毒侵染后的变化(B) * : P < 0.05;** : P < 0.01 |
选择NtWRKY40表达水平较高(W-5)和较低(W-3)的两个株系各20株接种TMV和PVY两种病毒,野生型烟草(WT)作为对照。观察发现,过表达植株比野生型植株早2 d出现病毒症状,在第9天时,转基因烟草的斑驳花叶病症较野生型更为明显(图 3),表明NtWRKY40过表达株系对病毒的敏感性增加。TMV病毒侵染实验(图 2-B)表明,野生型烟草的NtWRKY40表达在侵染后6 h和3 d均有升高,但两者没有明显差异。但在侵染后9 d,NtWRKY40表达量显著升高至148倍。NtWRKY40过表达转基因植株W-3在病毒侵染6 h和3 d时,NtWRKY40的表达量均比野生型高。但在侵染后的9 d时,其表达水平则稍低于野生型。W-5转基因植株在病毒侵染后6 h和3 d时,NtWRKY40的表达水平远高于野生型,而9 d时虽高于野生型(W-5为184,WT为148),但二者没有显著性差异。从转基因植株来看,9 d时NtWRKY40的表达水平均比6 h和3 d略有降低。

|
| 图 3 TMV病毒侵染后9 d野生型烟草(WT)与NtWRKY40转基因烟草株系W-3和W-5病症表型 |
为了进一步研究病毒侵染后病毒含量的动态变化,以确定NtWRKY40基因与感病程度的关系,利用定量PCR的方法分析了NtWRKY40过表达烟草与野生烟草的非侵染叶中TMV病毒外壳蛋白基因(coat protein,CP)和移动蛋白基因(move protein,MP)的表达水平。在接种TMV病毒后6 h,即可检测到CP和MP的表达(图 4)。分别以6 h时野生型烟草中CP和MP的表达水平为1,计算此后不同时间点的病毒基因表达的相对量。接种病毒后3 d(图 4-A),野生植株CP和MP的表达水平比6 h时高了1-2倍,而W-3和W-5中CP和MP升高了4-5倍;接种病毒后9 d(图 4-B),野生植株CP和MP的表达水平升高了5 000多倍,转基因植株W-3升高了1×104多倍,而W-5的表达水平则升高了近1.5×105倍。
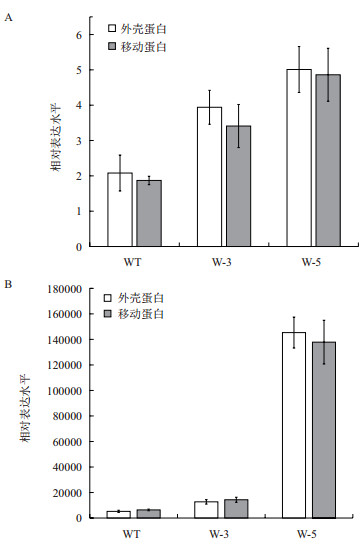
|
| 图 4 病毒外壳蛋白基因(CP)和移动蛋白基因(MP)在TMV病毒侵染后3 d(A)和9 d(B)的表达变化 *P < 0.05;**P < 0.01 |
综合图 2和图 4的结果,NtWRKY40的表达水平与CP和MP的表达水平呈正相关,且与叶片的感病程度一致,说明过表达NtWRKY40使植物对病毒的侵染更加敏感,表明NtWRKY40是一个负调控因子。
2.2 amiRNA抗病毒技术 2.2.1 amiR167-PVY转基因烟草植株的获得为进一步探索应用人工miRNA抑制病毒病害的技术,以烟草miR167e为骨架,以PVY病毒外壳蛋白为抑制对象,应用WMD3程序获得反义基因序列,进而构建出35S∷amiR167-PVY重组质粒,通过农杆菌介导法建立35S∷amiR167-PVY转基因植株的3个株系PVY-1、PVY-2和PVY-3。在35S启动子的驱动下,3个株系的amiR167-PVY成熟序列均比天然miR167有上百倍的表达(图 5-A)。以野生型烟草中miR167前体序列的表达水平为对照1,以此计算转基因植株中amiR167-PVY前体序列(pre-amiR167-PVY)的转录水平,结果(图 5-B)显示,3个株系的前体序列的表达水平也有明显的提高,且成熟序列的表达水平与前体基因的表达水平呈正相关。
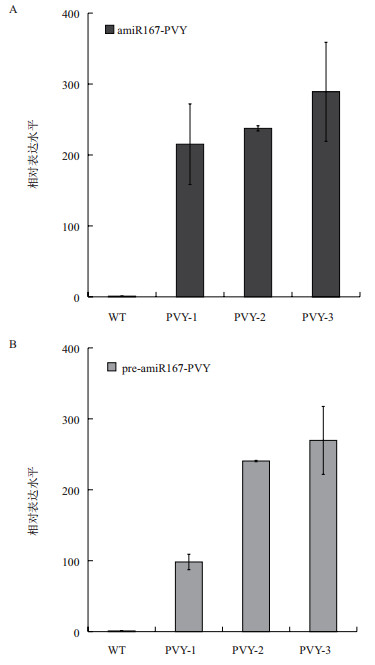
|
| 图 5 35S∷amiR167-PVY转基因烟草植株中amiR167-PVY成熟序列(A)和前体(B)的定量分析 **P < 0.01 |
将35S∷amiR167-PVY转基因植株的3个株系扩繁后接种PVY病毒,侵染30 d后对野生型烟草及PVY-1、PVY-2和PVY-3三个株系的抗病能力进行了统计。结果(表 2)显示,amiR167-PVY的3个株系均出现了病毒症状,但与野生型相比,转基因植株发病率较野生型低,病症发展较慢,对病毒有一定的抑制作用。
为了追踪病毒在侵染过程中的动态变化,对PVY-3号株系中的10棵烟草和野生型烟草中PVY病毒外壳蛋白基因(PVY-CP)进行定量分析。以侵染后6 h野生型烟草PVY-CP的表达水平为1,计算侵染后6 h和3 d转基因植株非侵染叶中PVY-CP的转录水平,结果(图 6)显示,6 h时除3-9中的表达水平与野生型相似外,其他植株的表达较低或者检测不到,3 d时野生型植株的表达升高至6 h的3倍,而转基因植株的表达显著低于野生型,对病毒具有抑制效果。
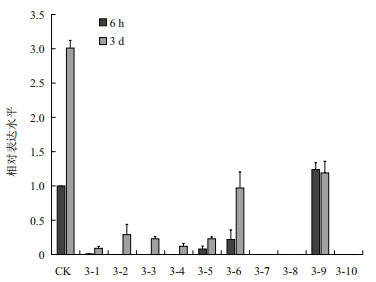
|
| 图 6 病毒侵染6 h和3 d后病毒外壳蛋白PVY-CP基因的定量分析 Nd :未检测到;** : P < 0.01 |
病毒侵染1个月后,总体上转基因烟株与野生株相比,病症显著减轻,但仍有个别转基因植株的病症与野生株相近(图 7)。为了进一步了解病症与人工amiR167-PVY、病毒外壳蛋白基因表达的关系,选择amiR167-PVY-3转基因植株F2分离后代中病症较重的3-9、病症较轻的3-1和抗病的3-8(图 7),进行上述基因的定量分析。

|
| 图 7 野生烟草(CK)和过表达amiR167-PVY的转基因烟草(3-9,3-1,3-8)病毒侵染1个月后的病症表型 |
以野生型烟草中miR167成熟序列的表达水平为1,计算转基因植株中amiR167-PVY成熟序列的转录水平。结果(图 8-A)显示,病症较轻植株的表达水平高于病症重者(3-8 > 3-1 > 3-9)。以侵染后6 h的野生型烟草中PVY-CP的表达水平为1,计算转基因植株病叶和非病叶中PVY-CP的转录水平,结果(图 8-B)显示,与6 h的野生型烟草相比,染病植株中PVY-CP的表达水平均有不同程度的升高,且与病症的严重程度相关,即病症严重的植株PVY-CP表达水平高,病症较轻的则表达水平低,而在未染病植株3-8中始终未检测到病毒相关基因的表达。在转基因植株中,PVY-CP的表达水平与成熟序列的表达水平表现出负相关,说明amiRAN抑制了病毒基因的表达,起到了抗病毒作用。
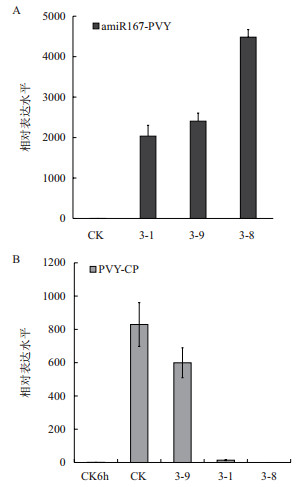
|
| 图 8 侵染病毒一个月后染病植株中成熟序列(A)和病毒外壳蛋白(B)的定量分析 Nd :未检测到;** : P < 0.01 |
对影响植物防卫反应的一些WRKY家族基因的研究表明,当植物受到不同病原体或是防御信号物质诱导时,WRKY基因的转录、蛋白合成以及结合活性都会产生明显变化,从而对不同的抗性反应作出调节[5, 22]。在病原菌感染以及用病原菌诱导子或水杨酸(salicylic acid,SA)处理时,许多植物中的WRKY基因迅速被诱导[23, 24],随后WRKY蛋白通过特异性的识别启动子上的W-box,激发一系列与抗病相关基因的表达,例如,PR基因等[25, 26]。一些研究对特定的WRKY蛋白参与植物防御反应提供了直接证据,例如,西芹中WRKY1作为转录激活子,通过与W-box结合来调节真菌诱导子诱导的基因表达[27]。有研究报道,植物对机械损伤和病原菌侵染的响应有着共同的信号传导元件,都能够诱导WRKY转录因子的表达[5]。当前对WRKY家族的研究主要集中该转录因子调节防卫反应中下游抗病基因的表达机制,以及确立它所参与的信号转导途径中一些上游信号传递元件[28]。在拟南芥中的研究发现,当病原菌侵染拟南芥时,AtWRKY40主要通过调控JZS的表达进而影响一些相关信号途径,如对JA信号途径的影响使得拟南芥对霉粉菌的入侵更加敏感[5]。在烟草中过表达NtWRKY-R1基因,导致JA信号途径关键防御基因PDF1.2表达量降低[29],说明NtWRKY-R1基因影响JA信号途径,参与逆境信号调节作用。
目前利用农杆菌介导的转基因技术并结合植物的逆境处理,可以有效揭示出WRKY转录因子所参与和调控的信号传导途径[5, 22]。本研究中所用的35S启动子是组成型启动子,其本身不受病毒或机械损伤的影响,而植物内源的NtWRKY40受病毒诱导,从病毒侵染后的发病症状来看,NtWRKY40过表达烟草对病毒的反应更加敏感,感病时效更短,病毒的表达与NtWRKY40的表达呈现出正相关,因此我们认为NtWRKY40是一个负调控因子,这有可能是病毒侵染6 h和3 d时,过表达株系中NtWRKY40的表达水平显著高于野生型的主要原因,而野生烟草在病毒侵染9 d时才受到显著诱导(图 2-B)。我们在取样过程中对植株造成一定的机械损伤,可能引起了PRs和JZS基因的表达变化,使得NtWRKY40过表达植株对TMV的敏感性增加。另外,有研究显示[13],烟草WRKY的表达水平与叶片发育程度呈负相关,即幼叶中表达水平高,老叶中表达水平低,本研究中,NtWRKY40的转基因烟草在病毒侵染后9 d,NtWRKY40的表达水平低于6 h和3 d,可能是因为转基因烟草对病毒的侵染更加敏感,导致其衰老程度加快,因而9 d时NtWRKY40的表达水平下降。
3.2 amiRNA骨架和病毒靶基因位点的选择
到目前为止,一般amiRNA均以天然miRNA作为骨架,一方面可以避免amiRNA转录后的降解碎片可能引起的内源基因的表达受到意外抑制,另一方面,可以使amiRNA在生物体内得以像天然miRNA一样顺利产生成熟的短链amiRNA片段[30, 31]。不同的miRNA骨架对靶基因的抑制效果也不尽相同,Ai等[32]在拟南芥上的研究发现,在选用相同的靶基因和成熟序列的前体下,miR159a,miR167b和miR171a三种不同前体对PVX(Potato virus X,马铃薯X病毒)和PVY病毒的抑制效果有所不同,以miR159a为骨架对病毒的抑制效率达到100%,而miR167b和miR171a则分别为75%和50%。这可能是由于植物在产生amiRNA时,miR159前体(pre-miR159a)的茎环结构更容易被DCL1(Dicer-like protein 1)识别,从而更有效的产生miRNA:miRNA*复合体(*代表反义链,与miRNA成熟序列互补);也可能与miRNA前体的自由能有关(pre-miR159a △G=-73 kcal·mol-1,pre-miR167b △G=-46.9 kcal·mol-1,pre-miR171a △G=-54.2 kcal·mol-1),自由能越低茎环结构越稳定,从而前体转录折叠成二级结构的时间变短,加快形成RISC复合体(RNA-induced silencing complex),实现更有效的基因沉默[32]。本研究以烟草miR167e为骨架构建amiRNA,根据在线网站RNAfold WebServer(http://rna.tbi.univie.ac.at/)预测,烟草miR167e的自由能为-31.35 kcal·mol-1,自由能偏高可能是amiR167-PVY不能完全抑制PVY病毒的原因之一。
此外,为数不多的有关amiRNA中人工靶基因片段序列选择的研究表明,选择高效率的小RNAs(small RNAs)和具有高度专一性的靶基因是大多数在线amiRNA序列分析软件设计amiRNA的原则,如WMD3[15]和PsRNAtarget[33](http://plantgrn.noble.org/psRNATarget/)等。本研究中选用的amiRNA成熟序列便是基于WMD3网站预测获得,选取供试序列中的最佳序列。有文献报道,WMD3网站平台是基于序列的互补配对和amiRNA与靶基因的结合能量进行预测,为每个靶基因提供出上百条候选amiRNA序列,而这些amiRNA在生物体内的表达、加工机器成熟序列的产生尚难预测[34]。amiRNA与靶基因的互作受到生物体多种因素的影响,包括靶基因mRNA的序列和mRNA结合蛋白等[35, 36]。因此,用于基因沉默的最佳amiRNA仅从目标反向互补的序列上判断,仍有不足,尚需进一步的研究。
本研究及此前的研究均表明,RNA病毒如TMV、PVY的侵染能够极显著地诱导烟草NtWRKY40的表达,而该基因在干旱、低温等逆境条件下的表达却无显著变化[13]。这些结果表明,该基因的表达控制元件对RNA病毒有较为专一的反应。因此,利用这一特点可以构建以抗病毒人工amiRNA和NtWRKY40表达控制元件为主体的表达系统,有可能实现对病毒侵染自动应答式的控制。
4 结论烟草NtWRKY40是WRKY家族基因Ⅱa亚族成员,与拟南芥AtWRKY40基因同源,具有该家族的典型结构域,它的过量表达使植物对于病毒的侵染更加敏感,是抗病负调控因子,同时它的过表达可能刺激了一些与植物生长有关的基因的表达,我们推断NtWRKY40可能是参与机械损伤胁迫和病原菌侵染的重要组分。
另外,以马铃薯Y病毒基因特定反相互补片段序列构建的amiR167-PVY在转基因烟草的抗病毒试验中,表现出对病毒有一定的抑制作用。
| [1] | Chen W, HuangT, Dai J, et al. Evaluations of tobacco cultivars resistance to Tobacco mosaic virus and Potato virus Y. Plant Pathology Journal , 2014, 13 (1) : 37–43. DOI:10.3923/ppj.2014.37.43 |
| [2] | Yan DH, Fenning T, Tang S, et al. Genome-wide transcriptional response of Populus euphratica to long-term drought stress. Plant Sci , 2012, 195 : 24–35. DOI:10.1016/j.plantsci.2012.06.005 |
| [3] | Zhao MY, Zhang ZB, Chen SY, et al. WRKY transcription factor superfamily: Structure, origin and functions. African Journal of Biotechnology , 2012, 11 (32) : 8051–8059. |
| [4] | Schmutz J, Cannon SB, Schlueter J, et al. Genome sequence of the palaeopolyploid soybean. Nature , 2010, 463 (7278) : 178–183. DOI:10.1038/nature08670 |
| [5] | Pandey SP, Roccaro M, Schön M, et al. Transcriptional reprogramm-ing regulated by WRKY18 and WRKY40 facilitates powdery mildew infection of Arabidopsis. Plant J , 2010, 64 (6) : 912–923. DOI:10.1111/tpj.2010.64.issue-6 |
| [6] | Naoumkina M, He X, Dixon R. Elicitor-induced transcription factors for metabolic reprogramming of secondary metabolism in Medicago truncatula. BMC Plant Biol , 2008, 8 : 132. DOI:10.1186/1471-2229-8-132 |
| [7] | Popescu SC, Popescu GV, Bachan S, et al. MAPK target networks in Arabidopsis thaliana revealed using functional protein microarrays. Genes Dev , 2009, 23 (1) : 80–92. DOI:10.1101/gad.1740009 |
| [8] | Ishihama N, Yamada R, Yoshioka M, et al. Phosphorylation of the Nicotiana benthamiana WRKY8 transcription factor by MAPK functions in the defense response. Plant Cell , 2011, 23 (3) : 1153–1170. DOI:10.1105/tpc.110.081794 |
| [9] | Skibbe M, Qu N, Galis I, et al. Induced plant defenses in the natural environment: Nicotiana attenuata WRKY3 and WRKY6 coordinate responses to herbivory. Plant Cell , 2008, 20 (7) : 1984–2000. DOI:10.1105/tpc.108.058594 |
| [10] | Nishiuchi T, Shinshi H, Suzuki K. Rapid and transient activation of transcription of the ERF3 gene by wounding in tobacco leaves -Possible involvement of NtWRKYs and autorepression. J Biol Chem , 2004, 279 (53) : 55355–55361. DOI:10.1074/jbc.M409674200 |
| [11] | Yamamoto S, Nakano T, Suzuki K, Shinshi H. Elicitorinduced activation of transcription via W box-related cis-acting elements from a basic chitinase gene by WRKY transcription factors in tobacco. Biochim Biophys Acta , 2004, 1679 (3) : 279–287. DOI:10.1016/j.bbaexp.2004.07.005 |
| [12] | Adachi H, Nakano T, Miyagawa N, et al. WRKY transcription factors phosphorylated by MAPK regulate a plant immune NADPH oxidase in Nicotiana benthamiana. Plant Cell , 2015, 27 (9) : 2645–2663. DOI:10.1105/tpc.15.00213 |
| [13] | 周汉琛, 席玉珍, 魏书. RNA病毒诱导的烟草WRKY转录因子基因的应急表达. 安徽农业大学学报 , 2014, 41 (6) : 1020–1026. |
| [14] | Carbonell A, Fahlgren N, Mitchell S, et al. Highly specific gene silencing in a monocot species by artificial microRNAs derived from chimeric miRNA precursors. Plant J , 2015, 82 (6) : 1061–1075. DOI:10.1111/tpj.12835 |
| [15] | Niu QW, Lin SS, Reyes JL, et al. Expression of artificial micro-RNAs in transgenic Arabidopsis thaliana confers virus resistance. Nat Biotechnol , 2008, 24 (11) : 1420–1428. |
| [16] | Qu J, Ye J, Fang R. Artificial microRNA-mediated virus resistance in plants. J Virol , 2007, 81 (12) : 6690–6699. DOI:10.1128/JVI.02457-06 |
| [17] | Tang S, Wang Y, Li Z, et al. Identification of wounding and topping responsive small RNAs in tobacco(Nicotiana tabacum). BMC Plant Biol , 2012, 12 : 28. DOI:10.1186/1471-2229-12-28 |
| [18] | Ossowski S, Schwab R, Weigel D. Gene silencing in plants using artificial microRNAs and other small RNAs. Plant J , 2008, 53 (4) : 674–690. DOI:10.1111/j.1365-313X.2007.03328.x |
| [19] | Gregor WS, Sven KD. Stable internal reference genes for normali-zation of real-time RT-PCR in tobacco(Nicotiana tabacum)during development and abiotic stress. Mol Genet Genomics , 2010, 283 (3) : 233–241. DOI:10.1007/s00438-010-0511-1 |
| [20] | Lang QL, Jin CZ, Lai LY, et al. Tobacco microRNAs prediction and their expression infected with Cucumber mosaic virus and Potato virus X. Mol Biol Rep , 2011, 38 (3) : 1523–1531. DOI:10.1007/s11033-010-0260-6 |
| [21] | Horsch RB, Fry JE, Hoffmann NL, et al. A simple and general method for transferring genes into plant. Science , 1985, 227 (4691) : 1229–1231. DOI:10.1126/science.227.4691.1229 |
| [22] | Abbruscato P, Nepusz T, Mizzd L, et al. OsWRKY22, a monocot WRKY gene, plays a role in the resistance response to blast. Mol Plant Pathol , 2012, 13 (8) : 828–841. DOI:10.1111/mpp.2012.13.issue-8 |
| [23] | Pan LJ, Jiang L. Identification and expression of the WRKY transcription factors of Carica papaya in response to abiotic and biotic stresses. Mol Biol Rep , 2014, 41 (3) : 1215–25. DOI:10.1007/s11033-013-2966-8 |
| [24] | Rushton PJ, Torres JT, Parniske M, et al. Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes. EMBO J , 1996, 15 (20) : 5690–700. |
| [25] | Chen C, Chen Z. Isolation and characterization of two pathogen-and salicylic acid-induced genes encoding WRKY DNA-binding proteins from tobacco. Plant Mol Biol , 2000, 42 (2) : 387–96. DOI:10.1023/A:1006399311615 |
| [26] | Dong J, Chen C, Chen Z. Expression profiles of the Arabidopsis WRKY gene superfamily during plant defense response. Plant Mol Biol , 2003, 51 (1) : 21–37. DOI:10.1023/A:1020780022549 |
| [27] | Turck F, Zhou A, Somssich IE. Stimulus-dependent, promoter-specific binding of transcription factor WRKY1 to Its native promoter and the defense-related gene PcPR1-1 in Parsley. Plant Cell , 2004, 16 (10) : 2573–2585. DOI:10.1105/tpc.104.024810 |
| [28] | Chi Y, Yang Y, Zhou Y, et al. Protein-protein interactions in the regulation of WRKY transcription factors. Mol Plant , 2013, 6 (2) : 287–300. DOI:10.1093/mp/sst026 |
| [29] | 胡曼, 宋丹丹, 杨金淼, 等. 烟草WRKY-R1基因的克隆及瞬时表达分析. 山东农业科学 , 2014, 46 (9) : 12–16. |
| [30] | Tiwari M, Sharma D, Trivedi PK. Artificial microRNA mediated gene silencing in plants: progress and perspectives. Plant Mol Biol , 2014, 86 (1-2) : 1–18. DOI:10.1007/s11103-014-0224-7 |
| [31] | Sablok G, Pérez-Quintero AL, Hassan M, et al. Artificial microRNAs(amiRNAs)engineering -On how microRNA-based silencing methods have affected current plant silencing research. Biochem Biophys Res Commun , 2011, 406 (3) : 315–319. DOI:10.1016/j.bbrc.2011.02.045 |
| [32] | Ai T, Zhang L, Gao Z, et al. Highly efficient virus resistance mediated by artificial microRNAs that target the suppressor of PVX and PVY in plants. Plant Biol(Stuttg) , 2011, 13 (2) : 304–316. |
| [33] | Dai X, Zhao PX. psRNATarget: a plant small RNA target analysis server. Nucleic Acids Res , 2011, 39 (Web Server issue) : W155–9. |
| [34] | Li J, Chung HS, Niu Y, et al. Comprehensive protein-based artificial microRNA screens for effective gene silencing in plants. Plant Cell , 2013, 25 (5) : 1507–1522. DOI:10.1105/tpc.113.112235 |
| [35] | Fabian MR, Sonenberg N, Filipowicz W. Regulation of mRNA translation and stability by microRNAs. Annu Rev Biochem , 2010, 79 (1) : 351–379. DOI:10.1146/annurev-biochem-060308-103103 |
| [36] | Pasquinelli AE. MicroRNAs and their targets: Recognition, regulation and an emerging reciprocal relationship. Nat Rev Genet , 2012, 13 (4) : 271–28. |