2. 中国科学院植物研究所植物分子与生理学重点实验室,北京 100093
2. Key laboratory of Plant Molecular Physiology, Insitiute Of Botany, CAS, Beijing 100093
蚜虫,又称为腻虫或蜜虫等,隶属于半翅目(原为同翅目),是农林业危害最大的害虫之一。蚜虫为刺吸式昆虫,以刺吸式口器从植物茎、叶和幼穗部位吸取汁液,大量吸收植物的营养成分导致植株生长受到抑制[1];其排泄的蜜露覆盖在植物叶片表面,影响植物的呼吸和光合作用并且引起病菌滋生,传播多种疾病[2, 3]。
植物凝集素(lectin)是一种特异性识别并可逆地与糖类化合物糖基相结合,但不改变与其相结合糖基共价结构的一类非免疫球蛋白,能够凝集细胞和沉淀糖蛋白,广泛存在于植物中[4],在各个组织中均有分布[5, 6]。根据结合糖的特异性,可将植物凝集素分为葫芦科韧皮部凝集素家族、2-型核糖体失活蛋白家族、豆科类凝集素家族、木菠萝(Jacalin)凝集素家族、苋菜凝集素家族、几丁质结合凝集素家族、单子叶结合甘露糖凝集素家族[7]等7个蛋白质家族,其中单子叶甘露糖结合凝集素因对刺吸式害虫如褐飞虱、桃蚜等同翅目害虫及线虫有毒杀作用,同时对鞘翅目和鳞翅目害虫也有一定毒性而受到研究者们的广泛关注[8]。
雪花莲凝集素(Galanthus nivalis agglutinin GN-A)是单子叶甘露糖凝集素家族中第一个被发现的凝集素,能专一识别α-1,3和α-1,6甘露糖[9, 10]。含有该基因的转基因小麦和国槐,对蚜虫具有一定的抗性[11, 12];转AalT/GNA基因的烟草对咀嚼式和刺吸式昆虫均有抗性[13];褐飞虱若虫会避开转GNA基因植株而选择未转化植株[14];将GNA基因导入棉花,获得了3个转基因品系,在抗蚜实验中3个品系对棉蚜均表现出了高抗水平[15]。半夏凝集素(Pinellia ternate agglutinin,PTA)属于单子叶甘露糖结合凝集素,由于其能特异性结合昆虫消化道内的甘露糖残基,而哺乳动物消化道内甘露糖残基很少,所以对人和哺乳动物的毒性极低,因此具有较高的应用价值。将从三叶半夏花中克隆到的PTA基因转入烟草,转基因烟草较对照的蚜口密度显著下降[16],构建cry Ia和PTA的双元表达载体转入小麦,蚜虫存活率减少至54%和78%[17],转PTA烟草抑蚜率达到77.02%[18];将半夏凝集素基因在烟草叶绿体中表达,对蚜虫、飞虱、鳞翅目昆虫等都有较高抗性[19]。Qi等[20]将半夏凝集素基因导入水稻内生枯草芽孢杆菌,发现对白背飞虱有很强的抗性,均表明PTA有较强的抗虫活性。
掌叶半夏凝集素(Pinellia pedatisecta agglutinin,PPA)也属于单子叶甘露糖结合凝集素家族,能够可逆地和甘露糖或甘露聚糖结合。Wu等[21]将掌叶半夏球茎中的凝集素基因在烟草中表达,能够提高转基因植株对桃蚜的抗性,T0代植株平均抑制率为90.28%,其中有两个株系致死率为100%。可见掌叶半夏凝集素具有较强的杀虫效果。本研究利用NCBI公布的半夏凝集素保守序列设计特异性引物,从掌叶半夏幼叶中克隆出一个新的凝集素基因PPA2,分别构建35S-PPA2过表达载体和AtPP2-PPA2韧皮部特异性表达载体,获得转基因烟草纯合植株并进行抗蚜性试验,旨在鉴定新的抗蚜基因,并为抗蚜基因的高效表达研究奠定基础。
1 材料与方法 1.1 材料掌叶半夏由河北省农业科学院提供,大肠杆菌DH5α、农杆菌GV101、植物表达载体pEarleyGate 101等主要菌株和载体均由本实验室保存。
植物总RNA提取试剂盒、反转录试剂盒、DNA回收试剂盒、质粒提取试剂盒等主要试剂盒都购于天根生化科技有限公司,phusion DNA聚合酶、Taq DNA聚合酶等主要酶购自Sigma公司,其他化学试剂购自国内试剂公司。
1.2 方法 1.2.1 RNA提取及反转录掌叶半夏总RNA提取采用天根多糖多酚植物总RNA提取试剂盒(离心柱型)进行,具体步骤参考试剂盒内提供的实验流程。采用天根公司的反转录试剂盒,将获得的cDNA第一条链作为后续的载体构建及反转录聚合酶链式反应(RT-PCR)的反应模板。
1.2.2 PPA2基因的克隆在NCBI数据库中进行BLASTN检索,根据已公布的半夏凝集素甘露糖结合保守序列,利用Primer 5.0引物软件设计基因特异引物658-F' 和658-R' (表 1),由上海Life公司合成。利用引物扩增到一条序列,将序列连在测序载体并转化大肠杆菌,挑取阳性菌落测序,经Blast比对发现其属于单子叶甘露糖结合凝集素家族,且为新序列。
用在线软件Compute pI/Mwtool,ExPASy(http://expasy.org/tools/pi_tool.html)预测PPA2蛋白的分子量和等电点,在http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi中分析PPA2蛋白的保守序列,使用DNAMAN软件进行系统进化分析。
1.2.4 植物表达载体构建及转化参照试剂盒说明书,使用Gateway(Invitrogen)系统,构建35S启动子驱动的PPA2超表达载体,载体为pEarley Gate 101,大肠杆菌(Escherichia coli)菌株为DH5α,农杆菌菌株为GV3101。采用CTAB法提取拟南芥DNA,根据NCBI中公布的拟南芥韧皮部蛋白特异性启动子区序列,然后采用Primer 5.0引物设计软件设计引物,扩增出韧皮部蛋白启动子特异性AtPP2,将其与pEarley Gate TW1连接后,同样采用Gateway系统构建AtPP2启动子驱动的表达载体。
1.2.5 转基因烟草T3代纯合植株的获得使用75%乙醇和1% NaClO对野生型烟草W38种子表面消毒后种于1/2 MS培养基中,制备无菌苗;将上述构建的植物表达载体电击转化农杆菌,叶盘法转化烟草,通过Basta抗性筛选,组织培养侵染的烟草叶片经脱分化-再分化途径,获得转基因烟草幼苗,然后经炼苗后移栽至花盆中于温室生长。在T1代转基因烟草植株中,根据孟德尔遗传定律,通过Basta抗性筛选,将分离比为3:1的株系进一步通过PCR和Western-blot鉴定,获得单基因位点插入的基因植株,套袋自交并留种;将单基因插入的烟草种子种下,进行抗性筛选,获得T3代不分离的纯合株系。然后,采用CTAB法提取烟草叶片DNA进行PCR鉴定,提取烟草叶片蛋白,进行Western-blot鉴定。植物表达载体上带有YFP标签,以YFP抗体为探针,通过分析YFP含量从而确定紧密连锁的目的基因的表达量,并根据目的蛋白表达量的多少,分别将含有35S启动子和AtPP2的转基因烟草植株分为高、中、低3类,每类各3株。
1.2.6 转基因烟草纯合植株的抗蚜性试验当烟草长出第8片真叶时,与长势一致的野生植株一起采用搭叶法接种一龄桃蚜20头进行抗蚜试验,每隔3 d统计一次烟叶上的蚜虫数量,共统计5次。根据以下公式计算各植株的抗蚜效率,比较35S启动子和AtPP2启动子驱动下的转基因纯合株系的抗蚜性:
抑蚜率(%)=[(对照组蚜虫数目-测试组蚜虫数目)/对照组蚜虫数目]×100%
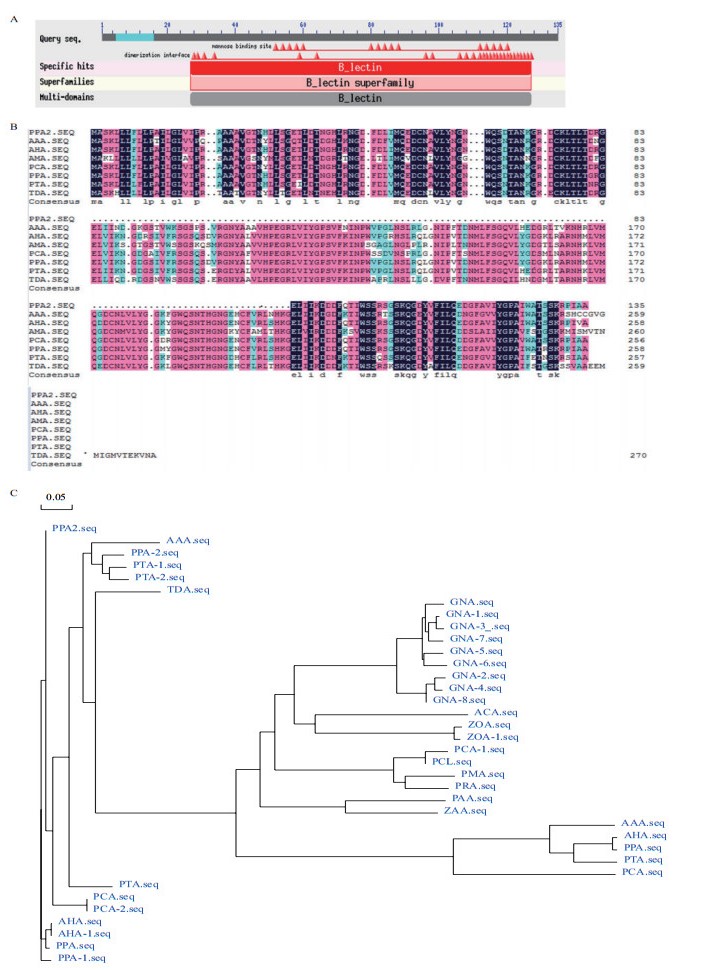
2 结果 2.1 PPA2基因克隆及序列分析根据NCBI中已公布的半夏凝集素保守序列,采用Primer5.0设计了特异性引物:658-F和658-R(表 1)。提取掌叶半夏RNA(图 1-A),通过RT-PCR法从掌叶半夏幼叶中扩增到一条大小为408 bp的cDNA片段(图 1-B),经克隆测序后命名为PPA2。生物学信息分析发现该基因分子量为14.7 kD,pI为4.98,编码135个氨基酸,具有一个信号肽的前体蛋白,切割位点在21和22个氨基酸之间;含有一个甘露糖保守结构域包括3个甘露糖结合位点,属于单子叶甘露糖结合凝集素家族(图 2-A),定位于细胞质中。通过Blast比对和构建系统进化树(图 2-C),发现PPA2与天南星科天南星凝集素、石半夏凝集素等同源性较高,与天南星科其他凝集素序列相似性在64%-75%之间(图 2-B),因而该基因为一个新的凝集素基因。

|
| 图 1 PPA2基因RT-PCR扩增产物电泳结果 1,2 :掌叶半夏幼叶总RNA;3,4 : PPA2基因 |
|
| 图 2 PPA2蛋白生物信息学分析 AAA :东北天南星凝集素(ABY91323.1);AHA :天南星凝集素(AAP50524.1);ALA浅裂南星凝集素(AAS66304.1);AMA :海芋凝集素(ABC69036.1);CEA :芋凝集素(ABQ32294.1);PCA :石半夏凝集素(ABK88277.1);PTA半夏凝集素(AEZ35184.1);TDA :犁头尖凝集素(ABM68041.1);下同。A :PPA2编码氨基酸序列保守域;B :PPA2与其它单子叶植物甘露糖结合凝集素氨基酸序列比对;C :不同凝集素氨基酸序列同源聚类分析 |
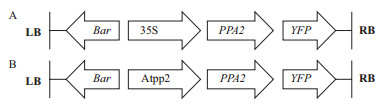
为了分析不同启动子驱动条件下PPA2基因的表达情况,分别构建含组成型CaMV 35S启动子(图 3-A)和拟南芥韧皮部特异性启动子AtPP2的植物表达载体(图 3-B)。通过NCBI查到AtPP2启动子大小为975 bp,而实验扩增大小为1 000 bp左右(图 4-A),测序后发现完全匹配。利用Gateway系统,通过重叠PCR反应将启动子与PPA2基因重叠后连接到入门载体,使用启动子上游引物和基因下游引物扩增到一大小为1 500 bp左右的片段(图 4-B),测序后发现连接成功。通过LR反应将重叠后的AtPP2-PPA2基因转入pEarleyGate-TW1植物表达载体,将PPA2基因转入pEarleyGate-101植物表达载体,进行菌落PCR鉴定(图 4-C,D),挑取阳性菌落进一步测序确证成功构建了含AtPP2和CaMV 35S启动子的植物表达载体。
|
| 图 3 载体示意图 A :CaMV 35S-PPA2载体示意图;B :AtPP2-PPA2载体示意图s |

|
| 图 4 PPA2基因的植物表达载体构建 A : PPA2基因以及AtPP2启动子扩增电泳图(1,2 : PPA2基因;3-5 : AtPP2载体);B : PPA2基因与启动子重叠PCR反应后凝胶电泳图(6,7 : AtPP2-PPA2);C :AtPP2-PPA2基因菌落PCR鉴定结果(8,10 :AtPP2-PPA2;9 :WT);D :CaMV 35S-PPA2基因菌落PCR鉴定结果(11-14 : CaMV 35S-PPA2) |
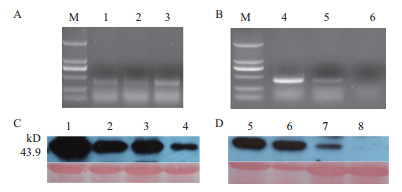
利用农杆菌介导的叶盘法侵染野生型烟草,对经Basta抗性筛选获得的再生烟草植株(图 5)进行PCR鉴定(图 6-A,B),共获得CaMV 35S启动子驱动的转基因烟草19株,AtPP2启动子驱动的转基因烟草24株。Western-blot检测PPA2基因在经PCR鉴定的转基因烟草中均能成功表达(图 6-C,D)。

|
| 图 5 转基因烟草的获得 A :农杆菌侵染后第3天;B :侵染后第35天;C :愈伤分化出幼苗;D :幼苗生根培养;E :移栽后的烟苗 |
|
| 图 6 转基因烟草T0代分子鉴定 A :CaMV 35S-PPA2基因PCR鉴定(1-3 :CaMV 35S-PPA2);B :AtPP2-PPA2基因PCR鉴定(4,5 : PPA2;6 :WT);C :转CaMV 35S-PPA2转基因烟草叶片Western-blot鉴定(1-4 :CaMV 35S-PPA2);D :转AtPP2-PPA2转基因烟草叶片Western-blot鉴定(5-7 :AtPP2-PPA2;8 :WT) |
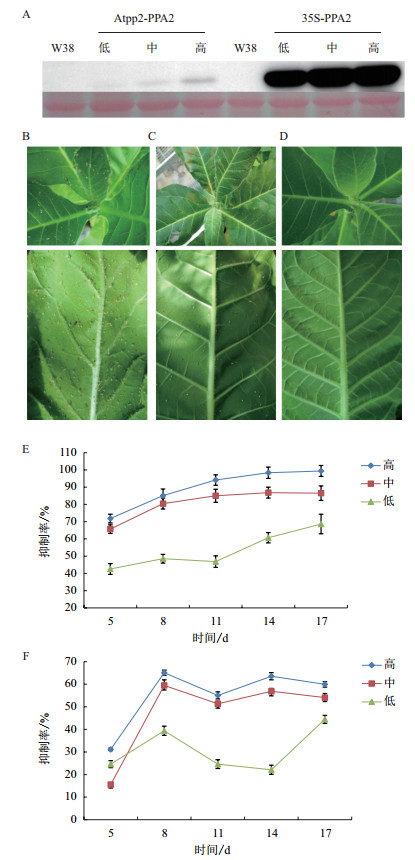
筛选获得CaMV 35S-PPA2转基因纯合株系10个;AtPP2-PPA2转基因纯合株系6个。为研究蛋白表达水平是否与抗蚜效果呈正相关,又因AtPP2启动子在韧皮部特异表达,遂选取转基因烟草各株系叶脉组织进行Western-blot检测(图 7-A),发现AtPP2启动子驱动的转基因植株蛋白表达量明显低于CaMV 35S启动子驱动的转基因植株,且各启动子驱动下不同株系之间,蛋白表达量存在明显差异。根据蛋白表达量差异,将转基因株系分为高、中、低三类进行抗蚜性试验。接种蚜虫后18 d发现野生型烟草蚜虫数目较多(图 7-B),转AtPP2-PPA2基因烟草叶片上可见一些蚜虫(图 7-C),而转CaMV 35S-PPA2基因烟草叶片上几乎没有蚜虫(7-D)。统计数据表明,CaMV 35S(图 7-E)和AtPP2启动子(图 7-F)驱动下的各转基因株系蛋白表达量高低分别与其抑蚜率强弱基本相符。CaMV 35S启动子驱动下高蛋白表达量的转基因植株抑蚜率为99.37%;中等蛋白表达量的抑蚜率为86.48%;而低蛋白表达量的抑蚜率仅为68.63%。AtPP2启动子驱动下高蛋白表达量的转基因植株抑蚜率为59.95%;中等蛋白表达量的抑蚜率为56.87%;而低蛋白表达量的抑蚜率仅为44.42%,均低于CaMV 35S启动子驱动下的转基因株系。
|
| 图 7 转基因烟草纯合植株蛋白检测及抗蚜性分析 A :转基因烟草叶脉蛋白表达检测;B :非转基因烟草;C :转ATPP2-PPA2基因烟草;D :转CaMV 35S-PPA2基因烟草;E :转CaMV 35S-PPA2基因烟草抑蚜率;F :转ATPP2-PPA2基因烟草抑蚜率 |
植物凝集素基因由于其抗虫功能,广泛应用于抗虫基因工程,其中单子叶甘露糖结合凝集素基因,由于其对蚜虫的抗性和对人及哺乳动物基本无毒性的特性受到关注,研究广泛。半夏属凝集素也属于单子叶甘露糖结合凝集素家族,抗虫效果较好[18, 19]。关于掌叶半夏凝集素(PPA)的相关研究极少,研究称将掌叶半夏球茎中的凝集素基因在烟草中表达,多拷贝插入T0代植株平均抑蚜率为90.28%[21],暗示掌叶半夏凝集素具有极高抗蚜效果,作为抗蚜候选基因,具有极高应用潜力。
本研究从掌叶半夏幼叶中克隆出一个新的掌叶半夏凝集素基因PPA2,对PPA2蛋白序列进行生物信息学分析,发现其具有一个保守结构域,包含3个甘露糖结合位点,属于甘露糖结合凝集素。分别构建CaMV 35S启动子和拟南芥韧皮部特异性启动子AtPP2驱动的重组载体,获得转基因烟草,利用筛选鉴定后得到的转基因烟草纯合植株进行抗蚜试验。相对于野生型,转基因植株均有很高的抗蚜性,CaMV 35S和AtPP2启动子驱动下的各转基因株系蛋白表达量高低分别与其抗蚜效率强弱基本相符。CaMV 35S启动子驱动下转基因植株抗蚜效率为68.63%-99.37%;AtPP2启动子驱动下高蛋白表达量的转基因植株抗蚜效率为44.42%-59.95%,均低于CaMV 35S启动子驱动下的转基因株系。这些结果表明PPA2虽比其他凝集素基因序列相比缺少一部分相对保守序列,但从功能上来看,与半夏属凝集素基因同样具有抗蚜作用。与前人研究[21]相比,我们获得的CaMV 35S-PPA2转基因植株抗蚜效率更高,表明PPA2是一个高效抗蚜基因。蚜虫为刺吸式昆虫,以吸取韧皮部汁液为食。AtPP2启动子为韧皮部特异性启动子,在韧皮部特异性表达,抗蚜效果理应高于组成型CaMV 35S启动子,而AtPP2启动子驱动的转基因植株抗蚜活性明显低于CaMV 35S启动子驱动的转基因植株。为究其原因,选取转基因烟草叶脉为材料进行Western-blot鉴定,发现其蛋白表达量远低于CaMV 35S启动子驱动的转基因植株,表明抗蚜效果与蛋白水平高低呈正相关。而蛋白表达量差异过大可能是由于试验取材部位为植株叶脉,叶脉主要由维管束及其周围包裹的结构构成,维管束包含木质部和韧皮部,韧皮部只占整个叶脉的一小部分,而AtPP2启动子只在韧皮部特异性表达,所以从蛋白结果上来看AtPP2启动子驱动的转基因植株蛋白表达量极低,而CaMV 35S启动子为组成型过表达启动子,在各个组织表达量均较高。AtPP2启动子在植物中表达量低,与许兰珍[22]研究结果相似,这也是导致抗蚜性试验中AtPP2启动子抗蚜效率低于CaMV 35S的一个可能原因,但在蛋白表达量较低的情况下,AtPP2启动子驱动的转基因烟草仍有较强的抗蚜效果,该结果为后期研究构建韧皮部特异性高效表达载体,使其在韧皮部特异性高效表达提供了研究基础。
4 结论本研究克隆到一个新的掌叶半夏凝集素基因PPA2,属于单子叶甘露糖结合凝集素家族,具有一个保守结构域。分别构建CaMV 35S启动子和拟南芥韧皮部特异性启动子AtPP2驱动的表达载体,对获得的转基因烟草进行了分子鉴定,并进一步筛选出单拷贝插入的纯合植株进行抗蚜性检测,结果表明PPA2基因抗蚜性极高。
| [1] | 周岩, 田颖川, 吴标. 转雪花莲外源凝集素基因烟草对桃蚜的抑制作用. 生物工程学报 , 1998, 14 (1) : 13–19. |
| [2] | 张广学. 中国经济昆虫志第二十五册, 同翅目, 蚜虫类[M]. 北京: 科学出版社, 1983. |
| [3] | 郑光宇. 基因工程防治蚜虫研究进展. 喀什师范学院学报 , 2006, 27 (3) : 54–60. |
| [4] | 郭洪年, 侯汉娜, 欧阳青, 等. 抗蚜基因及其转基因植物. 中国生物工程杂志 , 2008, 28 (6) : 118–124. |
| [5] | Van Damme EJM, Peumans WJ, Pusztai A, et al. Handbook of Plant lectins:properties and biomedical applieations[M]. Chichester: Published by JohnWilley and SonsLtd, 1997. |
| [6] | DamTK, Baehhawat K, Rani PG, et al. Garlie(Allium sativum)lectins bind to high mannose oligosaccharide chains. Biol Chem , 1998, 273 (10) : 5528–5535. DOI:10.1074/jbc.273.10.5528 |
| [7] | Peumans WJ, Damme EJM. Lectins as plant defence proteins. Plant Physiology , 1995, 109 (2) : 347–352. DOI:10.1104/pp.109.2.347 |
| [8] | 李凤玲, 徐培洲, 肖祎. 植物凝集素及其在抗虫基因工程中的应用. 安徽农业科学 , 2006, 34 (3) : 430–432. |
| [9] | Van Damme EJM, Allem AK, Peumans WJ. Isolation and character-ization of a lectin with exclusive specificity towards mannose from snowdrop(Galabthus nivalis)bulbs. FEBS Lett , 1987, 215 (1) : 140–144. DOI:10.1016/0014-5793(87)80129-1 |
| [10] | 王志斌, 张秀梅, 郭三堆. 在转基因植物中利用植物凝集素防治害虫的研究. 植物学通报 , 2000, 17 (2) : 108–113. |
| [11] | 徐琼芳, 田芳, 陈孝. 转GNA基因小麦新株系的分子检测和抗蚜虫性鉴定. 麦类作物学报 , 2005, 25 (3) : 7–10. |
| [12] | 张晓英, 甘敬, 尹伟伦. 国槐转雪花莲凝集素基因及抗蚜性. 吉林科学 , 2010, 46 (2) : 51–56. |
| [13] | Liu SM, Li J, Zhu JQ, et al. Transgenic plants expressing the AalT/GNA fusion protein show increased resistance and toxicity to both chewing and sucking pests. Insect Science , 2016, 23 (2) : 265–276. DOI:10.1111/ins.2016.23.issue-2 |
| [14] | Foissac X, Thi Loc N, Christou P, et al. Resistance to green leafhopper(Nephotettix virescens)and brown planthopper(Nilaparvata lugens)in transgenic rice expressing snowdrop lectin(Galanthus nivalis agglutinin; GNA). Insect Physiol , 2000, 46 (4) : 573–583. DOI:10.1016/S0022-1910(99)00143-2 |
| [15] | 肖松华, 刘剑光, 吴巧娟, 等. 转外源凝集素基因棉花对棉蚜的抗性鉴定. 棉花学报 , 2005, 17 (2) : 6–10. |
| [16] | Yao JH, Zhao XY, Liao ZH, et al. Cloning and molecular characterization of a novel lectin gene from Pinellia ternate. Cell Research , 2003, 13 (4) : 301–308. DOI:10.1038/sj.cr.7290175 |
| [17] | Yu Y, Wei ZM. Increased oriental armyworm and aphid resistance in transgenic wheat stably expressing Bacillus thuringiensis(Bt)endotoxin and Pinellia ternate agglutinin(PTA). Plant Cell Tissue and Organ Culture , 2008, 94 (1) : 33–44. DOI:10.1007/s11240-008-9384-y |
| [18] | 吴志明, 董文琦, 党志红, 等. 半夏凝集素基因克隆及其对桃蚜的抗性研究. 南京农业大学学报 , 2010, 33 (2) : 45–50. |
| [19] | Jin SX, Zhang XL, Daniell H. Pinellia ternata agglutinin expression in chloroplasts confers broad spectrum resistance against aphid, whitefly, Lepidopteran insects, bacterial and viral pathogens. Plant Biotechnology , 2012, 10 (3) : 313–327. DOI:10.1111/pbi.2012.10.issue-3 |
| [20] | Qi GF, Zhang XF, Zhao XY. Endophytic Bacillus subtilis WH2 containing Pinellia ternate agglutinin showed insecticidal activity against white backed planthopper Sogatella furcifera. Bio Control , 2013, 58 (2) : 233–246. |
| [21] | Wu ZM, Yan HB, Pan WL, et al. Transform of an ectopically expressed bulb lectin gene from Pinellia pedatisecta into tobacco plants conferring resistance to aphids(Myzus nicotianae). Australian Journal of Crop Science , 2012, 6 (5) : 904–911. |
| [22] | 许兰珍, 彭爱红, 何永睿. 异源韧皮部特异启动子在转基因枳中的表达. 园艺学报 , 2014, 41 (1) : 1–8. |





