2. 武汉大学资源与环境科学学院,武汉 430079;
3. 生物质资源化学与环境生物技术湖北省重点实验室,武汉 430079;
4. 遵义师范学院生命科学学院,遵义 563002
2. School of Resource and Environmental Sciences, Wuhan University, Wuhan 430079;
3. Hubei Biomass-Resource Chemistry and Environmental Biotechnology Key Laboratory, Wuhan 430079;
4. College of Life Science, Zunyi Normal College, Zunyi 563002
生长在重金属污染土壤中的植物,其生长受重金属的胁迫,为了维持正常生长代谢和重金属抗性机制,必须获得足够的碳源和能量。在大多数高等植物中,产自叶的光合同化物以蔗糖的形式经韧皮部转运到各个库器官中[1]。库器官对韧皮部蔗糖的卸载和利用促进蔗糖向库器官流动,因此库器官中与蔗糖卸载和利用相关的酶对调控同化物分配具有关键作用[2],然而蔗糖必须通过蔗糖合酶或转化酶水解为己糖才能被植物生长代谢所利用。液泡转化酶(vacuolar invertase,vINV),也称作可溶性酸性转化酶,最适pH为酸性(pH5.0-5.5),在水解蔗糖和应对环境胁迫等方面具有重要的作用[3],研究表明液泡转化酶参与低温、低氧、水分胁迫等环境逆境的调控过程[4]。重金属作为一种重要的环境胁迫因子,往往影响植物的生长,但关于液泡转化酶与重金属胁迫之间的关系报道较少。
大多数植物在高浓度铜含量的土壤中无法生长和繁殖,但某些植物在长期的胁迫环境下进化出铜抗性机制,能够在铜矿区或铜污染的土壤中生存,海州香薷(Elsholtzia haichowensis)便是其中的代表性植物[5]。海州香薷在非矿区也有分布,但矿区种群比非矿区种群具有更高的铜抗性,这可能是由于铜矿区的海州香薷长期生活在高浓度铜污染的环境下,发生了与铜污染相适应的抗性进化,形成了与非矿区种群不同的抗性生态型。海州香薷已逐渐成为研究植物铜吸收、耐性与解毒机理的模式植物,但其基因信息还较少报道,前期研究表明海州香薷两个不同抗性种群的液泡转化酶活性在铜胁迫下存在差异[6],而酶活性通常与基因及其表达调控过程相关,因此研究海州香薷不同抗性种群液泡转化酶基因编码的蛋白信息及在铜胁迫下的转录表达,对于进一步深入研究铜胁迫下不同抗性种群酶活性差异的分子机制具有重要的参考意义。
1 材料与方法 1.1 材料 1.1.1 试验材料海州香薷(E. haichowensis)种子分别采自湖北大冶铜绿山古铜矿遗址(抗性种群)和湖北红安(非抗性种群)。水培14 d后剪取新鲜的根尖(约2 cm)用于RNA提取,水培及铜处理均在人工培养室内进行,光周期14 h光照、10 h黑暗,光照强度122 μmol·m-2 s-1,温度控制25/15℃。
1.1.2 试剂RNA提取使用的Trizol购自Invitrogen公司;PCR反应所用的Ex Taq,dNTP mixture,pMD18-T载体,RNase Inhibitor,PrimeScript® RT reagent Kit(Perfect Real Time),SYBR®Premix Ex TaqTM(Perfect Real Time),均购自TaKaRa公司;反转录酶M-MLV RT购自Promega公司;DNA凝胶回收试剂盒和PCR清洁试剂盒为Axygen公司产品;大肠杆菌TOP10感受态细胞购自天根生化科技有限公司;其他生化试剂购自丁香园生物技术有限公司,引物由上海博道生物技术公司合成,序列测定由华大基因完成。
1.2 方法 1.2.1 海州香薷总RNA提取及cDNA合成采用Trizol法提取两个种群海州香薷根部的总RNA,具体操作步骤参照说明书。反转录酶与引物Oligo(dT)18引导cDNA第一链的合成。0.2 mL离心管中依次加入12.5 μL总RNA,3 μL Oligo(dT)18,11 μL DEPC处理的水,70℃温浴5 min,迅速置于冰上冷却,微离心收集溶液至离心管底部,再依次加入5×M-MLV RT Buffer 10 μL,RNase Inhibitor 1.5 μL,dNTP Mixture(2.5 mmol/L each)10 μL,M-MLV RT 2 μL,用移液枪吸打混匀,42℃反应60 min,70℃温浴10 min失活反转录酶,冰上分装后-20℃保存备用。
1.2.2 EhNvINV和EhCvINVcDNA全长序列克隆根据GenBank中海州香薷非抗性种群液泡转化酶基因EhNvINV(JX500755)和抗性种群转化酶基因EhCvINV(JX500756)序列,设计特异性引物V-FullF和V-FullR(表 1)。以反转录所得的cDNA为模板,进行PCR反应,反应体系为20 μL:10× Ex Taq Buffer(Mg2+ plus)2 μL,dNTP Mixture(2.5 mmol/L each)1 μL,PrimerF 1 μL,PrimerR 1 μL,cDNA 1 μL,Ex Taq 0.2 μL,ddH2O 13.8 μL。全长PCR反应程序为:94℃预变性5 min;98℃变性10 s,50℃退火15 s,72℃延伸2 min,32个循环72℃延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳检测并切胶回收、连接、转化、菌液PCR检测和阳性克隆测序。
使用NCBI网站的BLAST在线软件(http://www.ncbi.nlm.nih.gov/blast)进行海州香薷两个种群液泡转化酶基因全长序列的同源性比对分析与相似性搜索。使用ClustalX软件将海州香薷和其他物种液泡转化酶基因的氨基酸序列进行比对[7]。使用MEGA4.1软件构建海州香薷液泡转化酶基因的无根系统进化树[8]。
1.2.4 蛋白结构分析使用在线ExPASy序列分析工具(http://au.expasy.org/tools/)对推导的氨基酸序列进行分析,ProtParam分析蛋白的氨基酸序列组成、相对分子质量、等电点等理化性质。将海州香薷两个种群液泡转化酶的氨基酸序列提交至在线分析工具SWISS-MODEL(http://swissmodel.expasy.org/)进行同源建模,选择拟南芥(Arabidopsis thaliana)酸性转化酶基因AtcwINV1的3D蛋白结构(PDB:2AC1,www.pdb.org)为模板,预测海州香薷液泡转化酶蛋白EhNvINV和EhCvINV的三级结构。
1.2.5 分子模拟对接海州香薷液泡转化酶蛋白与蔗糖分子的模拟对接采用自动对接软件AutoDock4.0完成。蔗糖分子结构来自于MMsINC数据库(http://mms.dsfarm.unipd.it/MMsINC/)。选择液泡转化酶活性中心的GLU299设置为柔性残基。蛋白分子和蔗糖分子在对接过程中同时被赋予Geister Huckel电荷,Grid大小设置为26×28×28(x、y和z),格点间隔为默认值0.375 Å,Grid中心坐标设置为74.158,112.502,-4.938(x、y和z)。Number of GA Runs设置为30,其他参数均使用系统默认参数。对接过程使用拉马克遗传算法(lamarckian genetic algorithm,LGA)对结合位点进行搜索和能量评价,选择结合自由能最低的构象为最终的结合模式。同源模拟生成的PDB文件以及分子对接结果均使用PyMOL软件显示和分析。
1.2.6 Real-time PCR反应根据海州香薷EhNvINV和EhCvINV基因的序列,设计Real-time PCR的上下游引物V-rtF和V-rtR(表 1)。以EhACT为内参基因[9],设计定量PCR引物Actin-F和Actin-R(表 1)。使用StepOneTM Real-Time PCR System(Applied Bio-systems,USA)分析EhNvINV和EhCvINV在铜胁迫下的转录表达。幼苗水培10 d后进行铜处理,铜处理设对照组(不加铜)和处理组(加10 μmol/L Cu2+),Cu2+以CuCl2·2H2O的形式加入营养液中。铜分别处理1 d和7 d后收获植物,RNA提取方法同上所述,按照PrimeScript® RT reagent Kit说明书的步骤进行反转录,染料使用SYBR® Green I(TaKaRa,Japan)。反应条件如下:95℃预变性30 s后,用两步法进行扩增,即95℃变性5 s,60℃退火和延伸30 s,共40个循环,PCR扩增结束后作60-95℃的熔解曲线。所有Real-time PCR试验均设置3个生物学重复和3个操作重复。结果表示为样品基因的转录表达量相对于非抗性种群对照组表达量的倍数。反应结束后收集Ct值,基因的相对表达量采用2-△△Ct法进行计算。
2 结果 2.1 海州香薷总RNA提取海州香薷根中的总RNA经1.2%琼脂糖凝胶电泳检测呈现3条清晰的条带,其中28S rRNA的亮度约为18S rRNA的两倍,5S rRNA亮度较低,无明显降解,紫外分光光度计测定RNA样品OD260/OD280的平均值为1.91,表明所提取的总RNA质量较好,可用于反转录反应。
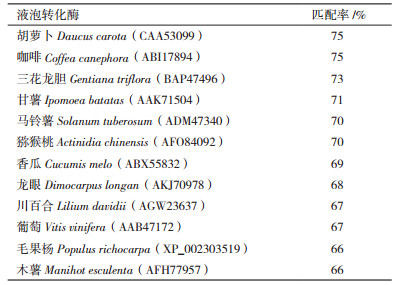
2.2 海州香薷EhNvINV和EhCvINV基因序列分析PCR扩增分别得到约1 900 bp大小条带,经测序,非抗性和抗性种群液泡转化酶基因的开放阅读框均为1 914 bp,编码637个氨基酸,EhNvINV和EhCvINV的核苷酸序列相似性为98.80%,编码的氨基酸序列相似性为99.69%。海州香薷与NCBI上公布的其他部分双子叶植物液泡转化酶氨基酸推导序列的同源性比较,见表 2。海州香薷与胡萝卜(Da-ucus carota)和咖啡(Coffea canephora)的相似性最高,达75%。
海州香薷与部分其他物种液泡转化酶基因推导的氨基酸序列的多重比对结果,见图 1。EhNvINV和EhCvINV均具有植物液泡转化酶的13个保守区域,其中包括液泡转化酶的两个最为保守的特征序列β-呋喃果糖苷基序(NDPN)和半胱氨酸残基催化区(WECVD),EhNvINV和EhCvINV具有5个糖基化位点(NXS/T)。两个不同抗性种群的液泡转化酶氨基酸序列存在趋异位点,EhNvINV的第114和346位氨基酸分别为Glu和Leu,而EhCvINV对应位点的氨基酸为Gln和Pro。这些趋异位点都位于13个保守区域外。
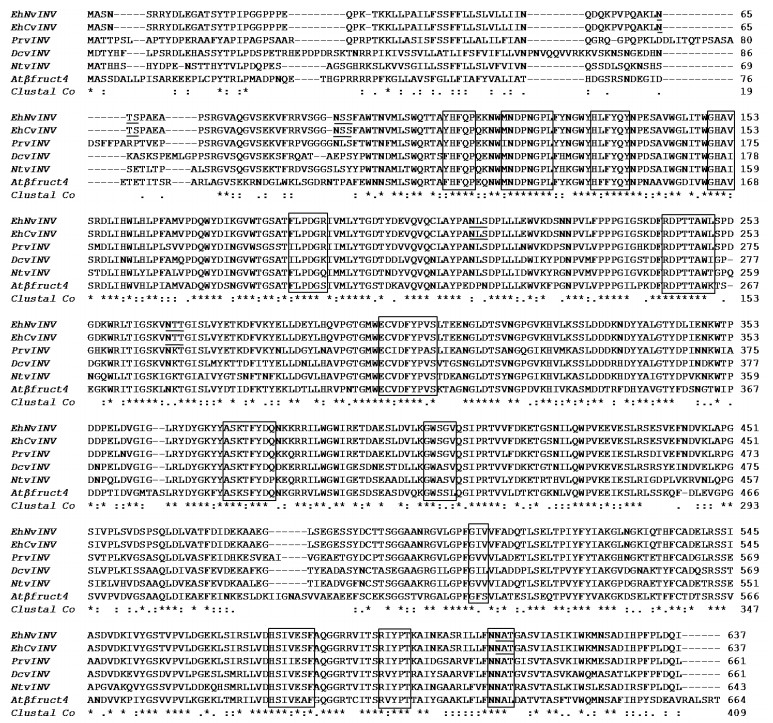
|
| 图 1 海州香薷与其他物种液泡转化酶氨基酸序列的多重比对结果 PrvINV :多枝列当液泡转化酶(Phelipanche ramosa vacuolar invertase);DcvINV :胡萝卜液泡转化酶(Daucus carota vacuolar invertase);NtvINV :烟草液泡转化酶(Nicotiana tabacum vacuolar invertase);Atβfruct4 :拟南芥液泡转化酶(Arabidopsis thaliana vacuolar invertase);方框中为植物液泡转化酶保守区域;下划线为糖基化位点 |
为进一步证实所克隆的基因属于海州香薷液泡转化酶基因,构建了与其他物种液泡转化酶、细胞壁转化酶和果糖基转移酶的无根进化树。结果(图 2)显示,进化树分为4个类群,分别为(Ⅰ)果糖基转移酶、(Ⅱ)单子叶植物液泡转化酶、(Ⅲ)双子叶植物液泡转化酶、(Ⅳ)双子叶植物细胞壁转化酶。EhNvINV和EhCvINV属于双子叶植物液泡壁转化酶。
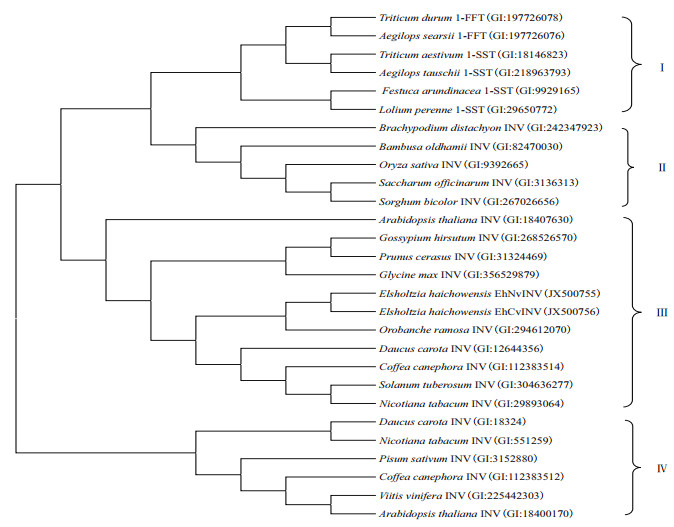
|
| 图 2 海州香薷液泡转化酶与其他植物酸性转化酶和果糖基转移酶的无根进化树分析 I :果糖基转移酶;II :单子叶植物液泡转化酶;III :双子叶植物液泡转化酶;IV :双子叶植物细胞壁转化酶 |
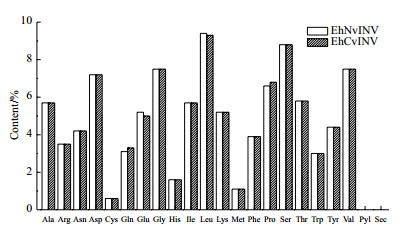
两个种群海州香薷液泡转化酶蛋白的氨基酸组成基本一致,天冬氨酸(Asp)、甘氨酸(Gly)、亮氨酸(Leu)、丝氨酸(Ser)和缬氨酸(Val)含量较高,均高于6%,无吡咯赖氨酸(Pyl)和含硒半胱氨酸(Sec)(图 3)。推导的非抗性种群液泡转化酶蛋白原子总数为9 933个,分子式C3226H4910N822O964S11,分子量为70.986 kD,理论等电点为4.89。抗性种群液泡转化酶蛋白原子总数为9 929个,分子式C3225H4907N823O963S11,分子量为70.969 kD,理论等电点为4.91。
|
| 图 3 海州香薷非抗性和抗性种群液泡转化酶蛋白氨基酸组成 Amino acid |
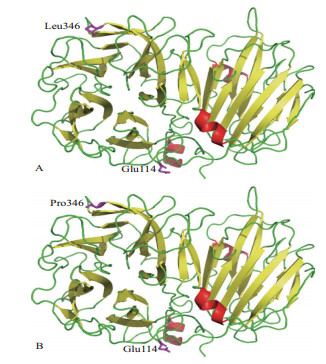
非抗性和抗性种群海州香薷液泡转化酶蛋白的3D结构相似,仅在趋异位点Glu114/Gln114和Leu346/Pro346处有细微的差别,如图 4所示。液泡转化酶蛋白由N-末端类似螺旋桨形状的β-转角结构域和C-末端的β-折叠区组成,这两个结构域由两个较短的α螺旋连接。其中N-末端的结构域由5个β转角组成,主要负责与底物蔗糖结合,是酶的催化中心,C-末端的结构域由2组反向平行的β折叠组成。
|
| 图 4 海州香薷两个种群液泡转化酶蛋白模拟3D结构 A :非抗性种群液泡转化酶蛋白3D结构;B :抗性种群液泡转化酶蛋白3D结构;红色、黄色和绿色部分分别表示α螺旋、 β折叠和环;紫色表示趋异氨基酸位点 |
本研究从液泡转化酶蛋白与底物结合的角度进行了计算机模拟分析,以EhNvINV为基础,在两个种群间的趋异位点处进行模拟定点突变,获得突变体酶蛋白分子EhNvINV-E114Q和EhNvINV-L346P,并分别与蔗糖分子进行对接。首先使用拟南芥酸性转化酶蛋白AtcwINV1(PDB ID:2AC1)[10]、突变体AtcwINV1-E203Q(PDB ID:2OXB)、AtcwINV1-E203A(PDB ID:2QQV)和AtcwINV1-D239A(PDB ID:2QQU)[11]的晶体结构模型检测海州香薷液泡转化酶蛋白与蔗糖的对接程序,确保对接结果的可靠性。
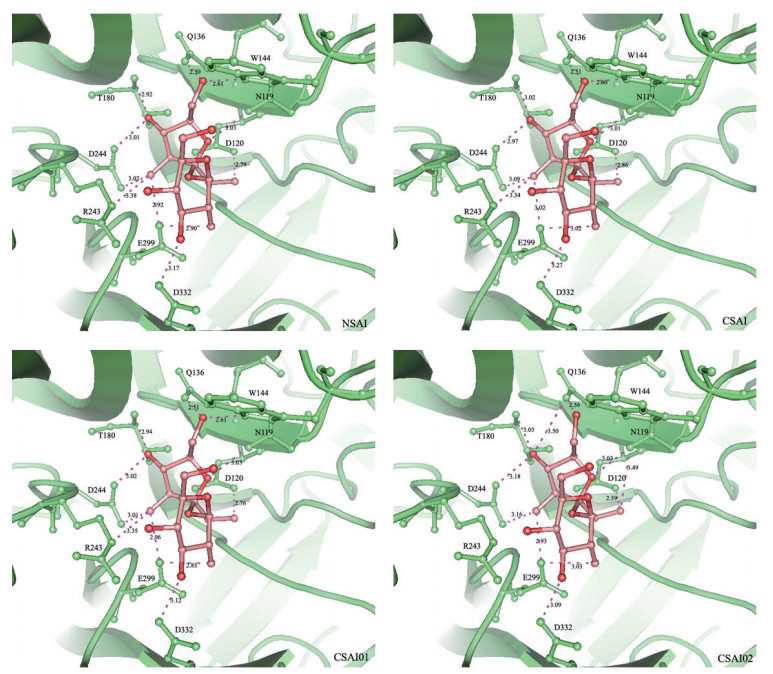
液泡转化酶与蔗糖分子的对接模拟结果(图 5)显示,蔗糖分子在EhNvINV和EhCvINV催化活性中心的构象基本一致,呋喃果糖环上的氧原子O6分别与Q136上的OE1和W144上的NE1,O4分别与T180上的N和D244上的OD1,O3分别与D244上的OD2、R243上的NE和E299上的OE2,O2与N119上的ND2,O1与D120上的OD1之间形成氢键相互作用。吡喃葡萄糖环上的O2与E299上的OE2,O3与D332上的OD2之间也形成了氢键相互作用,使蔗糖分子稳定地结合在液泡转化酶的催化活性中心。
|
| 图 5 海州香薷细胞壁转化酶蛋白及模拟突变体与蔗糖的对接模型示意图 NSAI :非抗性种群液泡转化酶蛋白与蔗糖结合示意图;CSAI :抗性种群液泡转化酶蛋白与蔗糖结合示意图;CSAI01 :模拟突变体E114Q与蔗糖结合示意图;CSAI02 :模拟突变体L346P与蔗糖结合示意图;氢键以粉色虚线显示;原子间的距离单位为Å |
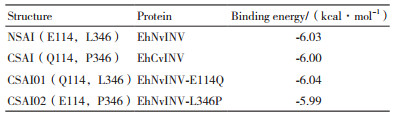
突变体EhNvINV-E114Q和蔗糖分子的对接构象与EhNvINV基本一致,而对于EhNvINV-L346P,与EhNvINV和蔗糖分子的对接构象相比较,呋喃果糖环上的氧原子O6与W144上的NE1,O3与R243上的NE无氢键相互作用,而O4与Q136上的OE1,O1与N119上的ND2之间具有氢键相互作用。EhNvINV、EhCvINV、EhNvINV-E114Q、EhNvINV-L346P与蔗糖分子的对接模型表明蔗糖分子在酶活性中心的空间位置上存在细微差异,计算机模拟对接的结合能差异较小(表 3),分别为-6.03 kcal/mol、-6.00 kcal/mol、-6.04 kcal/mol和-5.99 kcal/mol。
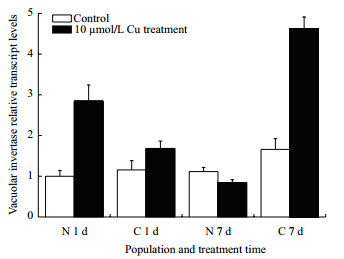
铜胁迫下海州香薷EhNvINV和EhCvINV基因相对转录表达量如图 6所示,铜处理1 d后,与对照组相比,海州香薷EhNvINV基因的转录表达量显著升高(P < 0.05),铜胁迫下,EhNvINV的转录表达量显著高于EhCvINV(P < 0.05)。铜处理7 d后,EhNvINV基因的转录表达量与对照组无显著表达差异,而EhCvINV基因的转录表达量与对照组相比显著升高(P < 0.05),且比EhNvINV基因在铜胁迫下的转录表达量高约4.5倍。
|
| 图 6 铜处理1 d和7 d后海州香薷两个种群根中EhNvINV和EhCvINV基因的相对转录表达量 N : EhNvINV; C : EhCvINV |
本研究克隆的EhNvINV和EhCvINV具有植物液泡转化酶基因的多个保守序列(图 1),包括β-呋喃果糖苷酶(NDPN)和催化区域的重要组成部分(WECP/VD)这两个最为保守的特征基序。几乎所有高等植物的液泡转化酶在催化区域的保守位点上都有一个缬氨酸(V)[12],海州香薷非抗性和抗性种群液泡转化酶(EhNvINV和EhCvINV)也同样如此。植物酸性转化酶和果糖基转移酶的同源性较高,具有相同的保守区域,如蔗糖结合基序、RDP基序和EC基序[13]。但液泡转化酶与细胞壁转化酶和果糖基转移酶的区别主要在于前者具有一些典型的特征序列,如所有双子叶植物和大部分单子叶植物的液泡转化酶在前肽区域具有一个保守序列R[G/A/P]XXXGVS[E/D/M]K,所有已知的液泡转化酶在成熟蛋白起始位点附近有一个保守序列WXXX[M/IV]LXWQ[14]。EhNvINV和EhCvINV具有这两个保存序列RGVAQGVSEK(第74-83位氨基酸)和WTNVMLSWQ(第97-105位氨基酸)。分子进化树分析也表明EhNvINV和EhCvINV属于双子叶植物液泡转化酶基因家族成员。
海州香薷非抗性种群液泡转化酶EhNvINV与抗性种群液泡转化酶EhCvINV的氨基酸序列存在两个趋异位点,这可能是由于抗性种群长期生活在铜胁迫下发生了适应性进化。研究表明氨基酸序列的改变可能会导致蛋白活性的改变,如Ritsema等[15]报道,替换洋葱(Allium cepa)液泡转化酶中的33个氨基酸(第143-175位),将会使液泡转化酶的蛋白活性从水解蔗糖变为糖基转移(把蔗糖转换成果聚糖)。NDPN基序和EC基序在转化酶中高度保守,如果将Asp23替换为Asn23,或者将Glu203替换为Ala203,转化酶将失去活性[16]。除高度保守的NDPN、RDP和EC基序外,其附近的氨基酸残基Trp82、Asp239和Lys242对于底物分子结合的稳定性也具有重要意义,这些位点的突变将改变转化酶水解蔗糖的活性参数,如Km和Kcat值[11, 17, 18]。海州香薷液泡转化酶EhNvINV和EhCvINV对应的NDPN、EC和RDP基序中3个保守的同源氨基酸分别为Asp120、Asp244和Glu299。AtcwINV1的Trp82、Asp239和Lys242同氨基酸在EhNvINV和EhCvINV中分别为Trp144、Asp332和Lys335,EhNvINV和EhCvINV的趋异氨基酸位点均不在上述活性位点或其附近。
EhNvINV和EhCvINV的2个趋异位点虽然不在活性中心,但Glu114/Gln114靠近活性中心,且Glu114/Gln114紧邻保守区域YHFQP(109-113)和WMNDPNGP(117-124)。这些氨基酸残基结构的差异可能会导致其临近区域的蛋白构象发生细微改变,而这种细微改变可能会影响到蛋白的稳定性或活性。在玉米(Zea mays)细胞壁转化酶INCW2中,C末端的一个胞嘧啶突变为胸腺嘧啶导致Pro变为Leu,尽管这个突变位点不在催化活性中心(WECPD),不在糖基化位点,也不在β-呋喃果糖基序(NDPNG)中,但突变使INCW2的蛋白活性在Incw2转录正常的情况下仅为正常值的6%,这可能是由于该位点的Pro被替换后降低了整个蛋白的稳定性[19]。计算机模拟结果(图 4)显示,海州香薷不同抗性种群液泡转化酶的趋异位点未造成蛋白构象的显著差异,分子对接结果表明EhNvINV和EhCvINV与蔗糖分子的结合构象基本一致,且与蔗糖分子对接的结合能差异较小,可能趋异的氨基酸位点对活性中心的构象没有产生影响。然而蔗糖分子与液泡转化酶蛋白催化活性中心氨基酸之间的空间距离具有细微差异(图 5),这种细微差别可能是由于趋异氨基酸的结构差异导致其附近的氨基酸残基的构象发生了改变,尽管这种改变很小,但也可能会传递至活性中心的氨基酸,从而使活性中心底物结合的口袋构象表现出细微的差异,这种构象上的细微差异是否会导致不同种群间液泡转化酶的活性表现出显著差异还需实验进行验证。
实时荧光定量PCR结果(图 6)表明,铜胁迫1 d后EhNvINV的表达显著高于EhCvINV,这可能是由于非抗性种群在受到铜胁迫后产生的应激反应,诱导液泡转化酶大量表达。铜胁迫7 d后,EhNvINV基因的表达受到抑制,这可能与液泡转化酶受多种胁迫调控相关。液泡转化酶基因的表达会受到外界环境条件的抑制,如小麦(Triticum aestivum)在受到短暂的缺水胁迫后,其花药的液泡转化酶基因Ivr5在雄性减数分裂期下调表达[20]。玉米子房在干旱胁迫下也表现出液泡转化酶mRNA表达量下降[21]。铜胁迫7 d后EhCvINV表达量显著升高,这可能是因为抗性种群在长期的铜胁迫环境下进化的抗性机制使之与非抗性种群的液泡转化酶基因表达存在差异。由于在铜胁迫下抗性种群的海州香薷需要大量的己糖提供碳源和能量用于维持胁迫响应,液泡转化酶基因可能在铜胁迫条件下对海州香薷的微进化过程中起着辅助基因的作用。因此,在海州香薷定居铜绿山高浓度铜含量环境的进化过程中,铜胁迫诱导作用可能强化了液泡转化酶基因表达的水平,从而使EhCvINV的转录表达量高于EhNvINV。环境胁迫抗性植物通常通过上调表达酸性转化酶基因,产生更多的小分子碳水化合物(葡萄糖和果糖)作为碳源和能量用于适应环境胁迫。如耐低温水稻品种R31的细胞壁转化酶基因OSINV4表达不会受到低温的抑制[22]。液泡转化酶基因在铜胁迫下的表达差异不仅在海州香薷的两个不同抗性种群中表现,在羊蹄[23]和齿果酸模[24]中也有报道,均表现为非抗性种群的液泡转化酶基因表达受到铜的抑制,而抗性种群受铜的诱导。
4 结论本研究克隆的EhNvINV和EhCvINV基因属于液泡转化酶基因家族成员,推导的蛋白序列存在2个氨基酸趋异位点,其中非抗性种群液泡转化酶EhNvINV在114和346位分别为谷氨酸和亮氨酸,而抗性种群液泡转化酶EhCvINV在这两个位点分别为谷氨酰胺和脯氨酸。
同源模拟表明二者的3D结构相似,仅在趋异位点Glu114/Gln114和Leu346/Pro346处有细微的差别。EhNvINV、EhCvINV和模拟突变体(EhNvINV-E114Q和EhNvINV-L346P)与蔗糖分子对接形成的活性中心构象基本一致,但在空间位置上存在细微差异,这些结构上的差异可能是造成两个种群细胞壁转化酶活性差异的原因之一。
铜胁迫7 d后,EhCvINV的转录表达量显著高于EhNvINV,可能是抗性种群在长期的铜胁迫环境下进化的抗性机制需要更多的己糖提供碳源和能量来维持。
| [1] | Rolland F, Baena-Gonzalez E, Sheen J. Sugar sensing and signaling in plants:conserved and novel mechanisms. Annual Review of Plant Biology , 2006, 58 (1) : 675–709. |
| [2] | Koch K. Sucrose metabolism:regulatory mechanisms and pivotal roles in sugar sensing and plant development. Current Opinion in Plant Biology , 2004, 7 (3) : 235–246. DOI:10.1016/j.pbi.2004.03.014 |
| [3] | Ruan YL, Jin Y, Yang YJ, et al. Sugar input, metabolism, and signaling mediated by invertase:roles in development, yield potential, and response to drought and heat. Molecular Plant , 2010, 3 (6) : 942–955. DOI:10.1093/mp/ssq044 |
| [4] | Albacete A, Grosskinsky DK, Roitsch T. Trick and treat:a review on the function and regulation of plant invertases in the abiotic stress response. Phyton , 2011, 50 (2) : 181–204. |
| [5] | Liu J, Xiong Z. Differences in accumulation and physiological response to copper stress in three populations of Elsholtzia haichowensis S. Water, Air, and Soil Pollution , 2005, 168 (1-4) : 5–16. DOI:10.1007/s11270-005-0215-z |
| [6] | Cai SW, Xiong ZT, Li L, et al. Differential responses of root growth, acid invertase activity and transcript level to copper stress in two contrasting populations of Elsholtzia haichowensis. Ecotoxicology , 2014, 23 (1) : 76–91. DOI:10.1007/s10646-013-1153-y |
| [7] | Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality qnalysis tools. Nucleic Acids Research , 1997, 25 (24) : 4876–4882. DOI:10.1093/nar/25.24.4876 |
| [8] | Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0. Molecular Biology and Evolution , 2007, 24 (8) : 1596–1599. DOI:10.1093/molbev/msm092 |
| [9] | 蔡深文, 熊治廷, 刘晨, 等. 海州香薷Actin基因片段克隆及表达分析. 生物技术通报 , 2015, 31 (2) : 111–115. |
| [10] | Verhaest M, Lammens W, Le Roy K, et al. X-ray diffraction structure of a cell-wall invertase from Arabidopsis thaliana. Acta Crystallographica Section D Biological Crystallography , 2006, 62 (12) : 1555–1563. DOI:10.1107/S0907444906044489 |
| [11] | Lammens W, Le Roy K, Van Laere A, et al. Crystal structures of Arabidopsis thaliana cell-wall invertase mutants in complex with sucrose. Journal of Molecular Biology , 2008, 377 (2) : 378–385. DOI:10.1016/j.jmb.2007.12.074 |
| [12] | Tymowska-Lalanne Z, Kreis M. The plant invertases:physiology, biochemistry and molecular biology. Advances in Botanical Research , 1998, 28 (3) : 71–117. |
| [13] | Ritsema T, Smeekens SCM. Engineering fructan metabolism in plants. Journal of Plant Physiology , 2003, 160 (7) : 811–820. DOI:10.1078/0176-1617-01029 |
| [14] | Van den Ende W, Michiels A, Le Roy K, et al. Cloning of a vacuolar invertase from Belgian endive leaves(Cichorium intybus). Physiologia Plantarum , 2002, 115 (4) : 504–512. DOI:10.1034/j.1399-3054.2002.1150404.x |
| [15] | Ritsema T, Hernandez L, Verhaar A, et al. Developing fructan-synthesizing capability in a plant invertase via mutations in the sucrose-binding box. Plant Journal , 2006, 48 (2) : 228–237. DOI:10.1111/tpj.2006.48.issue-2 |
| [16] | Goetz M, Roitsch T. Identification of amino acids essential for enzymatic activity of plant invertases. Journal of Plant Physiology , 2000, 157 (5) : 581–585. DOI:10.1016/S0176-1617(00)80115-7 |
| [17] | Le Roy K, Lammens W, Verhaest M, et al. Unraveling the difference between invertases and fructan exohydrolases:A single mmino acid(Asp-239)substitution transforms Arabidopsis cell wall invertase1 into a fructan 1-exohydrolase. Plant Physiology , 2007, 145 (3) : 616–625. DOI:10.1104/pp.107.105049 |
| [18] | Mátrai J, Lammens W, Jonckheer A, et al. An alternate sucrose binding mode in the E203Q Arabidopsis invertase mutant:An X-ray crystallography and docking study. Proteins:Structure, Function, and Bioinformatics , 2008, 71 (2) : 552–564. DOI:10.1002/(ISSN)1097-0134 |
| [19] | Carlson SJ, Shanker S, Chourey PS. A point mutation at the Miniature1 seed locus reduces levels of the encoded protein, but not its mRNA, in maize. Molecular and General Genetics MGG , 2000, 263 (2) : 367–373. DOI:10.1007/s004380051180 |
| [20] | Koonjul PK, Minhas JS, Nunes C, et al. Selective transcriptional down-regulation of anther invertases precedes the failure of pollen development in water-stressed wheat. Journal of Experimental Botany , 2005, 56 (409) : 179–190. |
| [21] | Andersen MN, Asch F, Wu Y, et al. Soluble invertase expression is an early target of drought stress during the critical, abortion-sensitive phase of young ovary development in maize. Plant Physiology , 2002, 130 (2) : 591–604. DOI:10.1104/pp.005637 |
| [22] | Oliver SN, Van Dongen JT, Alfred SC, et al. Cold-induced repression of the rice anther-specific cell wall invertase gene OSINV4 is correlated with sucrose accumulation and pollen sterility. Plant, Cell and Environment , 2005, 28 (12) : 1534–1551. DOI:10.1111/pce.2005.28.issue-12 |
| [23] | Huang WX, Cao Y, Huang LJ, et al. Differential expression of acid invertase genes in roots of metallicolous and non-metallicolous populations of Rumex japonicus under copper stress. Chemosphere , 2011, 84 (10) : 1432–1439. DOI:10.1016/j.chemosphere.2011.04.053 |
| [24] | Cai SW, Huang WX, Xiong ZT, et al. Comparative study of root gro-wth and sucrose-cleaving enzymes in metallicolous and non-metallicolous populations of Rumex dentatus under copper stress. Ecotoxicology and Environmental Safety , 2013, 98 (11) : 95–102. |