2. 中国农业科学院甘蔗研究中心 农业部广西甘蔗生物技术与遗传改良重点实验室 广西甘蔗遗传改良重点实验室,南宁 530007
2. Sugarcane Research Center, Chinese Academy of Agricultural Sciences/ Key Laboratory of Sugarcane Biotechnology and Genetic Improvement(Guangxi), Ministry of Agriculture/ Guangxi Key Laboratory of Sugarcane Genetic Improvement, Nanning 530007
甘蔗是我国乃至世界重要的糖料作物,也是重要的生物能源作物。甘蔗作为广西农业主要的经济作物之一,对农民增收起重要的推动作用。但广西地区甘蔗大部分种植于耕作层浅薄且缺乏灌溉条件的丘陵旱坡地上,而由于气候变化异常,尤其是季节性干旱给甘蔗生产造成巨大的损失[1]。研究表明,甘蔗是喜硅(Si)作物,施用适量Si能促进甘蔗的光合作用[2],提高甘蔗产量和糖分含量[3],增强甘蔗抗逆性及对土壤具有一定的改良作用[4],但迄今未见有关硅增强甘蔗抗旱性分子机理研究的报道。
低分子量热激蛋白(small heat shock proteins,sHSP)在原核生物和真核生物中广泛存在,热激蛋白早期研究证实与高温胁迫有关[5],随着研究的深入,低温、氧化剂、干旱胁迫也可诱导sHSP基因的表达,说明sHSP与植物的逆境胁迫存在一定的关系,是植物在逆境下产生的应激蛋白[6]。向日葵在水分胁迫时HSP被大量表达,并与水分丧失呈正相关关系[7];转sHSP17.7水稻干旱处理后植株存活率高达70%[8];拟南芥干旱敏感突变株小分子热激蛋白基因HSP17.4表达量很低,热诱导后则大量表达,并提高了抗旱性[9]。目前已从玉米[10]、花生[11]、杧果[12]、小麦[13]、巴西橡胶树[14]等植物中克隆出了热激蛋白,但还未见甘蔗小分子热激蛋白基因的克隆研究报道。为此,本研究利用RT-PCR克隆了甘蔗sHSP基因,通过荧光定量技术初步探明HSP基因在甘蔗干旱胁迫下的表达情况,旨为深入探索HSP基因在甘蔗抗旱分子机理研究提供证据。
1 材料与方法 1.1 材料 1.1.1 植物材料选取新台糖22号(ROC22)为研究材料,沙培幼苗长至2-3片真叶后,选取长势健壮且生长一致的幼苗,转移到不透光的塑料箱中,每箱装有25 L硅浓度为1.7 mol/L的1/2 Hoagland营养液(营养液pH用H2SO4稀溶液调至5.8)。当幼苗在含硅的1/2 Hoagland营养液中生长至5-6片真叶时,加入200 g/L的PEG-6000进行模拟干旱胁迫(Si+PEG)。以不加硅的1/2 Hoagland营养液培养的苗进行模拟干旱处理设为PEG,无硅和模拟干旱胁迫的为对照(CK),分别在模拟干旱处理0、18、40、63、96和144 h取样(+1叶),将采好的样品立即保存于-80℃冰箱备用。
1.1.2 试剂大肠杆菌DH5α、BL21、pMD18-T载体、凝胶回收试剂盒购自Bioer公司;M-MLV逆转录酶、均购自TaKaRa宝生物工程有限公司(中国大连)公司,dNTP、Taq DNA聚合酶、硅酸钠购自上海生工,Trizol购自Invitrogen公司。
1.2 方法 1.2.1 总RNA提取及cDNA合成提取甘蔗叶片总RNA,具体参照Invitrogen公司的Trizol说明书,cDNA合成用M-MLV逆转录酶,逆转录引物为Oligo(dT)18:5'-GGCCACGCGTCG ACTAGTAC(T)18-3',具体步骤按说明书进行,完成后取5 μL PCR产物用1%琼脂糖凝胶电泳检查并用紫外分光光度计检测cDNA浓度,最后将各处理cDNA浓度稀释至同一浓度。
1.2.2 HSP基因的克隆依据GenBank数据库中已知的高粱、玉米、水稻、小麦等植物sHSP基因的核酸序列为参照,利用DNAMAN软件在基因起始密码子位置设计HSP基因上游简并引物HSP:5'-ATGTCGCT(C/G)GTGAG(G/T)CGCAGCA(A/G)CG-3',下游引物为逆转录加尾引物3 side:5'-GGCCACGCGTCGACTAGTAC-3'。
扩增甘蔗HSP基因的PCR体系为25 μL,模板以不同处理的cDNA等量混合样。PCR扩增参数为:95℃ 5 min;95℃ 40 s,58℃ 45 s,72℃ 2 min,共35个循环;72℃延伸10 min。PCR结束后加2 μL核酸染料混匀后经1.5%的琼脂糖凝胶电泳检测,检测条带大小正确后,回收纯化目的条带,连接到pMD18-T载体,热激转化感受态细胞大肠杆菌DH5α,通过蓝白斑筛选挑取白色菌落,经菌液PCR验证为阳性克隆子后送上海生工测序,测序结果经拼接后在NCBI BLAST进行比对。
1.2.3 HSP基因生物信息学分析用BioXM2.6软件推导该基因氨基酸序列,在NCBI的BLAST上进行相似性比对;Clustalx软件进行多重序列比对;MEGA6软件构建进化树;在线网站(http://isoelectric.ovh.org/)预测甘蔗HSP的蛋白质分子量和等电点;用WoLF PSORT在线软件对该基因进行亚细胞定位;用SOSUI signal软件预测基因的信号肽;ExPASy Proteomics Server预测蛋白质的亲水性和跨膜结构;SOPMA软件预测基因的二级结构。
1.2.4 HSP基因的表达分析根据获得的甘蔗HSP基因的开放阅读框序列设计实时荧光定量引物HSPQF:5'-AGCATCCAGATCTCCGGTTG-3'、HSPQR:5'-GACATACCAAAGCAGAGTAACCA-3';以甘蔗管家基因25S作内参,设计内参引物25S F:5'-GCAGCCAAGCGTTCATAGC-3'、25S R:5'-CCAGCTCACGTTCCCTATTG-3',实时荧光定量PCR在ABI Stepone plus型荧光定量PCR仪上进行,PCR反应体系为20 μL,具体方法参照天根公司荧光定量试剂盒Real Master Mix(SYBR GreenⅠ)说明书。PCR扩增参数为:95℃ 10 min;95℃ 15 s,60℃ 1 min,72℃ 30 s,共40个循环。所有样品在同一台PCR仪上进行扩增,每个样品重复3次,根据荧光PCR扩增CT值,按照2-ΔΔCt法计算出基因相表达量。
2 结果 2.1 sHSP基因全长cDNA克隆以甘蔗品种ROC22幼苗在模拟干旱处理条件下,样品叶片的混合RNA逆转录cNDA为模板,用简并引物HSP和3 side进行PCR扩增,产物经琼脂糖凝胶电泳检测结果(图 1)显示,从cDNA中扩增得到长约600 bp的条带。对得到的序列(登录号为JQ712579)通过GenBank Blast搜索比对,显示结果为小分子量热激蛋白(sHSP)。sHSP全长659 bp,包含启始密码ATG和终止密码TGA,为sHSP基因全长序列。该基因cDNA包含一个459 bp(从第1-459 bp)的完整开放阅读框(Open reading frame,ORF),编码152个氨基酸,还包含200 bp的3'非编码区,该区域有个19 bp ployA尾巴。

|
| 图 1 甘蔗sHPS序列扩增结果 |
用在线网站(http://isoelectric.ovh.org/)预测sHSP基因所编码的氨基酸序列的蛋白质分子量为17.15 kD,等电点为5.83。sHSP亚细胞定位于细胞质。SOSUIsignal软件预测sHSP的信号肽,显示该基因不含信号肽,为可溶性蛋白;sHSP疏水性预测最小值为-4.5,最大值为4.5,sHSP无跨膜区域。在氨基酸组成中,部分氨基酸使用频率较高,如Val、Glu、Ser分别占总氨基酸的13.60%、10.53%和9.87%,一些出现频率则较低,如His、Cln和Trp仅占1.97%、1.32%和1.32%。利用SOPMA软件完整的预测sHSP的二级结构,结果显示,出现38个α-螺旋占25.00%,随机卷曲43个占48.03%,延伸链占21.05%,β-转角(5个)只占5.92%。另外sHSP序列没有糖基化位点,有6个丝氨酸和2个苏氨酸磷酸化位点。
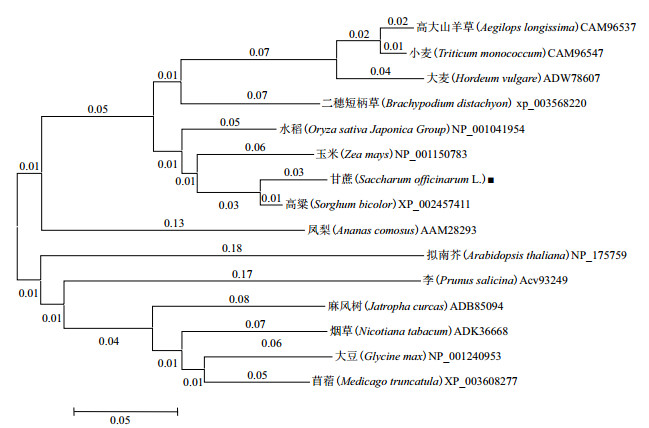
甘蔗sHSP基因的氨基酸序列与其它物种同源性比较发现,除N端45个氨基酸序列的保守性较低外,在热激蛋白功能区域非常保守,说明sHSP在进化过程中相当保守。利用NCBI Blast检索甘蔗sHSP基因核苷酸序列和编码氨基酸序列同源的物种,结果(图 2)显示,甘蔗sHSP基因与其它物种的核苷酸序列的同源性在79%-96%,与高粱最高为96%,其次是玉米93%。sHSP基因氨基酸序列与其它物种相比同源在69%-96%之间,其中与大豆的同源性最低为69%,与高粱的同源性最高为96%,其次是玉米为89%。不同物种sHSP基因序列的同源性较高,说明sHSP基因在进化过程中相当保守。用MEGA软件,选择Neighbor-Joining方法构建sHSP蛋白基因氨基酸序列进化树,结果(图 3)显示,甘蔗sHSP与高粱的进化关系最近,与李、拟南芥等物种sHSP进化关系较远。

|
| 图 2 八种植物sHSP氨基酸序列多重比对 |
|
| 图 3 甘蔗sHSP基因与其它物种的同源性分析 |
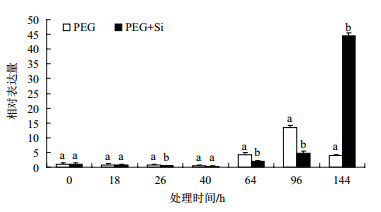
以甘蔗管家基因25S作为内参,利用荧光定量技术分析了sHSP基因在甘蔗不同处理干旱胁迫下叶中的转录水平,结果(图 4)发现在干旱胁迫40 h之前两个处理的sHSP表达量表现一样,都出现缓慢下降,但同一处理不同时间之间该基因的表达量有显著差异,在处理40 h干旱胁迫比对照减少了55.0%,硅加模拟干旱胁迫比对照减少了94.0%,但两个处理模拟干旱胁迫40 h后sHSP的表达量都显著升高,模拟干旱胁迫处理64和96 h时分别比对照升高了4.18和13.56倍,并在干旱胁迫144 h时迅速下降;而硅加干旱胁迫虽然在处理40 h后sHSP的表达量也迅速增加,但速度较慢,在处理64和96 h时分别比对照升高了2.02和4.80倍,在处理144 h时才出现最大值,比对照增加了44.64倍。这说明sHSP受到了模拟干旱胁迫的诱导表达,与干旱胁迫有一定的关系,另外干旱胁迫加硅比干旱处理推迟sHSP表达峰值出现的时间,说明硅在一定程度上能够提高甘蔗抗旱性。
|
| 图 4 荧光定量PCR检测sHSP基因在甘蔗水分胁迫中的表达 同一时间点内标有不同字母表示处理间在0.05水平上差异显著 |
热激蛋白是一类植物体受到逆境胁迫时诱导合成的应激蛋白。热激蛋白按分子量的大小分为:HSP110、HSP90、HSP70、HSP60和smHSP(small HSP,15-30 kD)5个家族。对HSP功能的研究一直是热点,特别是热激蛋白在高温及低温胁迫下的功能研究。其功能主要参与细胞内蛋白质的重新折叠、加工、稳定、转运及蛋白质变性后的复性、胞内运输、降解,以及修复受损的蛋白质等,维持胞内环境的稳定,从而保护植物细胞免受进一步的损伤,对减轻逆境引起的伤害有很大的作用[15, 16]。
本研究以甘蔗为材料,克隆了甘蔗sHSP基因全长,通过与其它物种的序列比对发现,该基因与其它物种的氨基酸序列高度保守同源性高达69%-96%,大部分都高于75%,进一步说明HSP基因在进化中高度保守[17]。对该基因编码的氨基酸序列功能预测显示,有个酪蛋白激酶Ⅱ磷酸化位点SSTD,已有研究表明细胞质sHSP在应激激酶通路中具有抑制作用,能削弱逆境胁迫中依赖于ASK1的细胞凋亡[18]。在序列中还发现6个丝氨酸和2个苏氨酸磷酸化位点,根据Abravaya[19]提出的HSF活化的反馈调控模型,认为胁迫条件使HSF-HSP70复合体解离,HSF以单体形式被Ser/ Thr激酶磷酸化形成同源三聚体,经一系列转运、结合、转录后使HSP的合成重新处于动态平衡。该基因在N末端出现一个细菌免疫球蛋白样结构域MSLV,37-83位氨基酸序列发现一个MVP重复序列,虽然目前已经知道所有的HSF都具有这个保守的特征以及3个HSF成员抗原抗体反应不同,但还不清楚它们是受何种信号激活。
为进一步研究甘蔗sHSP基因在干旱胁迫下的表达模式,本研究从mRNA水平上对转录特性进行分析,表明sHSP基因在转录水平受到了干旱胁迫的诱导,在对照sHSP有一定的表达,可能是植物在外界生长环境中或多或少的受到一些因素的影响所致,之后两个处理sHSP的表达量缓慢下降,说明甘蔗本身在干旱胁迫下有一定的适应能力,短期的干旱胁迫能提高甘蔗的耐旱性。在本研究条件下,甘蔗用PEG6000进行模拟干旱处理40 h,对提高甘蔗的耐旱性有一定的促进作用。之后幼苗sHSP的表达量急剧上升,说明甘蔗幼苗已受到了干旱胁迫的伤害,sHSP表达的上升是对干旱胁迫作出的应答反应,热激蛋白上升能有效阻止蛋白质的变性,帮助变性蛋白重新折叠,恢复其功能。另外,HSP能促进细胞骨架形成,保护细胞结构稳定,减轻对膜的损伤和细胞脱水,从而减轻细胞受损程度[20, 21]。单独干旱胁迫在处理96 h时sHSP的表达量达到最大,之后急剧下降,推测这时甘蔗对干旱胁迫的防御能力已逐渐丧失。而加硅后干旱胁迫直到处理144 h才急剧上升达到处理的最大值,说明硅处理能提高甘蔗的耐旱能力。黄海荣等[4]、江泽普[22]、曾宪录等[23]先后报道施硅肥能增强甘蔗光合作用。我们推测,施硅后能使硅在甘蔗叶片中沉积,从而提高细胞水势,防止水分流失,使叶片更直立,改善光合作用从而提高甘蔗的抗旱性[24]。在干旱胁迫下,sHSPs具有保护电子传递链稳定和增加光系统Ⅱ稳定性的作用,从而提高甘蔗光合作用和呼吸作用,稳定膜结构,提高甘蔗耐旱能力[25, 26]。另外,大量的研究证明,热激能使细胞内Ca2+浓度升高,CaM活性增加,促进CaM基因的表达,并提出一条新的热激信号转导途径(钙-钙调素途径),而Ca2+和CaM可能是热激信号转导途径中的主要上游组分[27]。施硅肥能促进甘蔗对Ca、Mg、Mn等元素的吸收,是否甘蔗在施硅后通过这条信号转导途径来提高甘蔗耐旱性,有待进一步的研究。
4 结论获得的sHSP基因cDNA长度为659 bp,包括1个459 bp的开放阅读框,编码132个氨基酸,具有典型的HSP结构域。HSP基因在甘蔗干旱胁迫过程中起到增强甘蔗耐旱时间,提高抗旱性的作用。该基因GenBank登录号为JQ712579。
| [1] | 李杨瑞, 杨丽涛. 20世纪90年代以来我国甘蔗产业和科技的新发展. 西南农业学报 , 2009, 22 (5) : 1469–1476. |
| [2] | 黄海荣, BokhtiarSM, 徐林, 等. 硅肥对甘蔗光合特性和产量的影响. 广西农业科学 , 2009 (12) : 1564–1569. |
| [3] | 蒋雄英, 陈桂芬, 尹辉, 等. 硅肥对甘蔗的生长、产量和品质的影响. 西南农业学报 , 2014 (6) : 2460–2464. |
| [4] | 黄海荣, 徐林, BokhtiarSM, 等. 硅肥对蔗地土壤性状、甘蔗叶片营养及产量的影响. 南方农业学报 , 2011, 42 (7) : 756–759. |
| [5] | Sanmiya K, Suzuki K, Egawa Y, et al. Mitochondrial small heat-shock protein enhances thermo tolerance in tobacco plants. PEBS Lett , 2004, 557 (1-3) : 265–268. |
| [6] | Maimbo M, Ohnishi K, Hikichi Y, et al. Induction of a small heat shock protein and its functional roles in nicotiana plants in the defense Response against Ralstonia solanacearum. Plant Physiology , 2014, 145 (4) : 1588–1599. |
| [7] | Almoguera C, Jordano J. Developmental and environmental concurrent expression of sunflower dry-seed-stored low-molecular-weight heat-shock protein and Lea mRNAs. Plant Mol Biology , 1992 (19) : 781–792. |
| [8] | Sato Y, Yokoya S. Enhanced tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein, sHSP17. Plant Cell Reports , 2008, 27 (2) : 329–334. DOI:10.1007/s00299-007-0470-0 |
| [9] | Wehmeyer N, Vierling E. The expression of small heat shock proteins in seeds responds to discrete developmental signals and suggests a general protective role in desiccation tolerance. Plant Physiology , 2000, 122 (4) : 1099–1108. DOI:10.1104/pp.122.4.1099 |
| [10] | 孙爱清, 葛淑娟, 董伟, 等. 玉米小分子热激蛋白ZmHSP17.7基因的克隆与功能分析. 作物学报 , 2015 (3) : 414–421. |
| [11] | 李翠, 侯蕾, 任丽, 等. 花生热激蛋白AhHSP70与热激因子AhHSF基因的克隆及表达分析. 山东农业科学 , 2015 (4) : 1–7. |
| [12] | CAN Van Toan, 罗 聪, 董 龙, et al. 杧果低分子量热激蛋白基因MiHSP17.6的克隆及表达分析. 园艺学报 , 2014 (12) : 2388–2392. |
| [13] | 安艳秋, 蔺瑞明, 冯晶, 等. 小麦热激蛋白基因TaHSP70克隆及其在植物防卫和抗逆反应中的表达分析. 分子植物育种 , 2011 (4) : 402–409. |
| [14] | 李德军, 郭会娜, 邓治, 等. 巴西橡胶树sHSP23.8基因的克隆、生物信息学及表达分析. 植物生理学报 , 2015 (11) : 1955–1962. |
| [15] | 栗振义, 龙瑞才, 张铁军, 等. 植物热激蛋白的研究进展. 生物技术通报 , 2016, 32 (2) : 7–13. |
| [16] | Timperio AM, Egidi MG, Zolla L. Proteomics applied on plant abiotic stresses:Role of heat shock proteins(HSP). Journal of Proteomics , 2008, 71 (4) : 391–411. DOI:10.1016/j.jprot.2008.07.005 |
| [17] | Al-Whaibi MH. Plant heat-shock proteins:a mini review. Journal of King Saud University-Science , 2011, 23 (2) : 139–150. DOI:10.1016/j.jksus.2010.06.022 |
| [18] | Park HS, Cho SG, Kim CK, et al. Heat shock protein HSP72 is a negative regulator of apoptosis signal regulating kinase 1. Mol Cell Biol , 2002, 22 (22) : 7721–7730. DOI:10.1128/MCB.22.22.7721-7730.2002 |
| [19] | Abravaya K, Phillips B, Morimoto RI. Heat shock-induced interactions of heat shock transcription factor and the human HSP70 promoter examined by in vivo footprinting. Mol Cell Biol , 1991, 11 (1) : 586–592. DOI:10.1128/MCB.11.1.586 |
| [20] | Waters ER. The evolution, function, structure, and expression of the plant sHSPs. Journal of Experimental Botany , 2013, 64 (2) : 391–403. DOI:10.1093/jxb/ers355 |
| [21] | Hilton GR, Lioe H, Stengel F, et al. Small heat-shock proteins:paramedics of the cell. Topics in Current Chemistry , 2013 (328) : 69–98. |
| [22] | 江泽普, 廖青, 韦广泼, 等. 硅磷互作对甘蔗生长及产量效应研究. 南方农业学报 , 2011, 42 (9) : 1091–1095. |
| [23] | Sanmiya K, Suzuki K, Egawa Y, et al. Mitochondrial small heat-shock protein enhances thermo tolerance in tobacco plants. PEBS Lett , 2004, 557 (1-3) : 265–268. |
| [24] | 曾宪录, 梁计南, 谭中文. 硅肥对甘蔗叶片一些光合特性的影响. 华中农业大学学报 , 2007, 26 (3) : 330–334. |
| [25] | Low D, Brandle K, Nover L, et al. Cytosolic heat-stress proteins HSP17.7 class 1and HSP17.3 class 11 of tomato act as molecular chaperones in vivo. Planta , 2000, 211 (4) : 575–582. DOI:10.1007/s004250000315 |
| [26] | Heekathom SA, Downs CA, Sharkey TD, et al. The small methionine-rich chloroplast heat-shock protein protest photosystem Ⅱ electron transport during heat stress. Plant Physiol , 1998, 116 (l) : 439–444. |
| [27] | Sangster TA, Queitsch C. The HSP90 chaperone complex, an emerging force in plant development and phenotypic plasticity. Current Opinion in Plant Biology , 2005, 8 (1) : 86–92. DOI:10.1016/j.pbi.2004.11.012 |




