RbcS是编码核酮糖1,5-磷酸羧化酶(Rubisco)小亚基的基因,这种酶能催化二氧化碳的固定和碳氧化间竞争反应[1],其活性是限制这两个竞争反应速率的关键因素[2]。Rubisco蛋白是由大亚基和小亚基组成,小亚基能调控大亚基的表达[3]。对于不同的物种来说,编码小亚基(RbcS)的基因家族成员个数和类型存在一定差异,有2-22个不等[4-7]。RbcS家族中不同成员基因的表达情况受多种因素的影响,如物种,组织器官类型等[7-9]。RbcS基因的总转录水平与Rubisco蛋白的含量具有高度相关性[7, 10]。Rubisco蛋白的活性主要受大亚基调控,但其多个小亚基对于蛋白活性也有一定的影响[11-13]。前人研究发现RbcS基因对环境的变化有一定的响应。当降低光照强度时,黄瓜叶片中RbcS的转录水平和Rubisco总蛋白活性都呈现明显下降趋势[14]。外源性的施加ABA或者萎蔫胁迫下时,拟南芥中rbcS的转录水平均表现为下降,4℃胁迫处理4 h时rbcS的表达量会上升[15]。大豆Rbcs基因含有3个不同成员,对水杨酸、盐胁迫和干旱处理均具有明显的响应。但不同浓度的水杨酸和NaCl处理对Rbcs基因的转录有不同程度的影响[16]。在烟草中转入天山雪莲sikRbcs2基因提高了烟草对于低温的耐受性[17]。说明RbcS基因表达调控与植物抗逆性有一定的关联。
青杄(Picea wilsonii)属于松科(Pinaceae)云杉属(Picea)多年生木本针叶树种,在干旱、阴冷等恶劣环境中具有较强的适应和生存能力。由于木本植物的生活史长且遗传背景复杂,对于针叶树种进行的生物学研究比较少。本研究通过RACE-PCR的方法,克隆PwRbcS基因的全长cDNA序列,分析PwRbcS的分子组成和理化性质,并且预测其蛋白质二级、三级结构等。同时利用荧光定量PCR技术检测其在青杄不同组织中的表达情况,以及在ABA、NaCl、PEG、冷热等处理下PwRbcS的表达情况,旨在为林木中RbcS基因的功能研究奠定基础,为筛选优质的林木基因以及林木遗传育种等提供理论依据。
1 材料与方法 1.1 材料本实验中以青杄(Picea wilsonii Mast)茎、针叶(幼叶和成熟叶)、花粉、种子、果实以及12周大的青杄幼苗作为实验材料,其中花粉、种子、果实采于中国科学院北京植物所植物园。成熟叶(多年生青杄的多年生针叶)、幼叶(多年生青杄的一年生针叶)、茎(多年生青杄的多年生茎)采于北京林业大学校园内。青杄种子春化后,置于湿润的滤纸上,在种子萌发后,将其移栽到湿润的草炭土与珍珠岩(体积比为1:1)混合基质,培养幼苗的温室相对湿度为60%-70%,日照时间为16 h。生长至12周、长势一致的青杄幼苗用于胁迫及激素响应实验。
1.2 方法 1.2.1 青杄PwRbcS全长cDNA的获得及PwRbcS基因的克隆 1.2.1.1 全长cDNA的获得通过RACE-PCR的方法,根据前期构建好的青杄均一化cDNA文库[18],从pDONR222载体和分析获得的PwRbcS的EST序列设计RACE引物,分别使用引物5'RACE-F和5'RACE-R扩增5'方向获得5'PCR产物,使用3'RACE-F和3'RACE-R扩增3'方向的序列获得3'PCR产物(表 1)。通过胶回收构建到pEASY-T1载体上,转入大肠杆菌测序后获得PwRbcS的末端序列,与EST序列拼接后获得PwRbcS全长cDNA序列。
取正常生长的12周大青杄幼苗5株,按照艾德莱生物公司植物RNA提取试剂盒的操作方法获得青杄的总RNA,利用天根生化科技的cDNA第1条链合成试剂盒反转录获得其cDNA模板备用。
将RACE-PCR获得的cDNA序列全长,利用DNAMAN6.0软件导入,分析获得PwRbcS的编码区序列,分别从其编码区的两端设计克隆引物RbcS-F,RbcS-R。利用引物RbcS-F和RbcS-R(表 1),青杄的cDNA模板,通过PCR克隆得到PwRbcS的CDS序列,PCR反应程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,35个循环;72℃延伸10 min。将PCR产物通过胶回收,构建于pEASY-T1载体上保存。
1.2.2 生物信息学分析将PwRbcS的cDNA全长导入到DNAMAN软件,通过软件上的翻译功能推导出PwRbcS的ORF,并进一步将核苷酸序列翻译成氨基酸序列;通过NCBI上的BLAST功能找出同源序列,运用ClustalX软件将同源的氨基酸序列进行多序列比对,并利用MEGA5.0软件中的邻连法(Neighbour-joining)构建系统发育树,bootstap检测次数为1 000次;利用NCBI的保守域数据库对目的基因的结构域进行预测;蛋白的理论等电点与分子量利用ExPASy中的Compute pI/Mw工具来计算;用Prot-Scale和TMHMM工具进行疏水性分析和预测该蛋白是否存在跨膜结构;利用GOR4和SWISS-MODEL在线分析工具二、三级蛋白结构。
1.2.3 组织特异性表达及胁迫响应实验 1.2.3.1 组织特异性表达实验中分别提取茎、幼叶、成熟叶、花粉,果实、种子的总RNA,反转录合成cDNA第1条链,将反转录后的cDNA模板浓度调整一致后在Step One Plus Real Time RT-PCR仪器上进行RT-qPCR实验,以检测PwRbcS基因在不同组织的相对表达量。其中提取RNA的试剂盒采用的是艾德莱生物公司的植物RNA提取试剂盒,反转录试剂盒(cDNA第1条链合成试剂盒)和荧光定量PCR试剂盒(SYBR Green SuperReal Premix)均购于天根公司。用于RT-qPCR的引物分别为RbcS-RT-F和RbcS-RT-R(表 1),实验中以青杄的EF1-α-F和EF1-α-R作为内参基因[19],实验程序采用两步法:95℃ 15 min;95℃ 3 s,60℃ 30 s,循环次数为40次。实验设置3次重复。
1.2.3.2 逆境胁迫及激素响应实验逆境处理和激素响应实验中采用12周大正常生长的青杄幼苗,实验方法具体参照[20-23],处理浓度和时间略有改动。实验中使用的处理溶液包括100 μmol/L ABA溶液、200 mmol/L NaCl溶液,20% PEG 4000溶液,温度逆境胁迫中主要采用了4℃、42℃处理,对照为水处理的植株。实验方法是将12周苗龄的青杄幼苗根浸入处理溶液,实验处理时间为0、2、4、6、8和12 h,处理后的青杄幼苗置于液氮中速冻,于-80℃保存,用于响应实验分析。实验设置3次重复。
1.2.3.3 数据处理方法组织特异性表达,逆境胁迫以及激素响应实验数据作图均采用Microsoft Excel 2007,数据处理使用SPSS19.0软件,差异显著性分析使用方法为单因素方差分析,多重比较方法为LSD(Least-significant difference)法。
2 结果 2.1 青杄PwRbcS全长cDNA的获得以青杄的cDNA为模板,利用青杄EST序列分析库中PwRbcS的EST序列和pDONR222载体两端设计特异引物分别进行5'端和3'端的RACE-PCR。PCR扩增产物通过胶回收,连接pEASY-T1载体,转入大肠杆菌送去测序,将测序结果序列与EST序列进行比对和拼接,得到青杄PwRbcS全长cDNA。结果(图 1)表明PwRbcS基因cDNA全长936 bp,编码区共552 bp,共编码186个氨基酸。在11 bp处出现起始密码子ATG,在560 bp处出现终止密码子TAA,911 bp处为Poly(A)26尾巴。

|
| 图 1 PwRbcS基因的cDNA全长及其编码的氨基酸序列 |
在NCBI网站上输入PwRbcS的氨基酸序列,进行蛋白功能结构域预测,结果(图 2-A)显示,青杄PwRbcS蛋白具有Rubis-CO small family典型的结构域,推测其属于RbcS家族的一类蛋白。

|
| 图 2 PwRbcS蛋白理化分析及二级三级结构预测 A :PwRbcS蛋白保守结构域分析;B :PwRbcS蛋白疏水性分析;C :蛋白质无序化分析;D,E :分别为PwRbcS蛋白二级、三级结构预测 |
PwRbcS全长936 bp,11 bp发现起始密码子ATG,在560 bp处发现终止子TAA,总共编码186个氨基酸。由ProParam工具预测理论分子质量(Molecular weight)为20.712 6 kD,理论等电点pI为9.07。蛋白质分子式为C926H1423N251O270S10,带有正电氨基酸残基(Arg+Lys)22个,负电氨基酸残基(Asp+Glu)16个,预测其半衰期大约为30 h,不稳定指数为33.79,低于阈值数40,预测该蛋白稳定。磷酸化位点预测位于PwRbcS的第12、17、24、44、124位有5个丝氨酸(Ser)磷酸化位点,有3个苏氨酸磷酸化位点,6个酪氨酸磷酸化位点。ProtScale分析蛋白质的疏水性指数为-5.49,表明该蛋白为亲水性蛋白(图 2-B)。蛋白无序化分析显示,有一处无序化序列,在28-76氨基酸处,预测该蛋白的动态结构较强,蛋白在行使功能时构象易发生变化(图 2-C)。TMHMM预测结果不存在跨膜区域。
采用GOR4软件预测PwRbcS的二级结构,结果显示该蛋白中α-螺旋,占总体的17.49%,无规则卷曲占55.19%,延伸链中占27.32%,无β-折叠结构(图 2-D)。SWISS-MODEL工具预测得到该蛋白的三级结构(图 2-E)。
2.2.3 多序列比对及系统进化树根据PwRbcS的cDNA序列推导其氨基酸序列,在NCBI上利用在线数据库Blast其同源序列,得出PwRbcS同源性蛋白包括:美洲落叶松(LlRbcS,X54464)、日本黑松(PtRbcS,X13408)、海岸松(PpRbcS,AJ309096)、北美红杉(SsRbcS,AY048671)、高粱(SbRbcS,AB564718)、玉米(ZmRbcS,NP_001105294)、燕麦(AvRbcS,AF104249;AcRbcS,AF192776;Am-RbcS,AF192779)、马蹄莲(ZaRbcS,AF034479)、黄瓜(CsRbcS,M16056)、拟南芥(AtRBCS1A、At1g67090、AtRBCS1B、At5g38430;AtRBCS2B,At5g38420)、黄菊(AvRbcS,AF104249)等。通过CLUSTAL X和Esprit 3.0软件将PwRbcS的氨基酸序列与以上同源性较的蛋白氨基酸序列进行对比,结果(图 3)表明,RbcS蛋白在进化上相对保守,与其同源性较高的物种有美洲落叶松(Larix laricina)、海岸松(Pinus pinaster)这些亲缘关系较近的松科物种,相似度分别是93%和90%,而与拟南芥(Arabidopsis thaliana)中的RBCS蛋白的同源性相较低,相似度在60%左右。
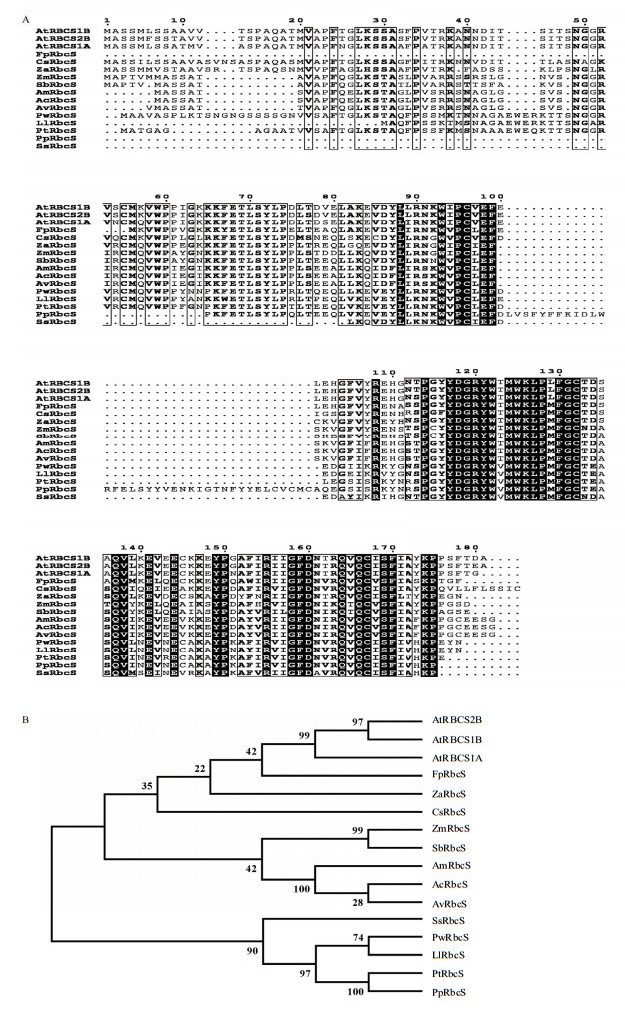
|
| 图 3 PwRbcS蛋白多序列比对(A)及系统进化树分析(B) |
实时荧光定量PCR技术分析PwRbcS基因在不同组织器官中的表达量,结果(图 4)显示PwRbcS主要在叶片中表达,并且在不同叶龄的针叶中的表达量变化很大。在幼叶中的表达量约为茎的15倍,而在成熟叶中表达量更高,约为茎中的25倍。

|
| 图 4 PwRbcS在青杄各组织中的表达情况 不同字母代表各个组织中PwRbcS表达水平差异显著(P < 0.05),下同 |
在200 mmol/L NaCl溶液处理下,PwRbcS的表达量表现为先上升后下降的变化趋势,在6 h达到表达量的高峰,表达量大约是对照的14倍。在8 h和12 h时表现为持续下降,在12 h基因的表达量大约为对照的5倍。用20% PEG4000(V/V)处理2 h后,表达量已经上升到对照的1.8倍,处理4 h时表达量上升至第一个高峰,表达量约为对照的2.2倍,随后基因的表达量在6 h、8 h出现持续的下降,在8 h时PwRbcS的表达量已经下降到对照的0.7倍左右,在处理12 h时,表达量出现回升至2.3倍左右(图 5)。
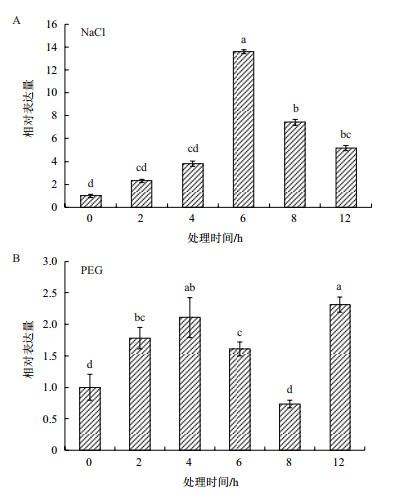
|
| 图 5 NaCl(A)及PEG(B)处理下PwRbcS表达量变化 |
低温胁迫处理青杄幼苗,PwRbcS的表达量出现先上升后下降的趋势,在处理6 h时,表达量达到最大值,约为对照组的12倍。之后表达量持续下降,在处理12 h后表达量为对照的4倍左右(图 6)。高温胁迫(42℃)处理下,在处理4 h后,表达量逐渐上升至对照1.7倍左右,之后表达量下降至对照水平,处理12 h后表达量回升至对照的1.6倍左右。

|
| 图 6 温度胁迫下PwRbcS基因的表达量变化 |
100 μmol/L的ABA处理青杄幼苗时该基因的表达量变化十分明显(图 7)。在处理0、2、4、6 h表达量几乎没有变化,最高表达量(6 h)也只达到对照的2倍左右。但在处理8 h时,PwRbcS的表达量急剧上升至对照的24倍左右,并且在处理12 h时表达量急剧下降至对照水平。水对照处理下,该基因表达量差异不显著,显示本实验结果的可靠性和准确性。
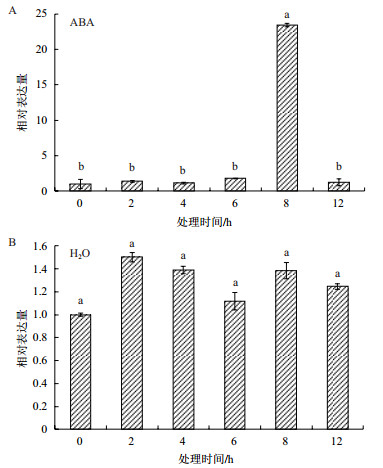
|
| 图 7 ABA(A)以及H2O(B)处理下PwRbcS的表达量变化 |
基于准确、简便的RACE-PCR的方法[24],本研究获得了PwRbcS的cDNA全长。结果表明,该基因全长936 bp,编码区共552 bp,共编码186个氨基酸。青杄PwRbcS蛋白具有RubisCO small family典型的结构域,推测其属于RbcS家族的一类蛋白。多序列比对和系统进化树分析得出,该基因在进化上相对保守,与北美落叶松,黑松等亲缘关系较近的松科类植物,相似度都在85%以上。前人研究表明Rubisco蛋白与光合、呼吸作用关系紧密[1],并且参与了植物抗逆、衰老等多种生理过程[15-17, 25]。PwRbcS是青杄中Rubisco蛋白的一个小亚基,通过组织特异表达实验发现,该基因主要是在青杄的针叶中表达,并且与幼叶相比,成熟叶片中的表达量明显更高,这与前人在水稻、拟南芥中的研究结果[7-9]相似。尽管青杄作为多年生木本植物,而拟南芥、水稻是一年生的草本植物,在植物类型上差异较大但组织特异性表达结果具有相似性可能与其催化光合作用二氧化碳的固定和呼吸作用碳氧化两者之间竞争反应的功能上的相似性紧密相关。
叶片作为植物光合呼吸作用的重要器官,在植物正常生长以及响应逆境胁迫中发挥重要作用。RbcS基因主要在叶片中表达,前人对于该基因是否参与植物抗逆过程的研究主要集中在拟南芥、黄瓜和大豆等模式植物,且研究发现该基因对于光照强度、温度及干旱等胁迫均有一定响应[15-17]。我们的研究结果与这些模式植物相似,在青杄中该基因对于这些非生物胁迫均有较明显的响应。在NaCl处理下,处理6 h表达量上升到对照的14倍,ABA处理后,PwRbcS基因的表达量在处理的前期,即0-6 h内几乎没有太大变化,而在处理8 h时出现急剧的上升现象。低温胁迫下,表达量表现为先上升后下降的变化趋势,最高时是对照组的12倍左右。结果预示该基因参与了多种非生物胁迫响应过程,并且对于不同的非生物胁迫,基因响应的时间和模式存在差异。前人研究在烟草中转入天山雪莲的sikRbcs2基因明显提高了对低温胁迫的耐受性[17],基于研究对象青杄中的PwRbcS基因对于多种非生物胁迫均有一定的响应,我们推测该基因可能参与到了植物多种抗逆响应过程,但是该基因能否提高植物的抗逆能力,以及其参与抗逆反应的信号途径和调控机制还需要进一步将PwRbcS基因转入模式植物拟南芥及烟草等进一步验证,以期为该基因在植物中的进一步利用奠定基础。
4 结论从青杄cDNA文库中成功克隆出核酮糖1,5-二磷酸羧化加氧酶的小亚基编码基因PwRbcS。组织特异性表达结果发现PwRbcS基因主要在叶片中表达,且成熟叶表达量最高。非生物胁迫实验结果表明,该基因参与了多种非生物逆境胁迫反应包括ABA、NaCl及低温处理。对于高温胁迫及PEG处理表达量变化则不十分明显。
| [1] | Evans JR. The relationship between carbon-dioxid-limited photosynthetic rate and ribulose-1, 5-bisphosphate-carbonxylase content in two nuclear-cytoplasm substitution lines of wheat, and the coordination of ribulose-bisphosphate-carboxlation and electron-transport capacities. Planta , 1986, 167 : 351–358. DOI:10.1007/BF00391338 |
| [2] | Makino A, Mae T, Ohira K, et al. Difference between wheat and rice in the enzymic properties of ribulose-1, 5-bisphosphate-carbonxylase / oxygenase and the relationship to photosythetic gas exchange. Planta , 1988, 174 : 30–38. DOI:10.1007/BF00394870 |
| [3] | Genkov T, Spreitzer RJ. Highly conserved small subunit residues influence rubisco large subunit catalysis. The Journal of Biological Chemistry , 2009, 284 (44) : 30105–30112. DOI:10.1074/jbc.M109.044081 |
| [4] | Sasanum T. Characterization of the RbcS multigene family in wheat:subfamily classification, determination of chromosomal location and evolutionary analysis. Mol Genet Genomics , 2001, 265 : 161–171. DOI:10.1007/s004380000404 |
| [5] | Spreitzer RJ. Role of the small subunit in ribulose-1, 5-bisphosphate-carbonxylase / oxygenase. Archives of Biochemistry and Biophysics , 2003, 414 : 141–149. DOI:10.1016/S0003-9861(03)00171-1 |
| [6] | Krebbers E, Seurinck J, Herdies L, et al. Four genes in two diverged subfamilies encode the ribulose-1, 5-bisphosphate-carbonxylase small subunit polypeptides of Arabidopsis thaliana. Plant Molecular Biology , 1988, 11 : 745–759. DOI:10.1007/BF00019515 |
| [7] | Suzuki Y, Miyamoto T, Yoshizawa R, et al. Ruisco content and photosythesis of leaves at different positions in transgenetic rice with an overexpression of RbcS. Plant, Cell & Environment , 2009, 32 : 417–427. |
| [8] | Wanner LA, Gruissem W. Expression dynamics of the tomato RbcS gene family during development. Plant Cell , 1991, 3 : 1289–1303. DOI:10.1105/tpc.3.12.1289 |
| [9] | Meier I, Callan KL, Fleming AJ, et al. Organ-specific differential regulation of a promoter subfamily for the ribulose-1, 5-bisphosphate-carbonxylase/oxygenase small subunit genes in tomato. Plant Physiology , 1995, 107 : 1105–1118. DOI:10.1104/pp.107.4.1105 |
| [10] | Izumi M, Tsunoda H, Suzuki Y, et al. RbcS1A and RbcS3B, two major members within the Arabidopsis RbcS multigene family, function to yield sufficient Rubisco content for leaf photosynthetic capacity. J Exp Bot , 2012, 63 : 2159–2170. DOI:10.1093/jxb/err434 |
| [11] | Du YC, Hong S, Spreitzer RJ, et al. RbcS surpressor mutations improve the thermal stability and CO2 /O2 specificity of rbcL-mutant ribulose-1, 5-bisphosphate carboxylase/oxygenase. Proceedings of the National Academy of Sciences of the United States of America , 2000, 97 (26) : 14206–14211. DOI:10.1073/pnas.260503997 |
| [12] | Miao CC, Li IR. Rubisco subunits between rice and tobacoo //Murata N(ed). Research in Photosynthesis[M]. Dordrecht the Netherlands:Kluwer Academic Publishers, 1992, 3:621-624. |
| [13] | Mann CC. Genetic engineers aim to soup up crop photosynthesis. Science , 1999, 283 : 314–316. DOI:10.1126/science.283.5400.314 |
| [14] | Sun J, Sui X, Wang S, et al. The response of rbcL, rbcS and rca genes in cucumber(Cucumis sativus L.)to growth and induction light intensity. Acta Physiol Plant , 2014, 36 : 2779–2791. DOI:10.1007/s11738-014-1648-z |
| [15] | Williams J, Bulman MP, Neill SJ, et al. Wilt-indeed ABA biosynthesis, gene expression and downregulation of rbcS mRNA levels in Arabidopsis thaliana. Physiologia Plantarum , 1994, 91 : 177–182. DOI:10.1111/ppl.1994.91.issue-2 |
| [16] | 贺超英, 王伟权, 东方阳, 等. 大豆1, 5-二磷酸核酮糖羧化酶小亚基基因的转录表达分析. 科学通报 , 2001, 16 : 1375–1380. |
| [17] | 杨晶, 祝建波, 张亚敏, 等. 低温胁迫对转新疆雪莲sikRbcS2基因烟草光合作用的影响. 生态学报 , 2015, 35 (23) : 7868–7877. |
| [18] | 张盾, 刘亚静, 李长江, 等. 青杄均一化cDNA文库构建及EST序列分析. 生物技术通报 , 2012 (6) : 71–76. |
| [19] | Yu YL, Li YZ, Huang GX, et al. PwHAP5, a CCAAT-binding transcription factor, interacts with PwFKBP12 and plays a role in pollen tube growth orientation in Picea wilsonii. J Exp Bot , 2011, 62 : 4805–4817. DOI:10.1093/jxb/err120 |
| [20] | 陈颖, 徐彩平, 汪南阳, 等. 盐胁迫下水杨酸对南林895杨组培苗抗氧化系统的影响. 南京林业大学学报:自然科学版 , 2012, 6 : 17–22. |
| [21] | 周燕妮, 李艳芳, 张通, 等. 青杄PwUSP2基因克隆和表达模式分析. 植物生理学报 , 2015, 51 (8) : 1307–1314. |
| [22] | 孙帆, 罗朝兵, 周燕妮, 等. 青杄生长素抑制蛋白基因PwARP-1的克隆及表达分析. 生物技术通报 , 2014 (4) : 64–70. |
| [23] | Zhang T, Li YF, Zhou YN, et al. Cloning and expression analysis of a homologous expasin gene EXP2 in Picea wilsonii. Journal of Forest Research , 2016, 27 (2) : 247–255. DOI:10.1007/s11676-015-0097-x |
| [24] | Borson ND, Salo WL, Drewes LR, et al. A lock-docking oligo(dT)primer for 5'and 3'RACE-PCR. PCR Methods Appl , 1992, 2 (2) : 144–148. DOI:10.1101/gr.2.2.144 |
| [25] | Ono Y, Wada S, Izumi M, et al. Evidence for contribution of autop-hagy to Rubisco degradation during leaf sensence in Arabidopsis thaliana. Plant, Cell & Environment , 2013, 36 : 1147–1159. |





