木薯(Manihot esculenta Crantz)是重要的粮食和经济作物。同大多数作物一样,干旱胁迫严重地影响木薯的生长和发育,如生长缓慢、光合作用下降等,最终导致木薯块根产量减少[1]。前人研究表明,脱落酸(ABA)生物合成及信号转导可能是调控木薯耐旱性的关键途径之一[1]。9-顺-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)是ABA生物合成的关键酶,在木薯中克隆NCED相关基因,探讨它们在木薯抗旱的分子作用机制具有重要意义。
ABA是一种重要的植物激素,在种子萌发、成熟与休眠、果实成熟以及植物对逆境胁迫的响应等方面起着重要作用[2, 3]。在干旱条件下,ABA被大量积累,这种累积是以ABA合成酶基因的调控为基础[3]。NCED是高等植物ABA生物合成途径中的限速酶,其表达量的变化与ABA含量有着直接关系。NCED基因最早从玉米突变体中被克隆[4],随后在拟南芥[5]、番茄[6]、大豆[7]、水稻[8]和烟草[9]等植物中被克隆。对不同植物的NCED基因分析表明,这类基因由多个成员组成,在植物中普遍存在且序列高度保守,无内含子。基于全基因组分析,Tan等[5]最早从拟南芥中鉴定出了5个NCED成员,并检测了它们在拟南芥转化植株中的表达情况,结果表明,AtNCED2和AtNCED3在拟南芥根中大量表达,主要调控侧根的萌发和生长;AtNCED3、AtNCED5、AtNCED6和AtNCED9在发育的种子中表达,调控种子胚胎成熟和休眠。此外,AtNCED3在叶中的表达受干旱胁迫诱导,积累大量的ABA以响应水分胁迫。
NCED参与植物干旱等非生物逆境胁迫,是响应胁迫的重要候选基因,目前木薯中与其相关的分子作用机制尚不清楚。本研究从木薯中克隆一个NCED基因成员,MeNCED3,分析其在木薯野生种和栽培种之间的结构变异,研究其在聚乙二醇(PEG)、脱落酸(ABA)和盐(NaCl)胁迫处理下的表达水平,旨在为进一步研究MeNCED3的功能并解析其在木薯抗旱中的分子机理提供理论参考。
1 材料与方法 1.1 材料本试验所用材料木薯栽培品种(M. esculenta cv.)Ku50和Arg7及野生种(M. esculenta ssp. Flabellifolia)W14,由中国热带农业科学院热带生物技术研究所提供。
1.2 方法 1.2.1 材料种植与处理在木薯种植季节(2013年5月),将Ku50粗细均匀的种茎切成长度大约15 cm至少含3-4个芽眼的茎段,种植于充满基质(营养土与蛭石以1:1的体积比混合)的塑料盆(高18.8 cm,上直径18.5 cm,下直径14.8 cm)里,木薯种植10 d后进行间苗。种植60 d后,选取长势一致的植株用20%的PEG 6000溶液模拟干旱胁迫,以不施PEG(浇灌自来水)为对照。在处理0、3和24 h后,分别收集木薯叶片(包括未展开叶、第一片完全展开叶和老叶)和根的样本,液氮冷冻、-80℃保存待用。
此外,对种植60 d的木薯采用100 µmol/L ABA进行叶片喷施处理,0、2、6、10、24、48和72 h后取样;用200 mmol/L NaCl对木薯进行灌根处理,0 h、2 h、6 h、3 d、14 d、18 d和24 d后取样。所取样品液氮冷冻、-80℃保存待用。
为考察木薯野生种W14和不同栽培种Ku50和Arg7中MeNCED3基因的表达情况,收集正常大田种植环境下木薯叶片(90 d)、茎(90 d)和储藏根(150 d)的样本,用于qRT-PCR分析。
1.2.2 RNA提取及cDNA合成按照RNA提取试剂盒(天根生化科技有限公司)提取木薯总RNA,之后用Revert Aid First Strand cDNA Synthesis试剂盒(Fermentas公司)将总RNA反转录成cDNA,-20℃储存备用。
1.2.3 引物合成及qRT-PCR用Primer6.0软件设计引物,由生工生物工程(上海)股份有限公司合成,包括actin基因(L1:5'-TGATGAGTCTGGTCCATC-CA-3';R1:5'-CCTCCTACGACCCAATCTCA-3')[10],MeNCED3基因qRT-PCR引物(L2:5'-TGGGATGG-TTCATGCTGTCC-3';R2:5'-TATCCCAGAGTGGCC-ATGGA-3'),和MeNCED3基因全长扩增引物(L3:5'-TCTCTCCCCCAATCAAACACC-3';R3:5'-ACCC-AGAAACAGGGTGATGC-3')。qRT-PCR按照SYBR Green Ⅰ试剂盒(TaKaRa公司)说明操作,反应体系在Mx 3005P荧光定量PCR仪(Stratagene,美国)上进行。每个样品3次生物学重复,表达量按照2-ΔΔCt进行计算[11]。
1.2.4 生物信息学分析用BLASTP搜索Phytozome数据库,获取其他物种与MeNCED3同源性较高的序列;用ClustalX进行序列比对;用CDD数据库(Http://www.ncbi.nlm.nih.gov/cdd/)进行保守结构域分析;用MEGA5.2软件构建进化树;用DnaSPv5进行SNP分析及ka/ks计算;用PlantCARE进行启动子元件分析;用ExPASy ProtParam软件分析蛋白质的分子量和等电点。木薯栽培种Ku50和木薯野生种W14中MeNCED3基因序列由全基因组测序确定[12];栽培种AM560中MeNCED3序列从Phytozome数据库下载。
2 结果 2.1 MeNCED3基因克隆以拟南芥AtNCED3序列(AT3G14440)为基础,在木薯数据库寻找与其同源的序列(Manes.03-G083500.1),设计引物进行PCR扩增(图 1)。测序后得到一个全长为1 965 bp的MeNCED3序列,其中包括54 bp的5' UTR,1 803 bp的开放阅读框,108 bp的3'UTR。该基因编码600个氨基酸,与Phytozome数据库木薯基因组(栽培品种:AM506)的注释信息一致。经与基因组信息比对,MeNCED3基因仅有1个外显子。预测的蛋白质分子量为66 351.2 Da,理论等电点(pI)为6.32。蛋白质结构域分析显示,MeNCED3编码的蛋白含有NCED家族保守结构域(PLN02258,图 2),进一步证实克隆到的基因为NCED3。
|
| 图 1 MeNCED3基因全长cDNA电泳图 M:DNA marker;1:MeNCED3基因cDNA全长分子量 |

|
| 图 2 MeNCED3编码的蛋白质结构域分析 |
经序列比对,获得了与MeNCED3同源性较高的其他物种序列。进化树分析结果(表 3)表明,NCED3基因可以聚类为3组:第Ⅰ组以C4物种为代表,包括玉米、谷子、狗尾草、高粱、二穗短柄草和柳枝稷,有趣的是,作为C3植物的水稻也聚类到了这一组,可能是它与二穗短柄草亲缘关系较近;第Ⅱ组包括拟南芥和白菜型油菜;木薯MeNCED3被聚类到第Ⅲ组,它与杨树(Potri.001G393800.1)和杞柳(SapurV1A.0617s0010.1)的亲缘关系较近,序列相似性分别达到83.9%和82.5%。
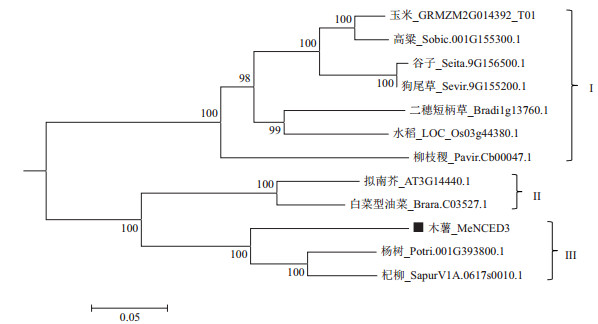
|
| 图 3 木薯MeNCED3基因与其他物种NCED3基因系统进化树 |
为了揭示MeNCED3在基因组结构上的变异,本研究将AM560(来自Phytozome木薯数据库)、Ku50和W14这3个材料中MeNCED3的DNA序列进行比对分析,共发现23个SNP,其中有8个为非同义突变(图 4)。
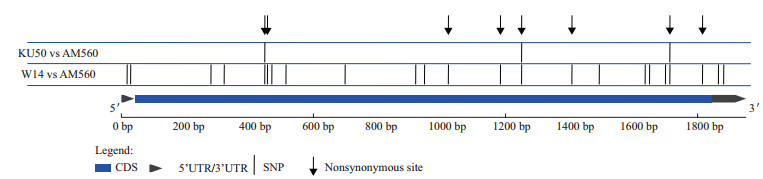
|
| 图 4 MeNCED3基因结构变异 |
序列两两比较表明,MeNCED3的结构变异主要来自于栽培种与野生种之间的差异,共有23个SNP;栽培种与栽培种之间的差异很小,仅有3个SNP。栽培种与野生种ka/ks值介于0.14-0.22之间,暗示MeNCED3基因在进化过程中受到了纯化选择。
2.4 MeNCED3基因启动子元件分析启动子是基因的重要组成部分,它与基因的表达(转录)息息相关。本研究选取MeNCED3起始密码子上游1 500 bp进行启动子元件分析,发现了与干旱相关的元件,如MBS。此外,还发现了一些与激素相关的元件,如赤霉素相关元件GARE-motif、水杨酸相关元件TCA-element和茉莉酸相关元件TGACG-motif,以及与光相关的元件,如Sp1、Box I和G-box等。这些结果表明,除了干旱,MeNCED3可能还参与激素和光相关的基因调控网络。
2.5 MeNCED3基因表达分析通过分析MeNCED3基因在木薯野生种和栽培种不同组织的表达情况,结果(图 5-A)表明,不管是野生种还是栽培种,MeNCED3在根中的表达量都要远远高于叶片和茎,呈现出根特异性表达的特点。另外,与野生种W14相比,MeNCED3在栽培种Ku50和Arg7根中的表达量上升9-10倍,而叶片和茎中则变化较小。
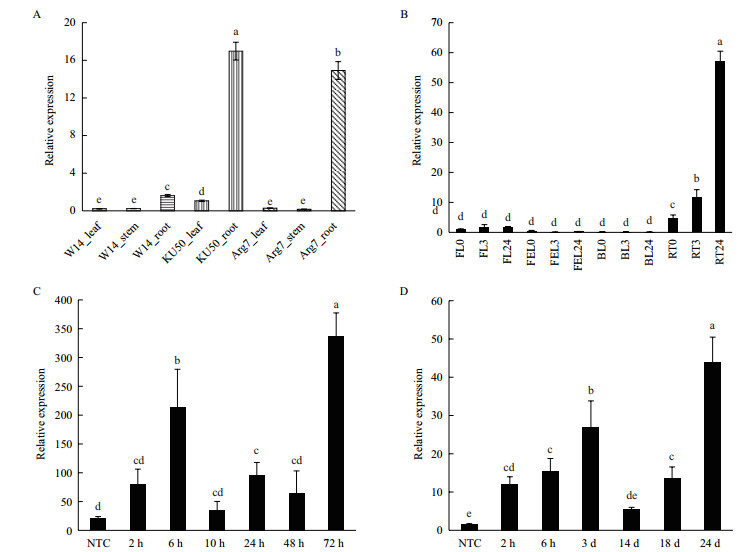
|
| 图 5 MeNCED3基因表达分析 A:木薯野生种(W14)和栽培种(Ku50、Arg7)不同组织中MeNCED3的表达情况;B:PEG 6000胁迫条件下MeNCED3在木薯Ku50不同组织中表达变化。FL:未展开叶、FEL:第一片完全展开叶、BL:老叶、RT:根;C:ABA处理下木薯Ku50叶片中MeNCED3的表达变化,NTC为对照;D:NaCl处理下木薯Ku50叶片中MeNCED3的表达变化,NTC为对照。数据用均值±标准差表示,不同的字母表示Duncan’s多重比较显著(P < 0.05) |
在PEG 6000胁迫条件下,木薯栽培种Ku50不同组织中MeNCED3基因表达的动态变化如图 5-B所示,MeNCED3在根中能被PEG处理快速诱导,其表达量在胁迫3 h和24 h后分别增加了2.5和12倍。相比之下,MeNCED3在未展开叶、第一片完全展开叶和老叶中的表达量则几乎没有变化,而且在第一片完全展开叶和老叶中表达量极低。这些结果进一步表明MeNCED3基因主要在木薯根中起作用。
本研究分析MeNCED3基因分别在ABA和NaCl处理下木薯Ku50叶片中表达量的动态变化(图 5-C):在ABA处理2-6 h后,MeNCED3的表达量显著上升,在10-48 h其表达量有所下降,随后在72 h其表达量达到最高;与ABA处理类似,在NaCl处理2 h、6 h和3 d后MeNCED3的表达量显著升高,在14 d其表达量有所降低,在24 d达到最高表达水平(图 5-D)。这些结果充分表明,ABA和NaCl处理能够显著提高MeNCED3基因的表达水平。
3 讨论NCED是高等植物ABA生物合成途径中的关键酶,在植物干旱等逆境胁迫中扮演着重要角色。目前已经从多个物种中克隆了NCED基因,然而在热带作物木薯中还没有关于NCED基因克隆的报道。本研究从木薯中克隆了一个NCED基因MeNCED3。该基因具有1 803 bp的开放阅读框,编码600个氨基酸,含有NCED家族保守结构域,这与前人在其他物种中的报道比较一致[8, 9];同源性分析表明,它与杨树和杞柳的NCED3基因同源性较高。
基因结构变异可以引起其表达量的改变。前人通过比较测序发现,拟南芥中AtNCED3第274位和第327位氨基酸的变异可能引起AtNCED3表达量的改变,导致干旱条件下ABA含量的增加[13]。在本研究中,MeNCED3的表达量在木薯野生种和栽培种之间差异很大,但栽培种内部不明显;木薯野生种和栽培种之间共发现8个SNP属于错义突变,而且其中3个也存在于栽培种之间,暗示另外的5个SNP可能是引起MeNCED3表达量在木薯野生种和栽培种之间差异较大的原因。
植物中有多个NCED成员,且各成员在不同组织中表达量不同,可能与它们各自不同的功能相关。如拟南芥中AtNCED2和AtNCED3主要在根中表达,负责侧根的萌发和生长;AtNCED5、AtNCED6和AtNCED9在发育的种子中表达,负责种子胚胎成熟和休眠[5];水稻中OsNCED1和OsNCED3都在叶片中表达,在水分胁迫条件下,前者被显著抑制而后者被快速诱导[14]。本研究在木薯中鉴定的MeNCED3基因在根中特异性表达,且能被PEG处理诱导,与NCED3在其他物种中的报道[5, 15]比较一致。这可能是因为在干旱条件下,根是接收水分缺乏信号(如ABA信号)最早的器官,它可以吸收更深层的地下水来应对干旱胁迫[1]。
NCED基因的表达受多种非生物胁迫的诱导。例如,干旱胁迫可以诱导NCED基因的表达和植物内源ABA的积累,而且NCED表达量的变化与ABA含量有着直接关系[3, 9]。研究表明,ABA也能够诱导NCED3基因的表达[16]。本研究发现,在PEG和ABA处理下MeNCED3基因的表达量均显著上升,暗示MeNCED3参与了ABA介导的干旱胁迫。然而,是否还有其他的木薯NCED基因参与干旱胁迫尚不清楚。与前人研究相似[16, 17],我们发现木薯MeNCED3基因能被NaCl显著地诱导。这些结果表明,MeNCED3参与了ABA和NaCl介导的非生物逆境胁迫应答,但具体的作用机制需要进一步研究。
4 结论采用RT-PCR的方法从木薯Ku50叶片中克隆了一个NCED基因MeNCED3,该基因编码600个氨基酸,含有NCED家族保守结构域。进化树分析表明,MeNCED3与杨树和杞柳中同源基因的亲缘关系较近。序列比对分析表明,MeNCED3在木薯野生种和栽培种之间共有8个错义突变,其中5个可能与MeNCED3的表达量有关。实时荧光定量PCR分析表明,不管是野生种还是栽培种,MeNCED3在根中的表达量要远远高于叶片和茎,呈现根特异性表达。而且,PEG、ABA和NaCl处理能显著诱导MeNCED3的表达。
| [1] | Okogbenin E, Setter TL, Ferguson M, et al. Phenotypic approaches to drought in cassava: review. Front Physiol , 2013, 4 : 93. |
| [2] | Rodrigo M-J, Alquezar B, Zacarías L. Cloning and characterization of two 9-cis-epoxycarotenoid dioxygenase genes, differentially regulated during fruit maturation and under stress conditions, from orange(Citrus sinensis L.Osbeck). Journal of Experimental Botany , 2006, 57 (3) : 633–643. DOI:10.1093/jxb/erj048 |
| [3] | Endo A, Sawada Y, Takahashi H, et al. Drought induction of Arabidopsis 9-cis-epoxycarotenoid dioxygenase occurs in vascular parenchyma cells. Plant Physiol , 2008, 4 : 1984–1993. |
| [4] | Schwartz SH, Tan BC, Gage DA, et al. Specific oxidative cleavage of carotenoids by VP14 of maize. Science , 1997, 276 (5320) : 1872–1874. DOI:10.1126/science.276.5320.1872 |
| [5] | Tan BC, Joseph LM, Deng WT, et al. Molecular characterization of the Arabidopsis 9-cis epoxycarotenoid dioxygenase gene family. The Plant Journal , 2003, 35 (1) : 44–56. DOI:10.1046/j.1365-313X.2003.01786.x |
| [6] | Burbidge A, Grieve TM, Jackson A, et al. Characterization of the ABA-deficient tomato mutantnotabilisand its relationship with maizeVp14. The Plant Journal , 1999, 17 (4) : 427–431. DOI:10.1046/j.1365-313X.1999.00386.x |
| [7] | Qin X, Zeevaart JA. The 9-cis-epoxycarotenoid cleavage reaction is the key regulatory step of abscisic acid biosynthesis in water-stressed bean. Proc Natil Acad Sci , 1999, 96 (26) : 15354–15361. DOI:10.1073/pnas.96.26.15354 |
| [8] | Vallabhaneni R, Bradbury LM, Wurtzel ET. The carotenoid dioxygenase gene family in maize, sorghum, and rice. Archives of Biochemistry and Biophysics , 2010, 504 (1) : 104–111. DOI:10.1016/j.abb.2010.07.019 |
| [9] | 牛志强, 刘国顺, 师婷婷, 等. 烟草NCED3基因的克隆及其干旱胁迫表达分析. 中国烟草学报 , 2015, 21 (3) : 100–106. |
| [10] | Xu J, Duan X, Yang J, et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots. Plant Physiology , 2013, 161 (3) : 1517–1528. DOI:10.1104/pp.112.212803 |
| [11] | 胡伟, 颜彦, 韦运谢, 等. 木薯MeASR基因克隆及表达分析. 生物技术通报 , 2015, 31 (10) : 125–130. |
| [12] | Wang W, Feng B, Xiao J, et al. Cassava genome from a wild ancestor to cultivated varieties. Nature Communications , 2014, 5 (5) : 5110. |
| [13] | Hao GP, Zhang XH, Wang YQ, et al. Nucleotide variation in the NCED3 region of Arabidopsis thaliana and its association study with abscisic acid content under drought stress. Journal of Integrative Plant Biology , 2009, 51 (2) : 175–183. DOI:10.1111/jipb.2009.51.issue-2 |
| [14] | Ye N, Zhu G, Liu Y, et al. ABA controls H2O2 accumulation through the induction of OsCATB in rice leaves under water stress. Plant and Cell Physiology , 2011, 52 (4) : 689–698. DOI:10.1093/pcp/pcr028 |
| [15] | 王晓庆, 张超, 王彦杰, 等. 牡丹NCED基因的克隆和表达分析. 园艺学报 , 2012, 39 (10) : 2033–2044. |
| [16] | Barrero J, RodrÍGuez PL, Quesada V, et al. Both abscisic acid(ABA)-dependent and ABA-independent pathways govern the induction of NCED3, AAO3 and ABA1 in response to salt stress. Plant, Cell Environ , 2006, 29 (10) : 2000–2008. DOI:10.1111/pce.2006.29.issue-10 |
| [17] | Xiong L, Lee H, Ishitani M, et al. Regulation of osmotic stressresponsive gene expression by the LOS6/ABA1 locus in Arabidopsis. J Biol Chem , 2002, 277 (10) : 8588–8596. DOI:10.1074/jbc.M109275200 |




