2. 北京农学院生物科学与工程学院农业部都市农业(北方)重点实验室,北京 102206
2. College of Biological Science and Engineering, Beijing University of Agriculture, Key Laboratory of Urban Agriculture(North)of Ministry of Agriculture, Beijing 102206
铁是植物生长的必需微量元素,叶绿素的合成、光合作用、呼吸作用以及植物体内的氧化还原反应和电子传递都需要铁的参与[1, 2]。铁虽然在土壤中的丰度很高,但大多以生物有效性低的氧化态形式存在,特别是在石灰性土壤上,高pH、高重碳酸盐含量严重降低了土壤中铁的有效性;此类土壤中Fe3+和Fe2+浓度较低,一般低于10-10mol/L,而植物最适生长所需的浓度为10-9-10-4 mol/L[3, 4]。缺铁引起的植物黄化在石灰性、高pH土壤上非常普遍,这种缺铁胁迫导致了作物产量降低及品质下降[5-7]。石灰性土壤上铁素营养失调已成为制约作物高产、稳产的主要限制因子;筛选和利用铁高效作物基因型是解决这一问题的经济有效途径之一[8, 9]。在长期的研究中,人们发现缺铁胁迫条件下,铁高效双子叶植物在生理上和形态上都会发生一些特异性的变化,以增加其对铁的吸收;不同种间或品种间铁效率差异很大[10-13]。
小豆(Azuki bean,Vigna angularisi),俗名红小豆,红豆,赤豆,属豆科(Leguminosae)豇豆属(Vigna L.),籽粒富含铁营养,是传统的补血食物,一般每100 g小豆含铁7.4 mg左右,是水稻的3.08倍、玉米的3.36倍、小麦的1.45倍[14]。缺铁是小豆发生失绿黄化主要因素,常规补充铁源的办法不能有效解决小豆的缺铁失绿症。迄今,对缺铁胁迫对小豆幼苗生理特性影响的研究未见报道。为了探讨小豆铁高效的可能生理指标,本研究探究缺铁胁迫对小豆的生理影响,以期为研究小豆对铁累积的高效率育种提供基础依据。
1 材料与方法 1.1 材料试验材料为小豆栽培种京农6号(JN6)及小豆品系13MY001、13MY007、FMY020,参试小豆材料由北京农学院选育。
1.2 方法 1.2.1 小豆材料培养小豆种子在石英砂中发芽生长为长势均匀的幼苗,将长有2片真叶的小豆幼苗去除子叶进行溶液培养处理,营养液配方为:KNO3 0.61 g/L、NH4H2PO4 0.23 g/L、MgSO4·7H2O 0.25 g/L、Ca(NO3)2·4H2O 0.94 g/L、KCl 0.15×10-2 g/L、H3BO3 3.08×10-2 g/L、ZnSO4·7H2O 1.15×10-2 g/L、MnSO4 0.68×10-2 g/L、CuSO4 0.06×10-2 g/L、H8MoN2O4 0.24×10-2 g/L。设缺铁(-Fe)和供铁(+Fe)2个处理,供铁处理的营养液中含有FeSO4·7H2O 0.011 g/L、EDTA-2Na 0.015 g/L(Fe(Ⅱ)-EDTA 4×10-5 mol/L),缺铁处理则不供给铁。每个处理4次重复,每周更换一次营养液,用0.1mol/L HCL调节pH5.6。分别于处理7、14、21 d取样分析。
1.2.2 分析方法 1.2.2.1 小豆幼苗叶片叶绿素相对含量(SPAD值)的测定取小豆幼苗第二叶位的功能叶,采用Hansatech CL-01型叶绿素测定仪测定叶绿素相对含量,每个处理测定3株小豆幼苗的功能叶,每个处理4次重复。
1.2.2.2 小豆幼苗叶片净光合速率(Pn)的测定采用CIRAS-2便携式光合仪(英国PP System公司),于晴朗天气的上午9:00-11:00时,取小豆幼苗第二叶位的功能叶测定小豆幼苗叶片的净光合速率(Pn),每个处理测定3株小豆幼苗的功能叶,每个处理4次重复。
1.2.2.3 小豆幼苗根系形态测定用Microtek ScanMaker i800 plus根系扫描仪及根系分析系统,测定小豆幼苗根系总根长、根系表面积。用根系分析仪进行测定前,首先将根放入装有去离子水的无色透明塑料水槽中,用镊子调整根的位置以尽量避免根系的交叉重叠,再进行图像扫描。
1.2.2.4 小豆幼苗根系Fe3+还原酶活性的测定采用2-2联吡啶比色法测定小豆根系Fe3+还原酶活性[15]。测定时,取40 mL反应液放入洁净的50 mL三角瓶中,将待测植株的根系放入饱和CaSO4溶液中浸泡5 min,用去离子水冲洗干净后将根系浸没在三角瓶的反应液中。2 h后取出待测植株,吸干根表残液并称量鲜重。反应液用分光光度计在523.3 nm波长下比色,读取OD值;Fe3+还原酶活性(μmol.g-1.t-1)=OD×106/(FW×8650),式中8650为Fe(Ⅱ)-联吡啶的摩尔吸光系数(mol.L-1.cm-1),FW为根鲜重,t为反应时间。
1.2.2.5 小豆幼苗根系的呼吸速率的测定采用英国Hansatech公司生产的液相Oxy-Lab氧电极测定小豆根系的呼吸速率。测量前将反应杯中准确加入1.5 mL蒸馏水,根系用蒸馏水冲洗2-3次,用吸水纸吸干,迅速称取0.1 g左右,用双面刀将根切成2 mm长的根段,放入反应杯,加盖,排气并启动测量程序;待反应曲线稳定后停止反应,在曲线上截取理想长度,记取数据;氧电极输出的结果是一个斜率值,该值为单位体积、时间内的耗氧量(μmol·min-1·mL-1),把该值乘以反映杯中液体的体积(mL),再除以放入的样品的质量(g),即最后的计算结果单位为μmol·g-1·min-1。
1.2.2.6 小豆幼苗铁含量的测定采用德国耶拿公司生产的原子吸收光谱仪AAS ZEEnit700P测定小豆幼苗的茎叶及根的铁含量。称取(0.05±0.001)g的样品放入微波硝解管中,每个硝解管加8 mL硝酸,盖上密闭盖,放入MARS5微波消解仪中按消解程序进行消解;消解完成后将消解罐放入BHW-09C赶酸机进行赶酸处理;赶酸之后,取出样品,冷却、定容、待测。用上样杯取待测液与标准液,按序号上样,启动原子吸收光谱仪对样品中Fe含量进行测定,将测定后的浓度换算成样品中Fe的相应含量(mg/kg)。
1.2.3 数据处理采用SPSS17.0软件对实验数据进行处理分析(LSD法,α=0.05),用Excel完成图表的绘制。
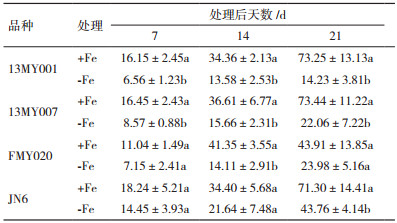
2 结果 2.1 缺铁胁迫对小豆幼苗叶绿素相对含量(SPAD值)的影响SPAD值即叶片的叶绿素相对含量是评价铁胁迫状况的重要指标之一。由表 1可知,随着处理时间的增加,+Fe培养的小豆幼苗的SPAD值随着时间的增加而呈现不同程度的增加;在-Fe培养下,随着处理时间的增加,SPAD值减少。+Fe和-Fe处理之间比较,4个小豆品种的3个处理时期的SPAD值差异均已达到显著性差异(P < 0.05),在处理后第21天,13MY001、13MY007、FMY020及JN6的SPAD值分别下降了77.0%、82.3%、90.7%及74.7%,其中FMY020下降幅度最大为90.7%,JN6的最小。说明缺铁胁迫导致小豆的叶绿素含量降低,小豆品种间差异较大。
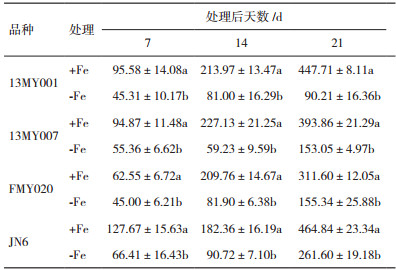
叶片的净光合速率可以直接反应植物光合作用的状态。由表 2可以看出,在+Fe条件下,4个小豆品种的Pn随时间的增加而增强;在-Fe条件下,随着处理时间的增加,4个小豆品种的Pn降低。同一小豆品种在同一时期,在+Fe条件和-Fe条件下叶片的Pn差异均已达到显著水平(P < 0.05),-Fe处理后的第21天,13MY001、13MY007、FMY020及JN6的净光合速率比+Fe处理的分别下降了53.5%、56.1%、81.3%和59.7%。结果表明缺铁胁迫抑制了光合作用,降低了光合速率。
根系是植物吸收矿质元素的重要器官,其形态学的特征能够体现出植物对缺铁条件所产生的反应。缺铁处理后,随着处理时间的增加,4个小豆品种的根系总表面积均显著减少(表 3)。-Fe处理后的第21 d,13MY001、13MY007、FMY020及JN6的根系总表面积比+Fe处理的分别下降了80.6%、70.0%、45.4%和38.6%。
小豆的总根长度的变化趋势与根系总表面积相似,随着缺铁处理时间的增加,4个小豆品种的总根长度均显著减少(表 4)。从处理后的第7 d开始,小豆幼苗在+Fe条件和-Fe条件下的总根长度差异均达到显著性水平(P < 0.05)。综上所述,缺铁处理后,根系总表面积和总根长度下降,表明尽管铁是微量元素,只要缺铁就会导致根系吸收能力整体下降。
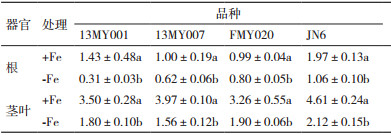
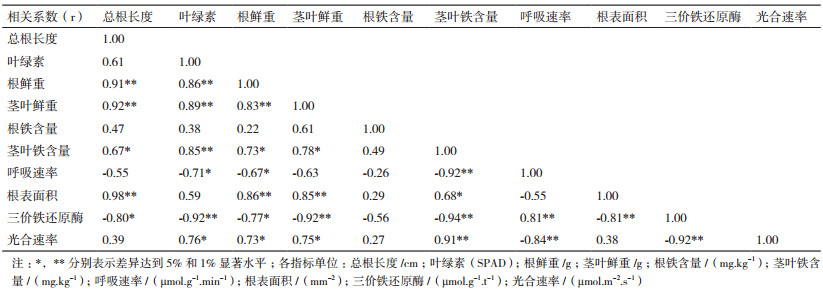
研究结果(图 1)表明,在相同的供铁水平下,不同小豆品种幼苗根系的Fe3+还原酶活性存在一定的差异。在+Fe和-Fe处理后第21 d的小豆幼苗根系的Fe3+还原酶活性差异达到显著性水平(P < 0.05),13MY001、13MY007、FMY020及JN6 -Fe处理的三价铁还原酶活性比+Fe的分别上升了5.83倍、8.95倍、3.88倍和5.60倍。铁胁迫诱导了小豆根系Fe3+还原酶活性的显著提高。

|
| 图 1 缺铁胁迫对小豆Fe3+还原酶活性的影响 |
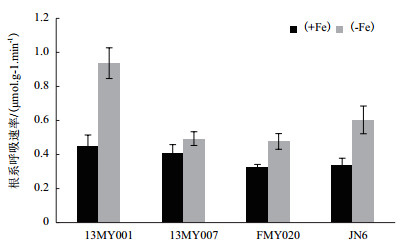
图 2显示,在缺铁胁迫处理的21 d,小豆根系呼吸速率明显提高,其中13MY001、FMY020以及JN6的+Fe处理和-Fe处理间达到显著性差异(P < 0.05)。13MY001、13MY007、FMY020及JN6 -Fe处理的根系呼吸速率比+Fe的分别上升了1.09倍、0.20倍、0.45倍和0.76倍,缺铁胁迫加速了小豆幼苗根系呼吸和耗氧量。
|
| 图 2 缺铁胁迫对小豆根系呼吸速率的影响 |
表 5结果显示,-Fe处理21 d的小豆根及茎叶的鲜重均显著低于+Fe处理的根及茎叶的鲜重,13MY001、13MY007、FMY020及JN6 -Fe处理的根的鲜重比+Fe的分别下降了78.3%、38.0%、10.1%和46.2%,茎叶鲜重分别下降了48.6%、60.7%、41.7%和54.0%。缺铁胁迫降低了小豆幼苗的生物量,不同品种间存在差异。
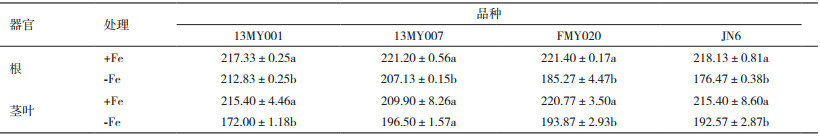
+Fe和-Fe处理对4个小豆幼苗茎叶及根中的全铁含量的影响情况如表 6。-Fe处理不同程度地降低了4个小豆幼苗茎叶及根中的总铁含量。但是,各品种幼苗茎叶及根中总铁含量的下降幅度间差异较大,-Fe处理21 d后的小豆根及茎叶中的总铁含量均低于+Fe处理的铁含量,其中13MY001、FMY020以及JN6的根及茎叶中铁含量在+Fe和-Fe条件下呈现显著性差异(P < 0.05),13MY007根中铁含量达到显著性差异(P < 0.05)。
通过相关性分析(表 7)可以看出小豆茎叶铁含量与小豆叶绿素含量、光合速率呈现极显著正相关,相关系数分别为0.85和0.91;与根系三价铁还原酶活性、根系呼吸速率呈极显著负相关,相关系数分别为0.94和0.92。根铁含量与上述指标的相关性均未达显著水平。
为了改善小豆的铁营养品质,应用于作物生物强化,探索小豆的缺铁生理具有更大现实意义。并且小豆野生资源类型丰富、驯化程度较低,从中选出抗缺铁基因型的潜力更大。但至今对小豆的缺铁生理研究很少,加强这方面的研究对有效筛选铁高效吸收利用基因型小豆无疑是非常重要的。
铁虽然不是叶绿素的组成部分,但其在叶绿素前体合成中是不可缺少的[16]。作物因缺铁导致叶片黄化症的程度主要用叶绿素含量表示,叶绿素含量是判断作物是否缺铁的有效指标[17]。大量研究已经证实缺铁胁迫会引起叶绿素含量降低,本研究中发现缺铁胁迫后的小豆叶绿素含量与正常小豆叶绿素含量达到显著性差异(P < 0.05)。叶绿素含量在耐缺铁和铁敏感的小豆上存在明显差异,耐缺铁小豆品种中叶绿素含量明显高于铁敏感小豆品种。缺铁胁迫引起的植物叶绿素降低会导致激发能转化为化学能的能力减弱,能够明显抑制光合作用[18, 19];叶片的净光合速率可以直接反应植物光合作用的状态,缺铁胁迫造成植物的净光合速率降低[20-22]。本试验结果也表明缺铁导致小豆叶片光合速率降低,并且小豆叶片的光合速率在缺铁胁迫下品种间变化较大,且不同品种间差异显著(表 2)。缺铁胁迫使小豆幼苗叶片光合色素严重下降,引起光合速率大幅降低,最终导致植株生物量的下降。
根是植物重要的营养器官,根系的适应性变化在植物铁素营养的吸收中发挥了重要的作用,有研究表明,缺铁胁迫会抑制主根的生长,侧根数、总根长和根体积均比对照处理显著降低[23, 24],也有研究结果显示缺铁使根尖数和主根的长度显著增加,根系活力和根系总表面积均下降[25];缺铁使小豆的总根长度、根系总表面积显著减少。至于缺铁胁迫是否抑制或促进主根生长、侧根数的发生可能因不同植物对缺铁处理的反应存在基因型差异,还有待进一步研究。
将Fe3+还原为Fe2+是双子叶植物吸收铁的前提,根系Fe3+还原酶活性的增强,是铁高效双子叶植物和非禾本科植物适应缺铁胁迫的主要生理机制[26];在缺铁环境中,小豆幼苗根系的还原活性显著增加,该结果与苹果、梨、桑等植物对缺铁胁迫响应的研究结果相一致[27-29]。小豆幼苗根系呼吸速率在缺铁胁迫21 d时显著高于对照(+Fe),同样在不同效率基因型间差异显著;究其原因是在双子叶植物和非禾本科植物中,缺铁胁迫诱导了Fe3+的还原及增加质子的分泌,这二者都相应增加了NAD(P)H和ATP的需求,加速了呼吸和耗氧量[30-33],但是根系的有氧呼吸的主要途径不可缺少铁,植物短期内为适应缺铁环境而增加呼吸代谢,长期缺铁对根系呼吸代谢的效应及机理值得深入研究。
4 结论小豆在缺铁胁迫过程中,叶绿素相对含量、净光合速率降低,生物量减少;小豆根系呼吸速率增高、Fe3+还原酶活性加强。小豆幼苗的茎叶铁含量与叶绿素含量、净光合速率呈极显著正相关,与根系Fe3+还原酶活性、根系的呼吸速率呈极显著负相关。在缺铁胁迫条件下,小豆叶片叶绿素含量、净光合速率、根系Fe3+还原酶活性及呼吸速率在品种间差异显著,为筛选和培育铁高效的小豆品种提供了生理指标。
| [1] | Hell R, Stephan UW. Iron uptake, trafficking and homeostasis in plants. Planta , 2003, 216 (4) : 541–551. |
| [2] | Schmidt W. Iron solutions: acquisition strategies and signaling pathways in plants. Trends Plant Sci , 2003, 8 (4) : 188–193. DOI:10.1016/S1360-1385(03)00048-7 |
| [3] | Römheld V, Marschner H. Evidence for a specific uptake system for iron phytosiderophores in root of grasses. Plant Physiol , 1986, 80 (1) : 175–180. DOI:10.1104/pp.80.1.175 |
| [4] | Guerinot ML, Yi Y. Iron: Nutritious, noxious, and not readily available. Plant Physiol , 1994, 104 (3) : 815–820. |
| [5] | 姜茂远, 顾曼如, 束怀瑞. 缺铁失绿与苹果矿质元素含量的关系. 园艺学报 , 1995, 22 (2) : 183–284. |
| [6] | Guerinot ML. It's elementary: enhancing Fe3+ reduction improves rice yields. PNAS , 2007, 104 (18) : 7311–7312. DOI:10.1073/pnas.0701954104 |
| [7] | 王翠玲, 杨晓明, 曹孜义. 缺铁黄化对葡萄生长及果实品质的影响. 果树学报 , 2007, 24 (1) : 26–29. |
| [8] | 韩振海, 王永章, 孙文彬. 铁高效及低效苹果基因型的铁离子吸收动力学研究. 园艺学报 , 1995, 22 (4) : 313–317. |
| [9] | 张凌云, 翟衡, 张宪法, 等. 苹果砧木铁高效基因型筛选. 中国农业科学 , 2002, 35 (1) : 68–71. |
| [10] | 安华明, 樊卫国. 缺铁胁迫对川梨的生理影响. 中国农业科学 , 2003, 36 (8) : 935–940. |
| [11] | Long JK, Bänziger M, Smith ME. Diallel analysis of grain iron and zinc density in southern african-adapted maize inbreds. Crop Sci , 2004, 44 (6) : 9019–2026. |
| [12] | Rodríguez-Celma J, Lattanzio G, Grusak MA, et al. Root responses of medicago truncatula plants grown in two different iron deficiency conditions: changes in root protein profile and riboflavin biosynthesis. J Proteome Res , 2011, 10 (5) : 2590–2601. DOI:10.1021/pr2000623 |
| [13] | Kawahara Y, Kitamura Y. Changes in cell size and number and in rhizodermal development contribute to root tip swelling of hyoscyamus albus roots subjected to iron deficiency. Plant Physiol Biochem , 2015, 89 : 107–111. DOI:10.1016/j.plaphy.2015.02.018 |
| [14] | Yamada T, Teraishi M, Hattori K, et al. Transformation of azuki bean by agrobacterium tumefaciens. Plant Cell Tiss Org , 2001, 64 (64) : 47–54. |
| [15] | 许良政, 等. 双子叶植物根系F3+还原酶活性的2, 2'-联吡啶比色测定法. 植物营养与肥料学报 , 1998, 4 (l) : 63–66. |
| [16] | Yamaguehi M, Peng XX. Iron toxicity and stress induced ethylene production in rice leaves. Plant soil , 1995, 173 (1) : 21–33. DOI:10.1007/BF00155514 |
| [17] | Tagliavini M, Rombolà AD. Iron deficiency and chlorosis in orchard and vineyard ecosystems. Eur J Agron , 2001, 15 (2) : 71–92. DOI:10.1016/S1161-0301(01)00125-3 |
| [18] | 姜闯道, 高辉远, 邹琦. 缺铁使大豆叶片激发能的耗散增加. 植物生理与分子生物学学报 , 2002, 28 (2) : 127–132. |
| [19] | Covarrubias JI, Retamales C, Donnini S, et al. Contrasting physiological responses to iron deficiency in Cabernet Sauvignon grapevines grafted on two rootstocks. Scientia Horticulturae , 2016, 199 : 1–8. DOI:10.1016/j.scienta.2015.12.013 |
| [20] | Jiang CD, Gao HY, Zou Q, et al. Effects of iron deficiency on photosynthesis and photosystem Ⅱ function in soybean leaf. J Plant Physiol Mol Biol , 2007, 33 (1) : 53–60. |
| [21] | 黄宗安, 徐坚, 史建磊, 等. 缺铁胁迫对温州盘菜幼苗叶片光合特性和抗氧化酶活性的影响. 浙江农业学报 , 2014, 26 (6) : 1495–1500. |
| [22] | 吴妤, 禹文雅, 李奕松. 缺铁胁迫对草莓幼苗光合特性及细胞器铁含量的影响. 植物营养与肥料学报 , 2013, 19 (43) : 918–925. |
| [23] | 李玥, 赖勇林, 王军, 等. 不同养分缺乏对烤烟根系形态及营养生长的影响. 中国烟草科学 , 2015, 36 (2) : 60–65. |
| [24] | 曾秀成, 王文明, 罗敏娜, 等. 缺素培养对大豆营养生长和根系形态的影响. 植物营养与肥料学报 , 2010, 16 (4) : 1032–1036. |
| [25] | 乔海涛, 杨洪强, 申为宝, 等. 缺氮和缺铁对平邑甜茶幼苗根系构型的影响. 园艺学报 , 2009, 36 (3) : 321–326. |
| [26] | Solti A, Müller B, Czech V, et al. Functional characterization of the chloroplast ferric chelate oxidoreductase enzyme. New Phytol , 2014, 202 (3) : 920–928. DOI:10.1111/nph.12715 |
| [27] | 张福锁, 刘书娟, 毛达如, 等. 苹果抗缺铁基因型差异的生理生化指标研究. 园艺学报 , 1995, 22 (1) : 1–6. |
| [28] | 殷文娟, 吴玉霞, 何天明, 等. 缺铁胁迫对3种梨砧木幼苗生理特性的影响. 经济林研究 , 2015, 33 (2) : 124–128. |
| [29] | 胡盛沪, 黎晓峰, 兰柳艳, 等. 桑树幼苗对缺铁环境的生理反应. 生态环境学报 , 2010, 19 (4) : 899–903. |
| [30] | Espen L, Dell'Orto M, De Nisi P, et al. Metabolic responses in cucumber(Cucumis sativus L.)roots under Fe-deficiency: a 31 P-nuclear magnetic resonance in-vivo study. Planta , 2000, 210 (6) : 985–992. DOI:10.1007/s004250050707 |
| [31] | López-Millán AF, Morales F, Andaluz S, et al. Responses of sugar beet roots to iron deficiency.Changes in carbon assimilation and oxygen use. Plant Physiol , 2000, 124 (2) : 885–898. DOI:10.1104/pp.124.2.885 |
| [32] | 李振侠, 徐继忠, 高仪, 等. 苹果砧木SH40和八棱海棠缺铁胁迫下根系有机酸分泌的差异. 园艺学报 , 2007, 34 (2) : 279–282. |
| [33] | Vigani G, Maffi D, Zocchi G. Iron availability affects the function of mitochondria incucumber roots. New Phytol , 2009, 182 (1) : 127–136. DOI:10.1111/j.1469-8137.2008.02747.x |