海岛棉是纤维品质最优的栽培棉种,新疆是我国唯一的海岛棉商业化生产基地[1]。组织培养以及以此为基础的转基因技术可充分利用自然界的遗传资源和加快育种进程等优势,为我国棉花产业的发展提供了一条新的途径。与其他作物相比,棉花组织培养仍存在体细胞胚胎发生率低、培养周期长、畸形胚频率高等方面的问题[2],目前的研究主要是针对陆地棉[3]、克劳茨基棉[4]等棉种的再生体系,而海岛棉是目前报道可再生棉花品系中较难再生的一种,我国报道的可再生海岛棉品系数量更为有限。
本研究在前人[5, 6, 7]的基础上,以6个新疆主栽海岛棉品系为材料,研究激素对诱导愈伤组织和体细胞胚胎发生能力的影响,旨在获得体细胞胚胎和再生植株,为拓宽海岛棉再生体系基因型奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试材料新疆海岛棉品系:DJ-1(373)、天长2号(376)、5917(380)、阿长-599(381)、塔07-152(383)、S0717(408),材料均由新疆农业大学生物技术重点实验室提供。
1.1.2 基本培养基配方海岛棉再生体系基本培养基配方见表 1。培养基各成分均按比例溶解均匀,所用的激素和氨基酸均在灭菌前加入,配置好的培养基用2 mol/L NaOH调节pH至5.8-6.0,121℃高压蒸汽灭菌20 min。所有培养物均置于培养室(28±2℃,光照强度2 000 Lx,16 h光照)培养。
将不同品系的种子经浓硫酸脱绒后,用水冲洗干净晾干。取适量种子进行处理:首先用75%酒精进行表面消毒3次,每次30-45 s;然后在30% H2O2中浸泡4-5 h后用无菌水冲洗4-5遍,28℃暗培养箱中无菌水浸泡过夜,直至种子“露白”;在无菌条件下去除种皮,将种仁接种于MS0培养基中促使种子萌发,(28±2)℃暗培养3 d后放于培养室中继续培养3 d,获得6 d龄无菌苗备用。1.2.2 愈伤组织诱导和增殖 取下胚轴中间段,弃去靠近子叶呈绿色及靠近胚根呈白色部位,将下胚轴切成0.5-0.8 cm小段,每6个小段接分别种于含30 mL左右的愈伤诱导培养基MS1和MS2中,每20-25 d于新鲜培养基继代1-2次。30 d时统计各棉花品系出愈率:

待下胚轴与愈伤组织产生较明显的隔离层以后,去除下胚轴,将愈伤组织接种到分化培养基MS3,每12-18 d于新鲜培养基继代培养一次。该阶段在愈伤组织块边缘可分化出胚性愈伤组织,称为“初生性胚性愈伤组织”,为6个海岛棉品系的分化阶段建立一个“剥离胚性愈伤”的优化处理阶段。处理A1:在MS4培养基上,将已成功获得再生品系的胚性愈伤与之放于同一培养瓶中。处理A2:将初生性胚性愈伤组织剥离接种于MS5培养基上,降低NH4+/NO3-比例促进体胚发生。30 d后,观察统计各棉花品系的胚性愈伤组织情况。每个培养基中的最初接种量为0.2 g左右,每个处理均为50瓶,计算胚性愈伤组织出愈率:

挑选继代培养3次后的胚性愈伤组织,参照代鑫[10]的方法做石蜡切片,在Olympus显微镜下观察并照相。
1.2.5 体细胞胚胎的获得将增殖后的淡黄色、颗粒状的胚性愈伤组织转接到体细胞胚分化培养基MS5(铺垫无菌滤纸)上,并设置不同浓度的激素组合,CK为对照组,C1为MS5+0.1 mg/L KT+0.1 mg/L 2,4-D,C2为MS5+0.1 mg/L KT+0.05 mg/L IBA,每25-28 d继代一次,继代培养3次后,统计体细胞胚胎发生数和子叶胚发生率。
1.2.6 体细胞胚胎的成熟及植株再生将未成苗的体细胞胚胎每12-15 d继代培养一次,每次继代时将不同时期的体细胞胚胎分开培养,直至获得完整子叶胚,将其接种到MS6培养基进行生根培养,获得完整植株。
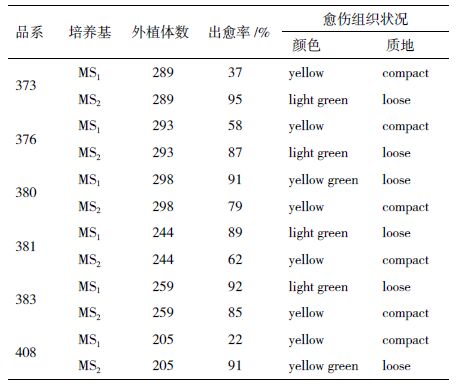
2 结果 2.1 愈伤组织的诱导和生长外植体接种到MS1和MS2之后,4-6 d左右两端切口开始膨大,开始形成愈伤组织;30 d后可观察到大量的愈伤组织。本研究所用的2 种激素组合均可以诱导形成愈伤组织,在前期的预实验中,采用双因素区组设计的方法分别筛选出KT/2,4-D与KT/NAA的最适浓度,结果表明0.1 mg/L 2,4-D+0.1 mg/L KT 激素组合和0.3 mg/L NAA+0.1 mg/L KT激素组合诱导愈伤组织的效果最佳。愈伤组织诱导率在6个品系之间有所差异,变幅为 22%-95%(表 2)。同一个品系在不同的激素组合处理下,诱导出的愈伤组织状态和诱导率也有很大差异,通过实验结果分析,KT+2,4-D的激素组合处理下,愈伤组织多为黄色或黄绿色,海岛棉品系380、381和383出愈率较高,分别为91%、89%和92%,且状态较好;KT+NAA的激素组合处理下,海岛棉品系373、376和408出愈率较高,分别为95%、87%和92%,外植体上有数量不等的不定根形成。
由图 1可知,A1处理下,6个品系在20-25 d左右即可诱导出新的胚性愈伤组织,且出愈率分别为42%、24%、58%、34%、74%和78%;而A2处理下,在40 d左右才能观察到极少量的胚性愈伤组织,且诱导率0%、1%、4%、2%、6%和2%。因此,将新挑出的初生性胚性愈伤组织接种到MS4培养基,并在同一个培养瓶中放入已获得的其他品系的胚性愈伤,可大大提高此棉花品系出现胚性愈伤的速度和可能性,且此方法适用于本实验的6个不同基因型的海岛棉品系;因此可以推断出:通过胚性愈伤组织次生代谢物的影响,可以加快初生性胚性愈伤组织向胚性愈伤组织分化的进程。
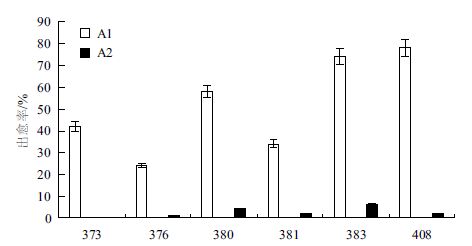
|
| 图 1 各海岛棉品系愈伤处理情况 |
由图 2可以看出,胚性愈伤组织由胚性细胞和非胚性细胞组成,胚性细胞边缘清晰完整,与周围的非胚性细胞有明显的界限,细胞核明显,细胞质浓厚,染色清晰,胚性细胞有的位于愈伤组织内部,有的位于边缘,它处于增殖旺盛和分化的状态,有胚胎发生能力;周围未分化的非胚性细胞排列疏松,大而不规则,只能看清细胞壁,看不到明显的细胞核,细胞液泡化程度高,细胞质少而染色浅,细胞间的空隙较大,这类细胞虽具有增殖能力,但没有胚胎发育能力。而且,胚性愈伤中的胚性细胞和非胚性细胞差别较大,容易辨别。而不同基因型的海岛棉胚性愈伤组织细胞学之间并无明显差异。

|
| 圆圈部分所示为部分胚性细胞 图 2 六个海岛棉品系胚性愈伤组织细胞学观察 |
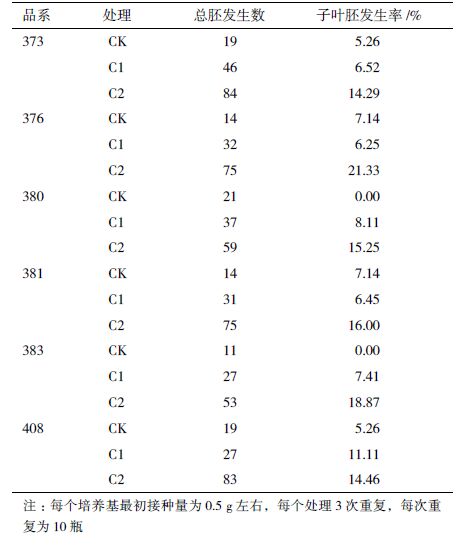
以不加激素的MS5培养基为对照,进行了不同激素组合对体细胞胚胎发生影响的研究。表 3显示,不加激素的情况下,总胚发生数较少,子叶胚发生率很低,最高为7.14%,C2处理下,总胚发生数和子叶胚发生率均有明显提高,6个棉花品系子叶胚发生率分别为14.29%、21.33%、15.25%、16.00%、18.87%和14.46%。说明对于不同基因型的海岛棉品系,添加激素均有利于诱导海岛棉体细胞胚胎发生,KT+2,4-D激素组合处理下,虽也能促进体细胞胚胎发生,但效果不太明显,而KT+IBA激素组合则能显著提高子叶胚发生率,缩短胚性愈伤分化为体细胞胚胎的时间,有效地缩短了海岛棉再生体系的周期。
诱导出的体胚中有畸形苗的发生率非常高(80%以上),将畸形苗转入MS6培养基,一般30 d左右就会褐化死亡,将死亡的畸形苗放置在MS6培养基上继续培养,会发现畸形苗的根部附近会生长出大量胚性愈伤组织和体细胞胚胎(图 3-B),将所得胚性愈伤及体细胞胚再次放入MS5培养基后所得到的胚性愈伤再生能力强且畸形率仅为37%左右,使棉花再生体系培养周期缩短3-4个月[7]。这一现象的出现为缩短棉花再生体系周期提供了新的途径。

|
| A:畸形苗转接到MS6培养基;B:畸形苗根部出现大量的胚性愈伤和体胚;C:体胚形成;D:再生苗的生成 图 3 畸形苗的培育过程 |
诱导愈伤组织是棉花组织培养的起始阶段,能否获得活力旺盛且易分化的愈伤组织是获得棉花再生植株的前提。棉花愈伤组织诱导的激素主要有KT、ZT、2,4-D、NAA和IBA等,生长素与细胞分裂素的合理结合可促使状态较好愈伤组织的诱导[3]。本研究表明不同浓度的2,4-D/KT和NAA/KT两种激素组合均可使海岛棉诱导出愈伤组织。在愈伤组织诱导培养基中加入0.1 mg/L 2,4-D和0.1 mg/L KT,愈伤多为淡黄色,增殖速度较,是海岛棉380、383和381愈伤组织最佳诱导条件;在愈伤组织诱导培养基中0.3 mg/L NAA和0.1 mg/L KT,愈伤多为淡绿色,增殖速度较慢,易长出不定根,而不定根附近较易诱导出胚性愈伤,是373、376和408愈伤组织最佳诱导条件。有研究表明380、381和383亲缘关系较为接近[11],因此,针对不同基因型的棉花品系,应设计不同的激素组合及配比,亲缘关系较近的品系可采用相同或相似的激素组合。
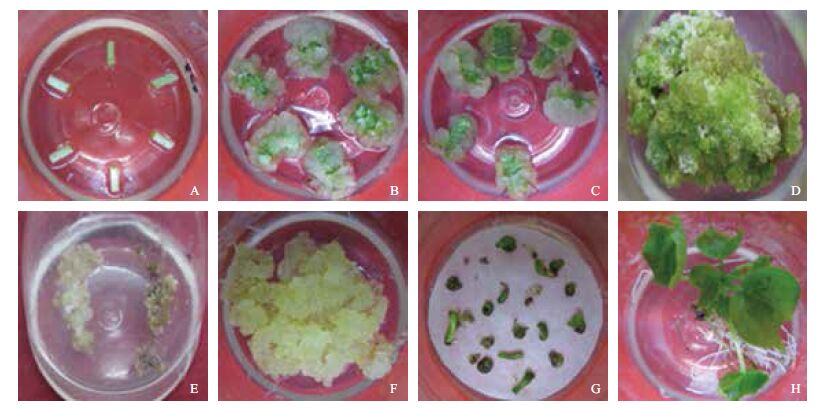
|
| A:下胚轴切为短茎接种到愈伤组织诱导培养基;B:下胚轴接种在MS1上30 d后愈伤组织诱导状况;C:下胚轴接种在MS2上30 d后愈伤组织诱导状况;D:MS3培养基上分化出的愈伤组织;E:初生性胚性愈伤组织(右侧);F:MS4培养基上继代两次后的胚性愈伤组织;G:MS5培养基(铺垫无菌滤纸)上诱导出的体细胞胚胎;H:MS6培养基上萌发出的再生植株 图 4 海岛棉的愈伤组织诱导和体细胞胚胎发生 |
在海岛棉再生体系中,海岛棉胚性愈伤组织的挑选和继代培养是非常关键的一个阶段。本研究通过胚性愈伤组织次生代谢物的影响,将新挑出的初生性胚性愈伤组织与已获得的其他品系的胚性愈伤接种到同一个培养瓶中,以此提高此棉花品系出现胚性愈伤的速度,此方法可适用于所有海岛棉品系,提高胚性愈伤发生率,有利于缩短海岛棉再生体系周期。
胚性愈伤组织细胞学观察中,胚性细胞与非胚性细胞在形态上差别很大,胚性细胞之间结合紧密,且多分布在细胞边缘,细胞核位于细胞中央,有明显的核仁结构,细胞壁也较厚,细胞间在生理上出现相对隔离。可依此推测,在胚性细胞的发生与发育过程中处于相对独立状态,有利于形成成熟的体细胞胚及其进一步的发育[12]。
体细胞胚胎发生是棉花组织培养的关键环节,氮源和激素是影响体细胞胚胎发生和成熟的重要因素[13, 14, 15],增加 KNO3的浓度能促进体细胞胚的发生[16]。张宝红等[17]研究发现IBA、ABA、IAA、BA、KT、ZT和ZiP对棉花体细胞胚胎发生具有促进作用,IBA+KT组合通常用来继代培养胚性愈伤组织和促进体细胞胚胎发生[18]。本研究中将淡黄色、颗粒状的胚性愈伤转入KNO3加倍,去除NH4NO3并铺垫无菌滤纸,添加KT和IBA的MS5培养基中,5-7个月即可成功诱导出6个海岛棉品系的体细胞胚胎。
畸形苗的发生是植物组织培养中一种常见的生理异常现象,严重制约着植物组织培养技术的发展。畸形苗的产生与形成是多因素共同作用的结果[19],很难从根本上解决这一问题,但是可以将这些畸形苗加以合理的利用,使畸形胚转化为正常苗。本实验通过对畸形苗的培育研究,探索出了一条由畸形苗直接获得体胚的捷径。
棉花体细胞再生技术已经较为完善,但当前的海岛棉再生体系还不能完全克服海岛棉基因型限制。因此,优化海岛棉再生体系是一项值得探索的工作。基因型对棉花体细胞胚胎发生和植株再生的限制只是相对而言的,关键在于能否根据供试材料的遗传背景采取与之相适应的培养手段和措施。相对而言,陆地棉的再生体系较为简单,诱导愈伤组织所用的浓度较低[20],体细胞胚胎的分化速度较快且分化率较高[21]。本研究以下胚轴为外植体,对海岛棉的再生体系进行优化研究,获得了6个海岛棉品系的再生植株,扩展了海岛棉再生基因型,为促进新疆海岛棉转基因研究具有一定的意义。
4 结论本研究以下胚轴为外植体材料,成功建立了6个海岛棉品系的再生体系,在6-8个月均获得了再生植株。在愈伤组织诱导阶段,在培养基中添加0.1 mg/L 2,4-D和0.1 mg/L KT 时,海岛棉380、383和381愈伤组织诱导效果最好,而添加0.3 mg/L NAA和0.1 mg/L KT 则为海岛棉373、376和408愈伤组织最佳诱导条件;在胚性愈伤组织诱导阶段,利用成熟的胚性愈伤组织产生的次级代谢产物可加快胚性愈伤组织的分化;在体细胞胚胎分化阶段,在培养基中添加0.1 mg/L KT和0.05 mg/L IBA可促进体细胞胚胎的发生和成熟,而且利用畸形苗的培育可缩短再生体系的周期。
| [1] | 王献礼, 戴翠荣, 贺美球, 等. 新疆长绒棉品种性状分析及其有关问题的探讨[J]. 中国种业, 2014(11): 28-30. |
| [2] | 武秀明, 刘传亮, 张朝军, 等. 棉花体细胞胚胎发生的研究进展[J]. 植物学通报, 2008, 25: 469-475. |
| [3] | Davidonis GH, Hamilton RH. Plant regeneration from callus tissue of Gossypium hirsutum L. [J]. Plant Science Letters, 1983, 32: 89-93. |
| [4] | Zhang BH, Feng R, Li X. Anther culture and plant regeneration of cotton(Gossypium klotzschianum Anderss)[J]. Chinese Science Bulletin, 1996, 41(2): 145-148. |
| [5] | 贺雅婷, 曲延英, 孔庆平, 等. 海岛棉愈伤组织诱导及分化的影响因素初探[J]. 分子植物育种, 2008, 6: 597-602. |
| [6] | 李杨阳. 海岛棉再生体系的优化及转化NAC转录子家族基因海岛棉的研究[D]. 乌鲁木齐: 新疆农业大学, 2011. |
| [7] | 李琼. 棉花体细胞胚胎发生机制研究及p53基因的遗传转化[D]. 乌鲁木齐: 新疆农业大学, 2012. |
| [8] | Murashige T, Skoog F. A revised medium for rapid growth and Bio Assays with tobacco tissue cultures[J]. Physiologia Plantarum, 1962, 15(3): 473, 497. |
| [9] | Gamborg OL, Miller RA, Ojima K. Nutrient requirements of suspension cultures of soybean root cells[J]. Experimental Cell Research, 1968, 50(1): 151-158. |
| [10] | 代鑫. 海岛棉组培过程细胞形态特性与基因表达差异的研究[D]. 乌鲁木齐: 新疆农业大学, 2010. |
| [11] | 谢元元. 127份海岛棉遗传多样性分析[D]. 乌鲁木齐: 新疆农业大学, 2013. |
| [12] | 刘振虎, 卢欣石, 葛军. 紫花苜蓿愈伤组织及体细胞胚的细胞学观察[J]. 草业科学, 2005, 22: 37-40. |
| [13] | 迟吉娜, 李喜焕, 王省芬, 等. 棉花体细胞胚胎发生和植株再生的影响因素[J]. 棉花学报, 2004, 16: 55-61. |
| [14] | 王志才, 木合热皮亚·艾尔肯, 廖茂森, 等. 影响棉花体细胞胚胎发生和植株再生的关键因素分析[J]. 新疆农业科学, 2011, 48: 39-44. |
| [15] | 朱华国, 张献龙, 金双侠, 等. 两种常用激素组合下棉花体细胞胚胎发生过程的组织学观察[J]. 棉花学报, 2012, 24: 159-166. |
| [16] | Trolinder NL, Goodin JR. Somatic embryogenesis in cotton(Gossypium). II. Requirements for embryo development and plant regeneration[J]. Plant Cell Tissue and Organ Culture, 1988, 12(1): 43-53. |
| [17] | 张宝红, 刘方. 外源激素对棉花体细胞胚胎发生及发育的调控作用[J]. 棉花学报, 2000, 21(1): 17-21. |
| [18] | Sun Y, Zhang X, Huang C, et al. Somatic embryogenesis and plant regeneration from different wild diploid cotton(Gossypium)species[J]. Plant Cell Reports, 2006, 25(4): 289-296. |
| [19] | 任辉丽. 植物组织培养中畸形苗发生机理的研究进展[J]. 生物技术世界, 2014(10): 63. |
| [20] | 周小凤, 金双侠, 李保成, 等. 初步研究不同激素对海岛棉体细胞胚胎发生的影响[J]. 中国农学通报, 2009, 25(11): 78-83. |
| [21] | 阿依夏木姑丽·司马依力, 曲延英, 色娜瓦尔·买买提明, 等. 海岛棉与陆地棉激素诱导胚性愈伤组织的研究[J]. 棉花学报, 2013, 25: 352-358. |