韭菜(Allium tuberosum Rottler)属百合科葱属,原产于中国,由于其具有特殊的风味和营养价值及抗癌功能[1],深受人们的喜爱。韭菜既可以进行种子繁殖,也可以进行无性繁殖,但是在生产中大多采用多年生的方式进行生产,而不是采用种子繁殖的方式,因此,在育种中不像其他的蔬菜如茄果类和叶菜类等方便进行杂交育种。采用现代分子育种方法进行品种的选育具有非常简便的优点,因此,进行遗传转化就成为一个必要的条件,但在韭菜的遗传转化研究方面还较少。目前许多葱蒜类蔬菜已经建立了高效的再生体系和成熟的转化系统[2, 3, 4],而且均是采用农杆菌介导的方法取得成功。由于农杆菌介导法具有简便、单拷贝等优点,已经广泛应用于植物的遗传转化中,但是该方法的建立需要高效的再生系统作为前提。
有关韭菜组织培养方面的研究早在1977年就已经开始[5],1992年,Pandey等[6]通过茎尖的诱导进行了韭菜的离体繁殖,随后Matsuda等[7]由茎尖获得胚性愈伤进而得到再生的植株,效率明显提高。人们通过未成熟胚[8]和未受精的子房[9]也诱导出愈伤组织,进而成功得到了再生植株。在根外植体研究方面,Shuto等[10]和张松等[11]均通过根尖诱导愈伤组织,进而分化为植株,但是没有形成高频的具备鳞茎的单独植株。其后也有一些相关的报道[12, 13],但是在激素配方的使用方面相差很大,且研究结果不系统,因此本实验在前人研究的基础上,通过比较各个配方及根系的不同部位,进行再生过程的优化,以期从中选出最佳的激素配方和合适的根外植体,提高形成单株组培苗的频率,为今后的遗传转化奠定基础。
1 材料与方法 1.1 材料 1.1.1 植物材料及外植体准备试验于山西农业大学植物组培实验室进行。韭菜采用“汉中冬韭”品种,种子购于山西省侯马市农人种业有限公司。
将韭菜种子冲洗干净,75% 乙醇中消毒30 s,用无菌水冲洗3-5次,再在含有0.1%升汞和0.1% Tween-20的混合溶液中消毒10 min,用无菌水冲洗3-5次;消毒后的种子播种在含1/2MS固体培养基的9 cm的培养皿中,进行发芽,每个培养皿50粒种子。7 d左右,种子萌发生长获得1 cm无菌胚根。
1.1.2 培养基及培养条件基础培养基采用MS培养基,含3%蔗糖和0.65%琼脂粉,用1.0 mol/L NaOH调节培养基的pH为5.8,使用前121℃高压灭菌20 min。为了不同的试验目的,在基础培养基中添加不同种类和浓度的激素。
培养温度为(25±1)℃,光照度为1 500-2 500 lx,光照时间为光/暗:16 h/8 h。
1.2 方法 1.2.1 外植体选择在无菌环境下,切取韭菜无菌胚根的尖、中、上3个部位,长为1.5-2 mm,参照之前的结果放置在含2 mg/L BA和1 mg/L NAA的MS培养基上诱导愈伤组织[14]。每5 d观察统计愈伤组织分化情况,比较愈伤组织诱导的结果,以确定根系外植体的最佳部位。
1.2.2 愈伤组织及不定芽的诱导为了确定不定芽诱导的最佳配方,将韭菜胚根尖放置在不同浓度BA(1、1.5和2 mg/L)、NAA(0.5、1和1.5 mg/L)、KT(0.5、1和1.5 mg/L)正交组合及2 mg/L BA + 1 mg/L NAA的MS培养基中,观察愈伤组织的分化及不定芽的分化,以得到愈伤组织及不定芽分化的最佳激素配方。
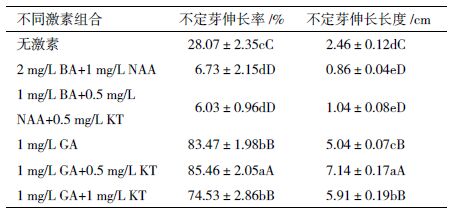
1.2.3 不定芽伸长将丛状不定芽分为5-7个一簇,携带愈伤组织,分别放置在不含植物激素、含2 mg/L BA + 1 mg/L NAA、2 mg/L BA+1 mg/L NAA+0.5 mg/L KT、1 mg/L GA及1 mg/L GA+KT(0.5和1 mg/L)的MS培养基中,进行不定芽的伸长,以期选择不定芽伸长的最佳配方。
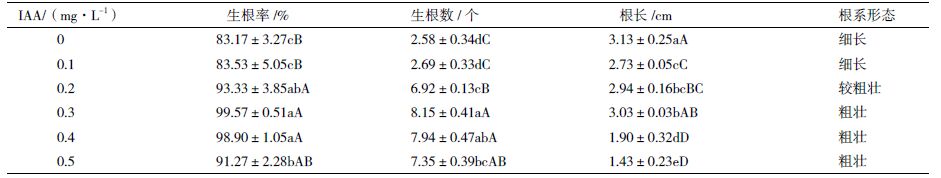
1.2.4 不定芽的生根将伸长培养得到的独立健壮的韭菜植株(高3 cm左右)从愈伤组织上分离,转移到含0、0.1、0.2、0.3、0.4和0.5 mg/L IAA的1/2 MS固体培养基中进行生根,每2 d观察一次,观察记录生根的早晚、生根率和根系的发育状况。
2 结果 2.1 外植体的确定将胚根各部放于愈伤组织诱导培养基上,诱导培养7 d后,不同部位的根段均开始膨大,胚根尖变得白色透明,胚根中部和上部的根段大部分为翠绿透明状。20 d左右,愈伤组织从韭菜根尖开始形成,并且迅速膨大,但是中上部的根段几乎没有形成的愈伤组织(图 1)。50 d后记录愈伤组织的诱导率,统计分析的结果(表 1)表明,不同部位根尖愈伤组织的诱导效果差异显著,以胚根尖端部位诱导效果为最好,愈伤组织诱导率达到81.40%,此外,从胚根尖诱导出的芽数也显著高于其它两个部位。

|
| 图 1 胚根不同部位愈伤组织及不定芽诱导比较 |
切取无菌胚根的根尖(图 2-A),放置在含12种不同激素组合处理的培养基中诱导愈伤组织,并分化不定芽。7 d后,根段开始膨胀变粗,15 d后,从切口处开始形成愈伤组织,30 d左右,愈伤组织直径达到2 mm,50 d后,愈伤组织直径达到5 mm(图 2-B),记录愈伤组织的诱导率并进行统计分析的结果表明,2、3、10和11 这4个配方愈伤组织的形成率均达到75%以上,而且相互间无显著性差异(表 2);随后,愈伤组织开始逐步分化不定芽(图 2-C),15 d后,明显可见绿色健壮的不定芽(图 2-E),随着时间的延长,分化的不定芽数及长度不断增加,30 d后不定芽长达1 cm(图 2-F和2-G),比较几种组合,3和11组合的不定芽分化率为71.73%和69.30%,平均诱芽数为16.53和9.56;而2和10组合的不定芽分化率分别达到77.17%和78.83%,不定芽的平均分化数为25,显著高于其他组合。因此,把1 mg/L BA+1 mg/L NAA+1 mg/L KT和1 mg/L BA+0.5 mg/L NAA+0.5 mg/L KT作为韭菜胚根诱导不定芽分化的最佳配方。

|
| A:1 cm胚根;B:胚根尖愈伤组织的诱导过程,从左向右分别为:7、15、30和50 d;C:愈伤组织分化芽;D:胚性愈伤分化不定芽石蜡切片;E:不定芽的分化;F:愈伤组织分化的丛生不定芽;G:丛生芽;H:不同培养基上不定芽形态,a:2 mg/L BA + 1 mg/L NAA,b:1 mg/L GA,c:1 mg/L GA + 0.5 mg/L KT;I:伸长后的不定芽;J:分化鳞茎的独立韭菜植株;K:生根植株;L:无菌苗驯化栽培 图 2 韭菜根外植体愈伤组织诱导及不定芽的分化 |
通过组织学发生分析愈伤组织的形成途径,证明愈伤组织先由根外植体诱导形成,然后由愈伤组织直接分化为芽体(图 2-D)。
2.3 不定芽的伸长及鳞茎的分化在诱芽培养基中,虽然愈伤组织分化出许多不定芽,但却是丛生的,难以生成独立植株。为了使其尽快分化为单独的植株,将不定芽分为5-7个一簇,放入不同的培养基中。当培养基中不加激素时,出现不定芽伸长、生根及继续分化不定芽等各种情况,形态不一致,而在诱导愈伤和不定芽的培养基中,愈伤组织继续分化不定芽,不定芽不进行伸长(图 2-Ha)。在含GA的培养基中,15 d后不定芽伸长达到5 cm,但仅仅使用GA,植株细弱(图 2-Hb),加入KT后,不定芽的平均伸长长度为7.14 cm,且非常健壮(图 2-Hc和图 2-I)。30 d后不定芽形成鳞茎进而形成独立植株,成为健壮独立的韭菜小苗(图 2-J)。统计不定芽伸长率(不定芽伸长1 cm以上的植株数/总植株数)及平均伸长长度(表 3),在MS+1 mg/L GA+0.5 mg/L KT和MS+1 mg/L GA的培养基上,不定芽的伸长率均达到80%以上。综合考虑统计结果和生长状态,不定芽伸长的最佳配方为MS+1 mg/L GA+0.5 mg/L KT,操作时每块愈伤组织尽可能含较少的芽体便于其更好地发育成独立的小苗。
将3 cm高的韭菜植株转移到生根培养基上,5 d后未加IAA的组合最先开始生根,7-9 d后含IAA的组合都开始逐渐生根,15 d后观察统计各个配方下生根情况及根系状态,结果(表 4)表明,未加IAA的配方生根最早,但是生根数少,且根系细长。含有0.3 mg/L IAA时,根系数达到8条以上,根系粗壮且根长与未加IAA配方没有极显著的差异。浓度继续增高时,生根数量也提高,但根系呈现短粗状。因此韭菜植株生根的最佳配方为1/2 MS+0.3 mg/L IAA(图 2-K)。
在韭菜中已经建立了通过胚胎发生进行离体组培的系统,但是需要采用小植株来完成[7]。本试验以韭菜的胚根根尖作为外植体,外植体容易获得,在任何时候都可以进行,不受季节的影响。不仅节约外植体得到的时间,而且形态一致。比较不同部位诱导愈伤的情况,胚根尖饱满,可以明显区分其分生组织,愈伤组织的诱导率达到81.4%以上,为最佳部位,这与屈二军等[13]报道的胚根愈伤组织的诱导率相一致。
在植物组织培养过程中,植物激素的种类和比例对愈伤组织和不定芽的形成有着重要的影响。细胞分裂素和生长素的比例显著影响愈伤组织的形成率,而细胞分裂素的浓度显著影响不定芽的分化率,尤其是细胞分裂素KT对不定芽的分化有很大的意义。张松等[11]研究表明愈伤组织诱导及不定芽分化的最佳配方为MS+1 mg/L NAA+2 mg/L BA。细胞分裂素KT应用在很多葱蒜类组织培养试验中,提高愈伤组织诱导率,尤其是不定芽的增殖率。本试验表明,当细胞分裂素BA和KT共同与NAA作用时,愈伤组织的诱导速度快,比率高,更重要的是每个愈伤组织分化的不定芽达到20-30个,大大提高了增殖率。
在之前的韭菜再生过程中,植株分化形成丛生的不定芽,没有形成带有假茎的单独的不定芽,难以生根,只能将含有多个不定芽的愈伤组织一起生根,这样不易获得独立的植株,因此,繁殖系数较低、成活率也低,整个过程中也没有形成单独的植株[14]。Zdravković-Korac等[2]在洋葱的研究结果表明,不定芽经过进一步增殖可形成具有鳞茎的独立植株。本试验将韭菜不定芽放置在MS+1 mg/L GA+0.5 mg/L KT中伸长生长,能快速形成明显与愈伤组织分离的独立健壮的韭菜苗,大大缩短了时间,提高了再生的效率。另外,韭菜苗在1/2MS + 0.3 mg/L IAA中,植株生根的条数与形态最佳,且与之前韭菜丛生芽生根的情况一致[14]。
4 结论采用胚根尖作为外植体,在培养基(2 mg/L BA+1 mg/L NAA)上诱导愈伤,50 d后愈伤直径可达5 mm,此时部分愈伤开始分化不定芽,将其转到诱芽培养基上(1 mg/L BA+0.5 mg/L NAA+0.5 mg/L KT),15 d就可以长出丛生芽。再生长15 d后,丛生芽数达到25-30个,最高达到3 cm。将丛生不定芽转到伸长培养基中(1 mg/L GA+0.5 mg/L KT),30 d就可以得到独立的小苗,将其转移到生根培养基中(0.3 mg/L IAA)进行生根,5 d左右就可以开始生根,15 d后即可得到根系健壮的独立韭菜植株。因此经过130 d左右即可从胚根脱分化再生出植株。
| [1] | Shao J, Dai J, Ma JK. A pilot study on anticancer activities of chinese leek[J]. J Altern Complement Med, 2001, 7: 517-522. |
| [2] | Zdravković-Korać S, Milojević J, Tubić L, et al. Somatic embryogenesis and plant regeneration from root sections of Allium schoenoprasum L. [J]. Plant Cell Tiss Org Cult, 2010, 101: 237-244. |
| [3] | Eady C, Davis S, Catanach A, et al. Agrobacterium tumefaciens-mediated transformation of leek(Allium porrum)and garlic(Allium sativum)[J]. Plant Cell Rep, 2005, 24: 209-215. |
| [4] | Zheng SJ, Khrustaleva L, Henken B, et al. Agrobacterium tumefaciens-mediated transformation of Allium cepa L. : the production of transgenic onions and shallots[J]. Mol Breeding, 2001, 7: 101-115. |
| [5] | Zee SY, Fung A, Yue SB. Tissue culture and differentiation of chinese chive[J]. Hortsci, 1977, 12: 264. |
| [6] | Pandey R, Chandel KPS, Rao SR. In-vitro propagation of Allium-Tuberosum Rottl. Ex. Spreng. by shoot proliferation[J]. Plant Cell Rep, 1992, 11: 375-378. |
| [7] | Matsuda Y, Adachi T. Plant regeneration via embryogenesis in commercial cultivars of chinese chive(Allium tuberosum Rottl.)[J]. Plant Sci, 1996, 119: 149-156. |
| [8] | Xue HM, Araki H, Kanazawa T, et al. Callus formation and plantlet regeneration through in vitro culture of immature embryo and seedling in chinese chive(Allium tuberosum Rottler)[J]. J Jap Soc Horti Sci, 1997, 66: 353-358. |
| [9] | Kim CK, Oh JY, Chung JD. Plant regeneration of Korean native chinese chive by unpollinated ovule culture[J]. J Kor Soc Hort Sci, 1998, 39: 693-696. |
| [10] | Shuto H, Abe T, Sasahara T. In vitro propagation of plants from root apex-derived calli in chinese chive(Allium tuberosum Rottler)and garlic(Allium sativum L.)[J]. Japan J Breed, 1993, 43: 349-354. |
| [11] | 张松, 达克东, 曹辰兴, 等. 韭菜组织培养高频植株再生体系的研究[J]. 园艺学报, 2002, 29(2): 141-144. |
| [12] | 王桂英. 韭菜根尖培养及植株再生[J]. 北方园艺, 2007, 12: 199-200. |
| [13] | 屈二军, 张现青, 赵祯, 等. 韭莱愈伤组织诱导条件优化的研究[J]. 种子世界, 2008, 6: 24-25. |
| [14] | 张学智, 张彦良, 李梅兰, 等. 韭菜根再生相关因素的研究[J]. 分子植物育种, 2013, 11(1): 113-118. |