植物胚胎发生、种子萌发、营养生长、果实成熟和叶片衰老等生长发育的各个阶段都受到多种激素信号的控制[1]。随着人们对植物激素信号转导途径研究的深入,目前已发现各个激素间具有明显的相互促进与互为拮抗的关系,而这一关系与外界环境信号及自身发育程序对激素作用的调控一起组成了一个非常精细和复杂的调控网络[2, 3]。植物生长调节剂对植物生长发育的调控一般是通过调控细胞分裂、细胞分化、细胞伸长和细胞死亡等方式进行的[1, 2]。在枣(Ziziphus jujuba L.)冷藏方面,李红卫等[4, 5]发现,ABA处理促进了冬枣果肉MDA和过氧化氢的积累,提高了CAT 活性,促进了枣果实的成熟衰老,而 GA3具有延缓作用。进一步研究发现,外源ABA处理抑制了内源GA3和IAA含量的增加,促进了冬枣储藏期的成熟衰老。杨卫民等[6]认为,自然条件下GA3、CTK、IAA 与 ABA 协调着枣果实的生长和发育过程,在生理活动中表现出相互制约和拮抗的关系。薛梦林等[7]认为 GA3 处理保持了果实较好的硬度等指标,有延缓枣成熟衰老的功效。甘霖等[8]发现枣果中CAT活性与Vc总量的增加呈极显著负相关。魏天军等[9]也发现枣果实发育后期Vc含量与果实发育成熟度呈极显著的负相关关系。王如福[10]发现GA3与ABA在许多方面表现出相拮抗的生理作用,如采前GA3处理可以明显延缓采后梨枣成熟衰老的进程,从而抑制了枣果肉组织的膜透性增高和Vc的损失。张有林等[11, 12]认为ABA处理加快了枣果的衰老,促进了Vc等的下降,显著降低了鲜果率,说明 ABA 是导致枣果变软衰老的主要因素之一。到目前为止,前人的研究仅限于对枣成熟某个生理指标的讨论,对激素的调控也仅仅表现在GA3与ABA之间。本研究以山西柳林县小垣则村黄河滩枣(木枣)为应试材料,在木枣白熟期,分别用不同浓度的6-BA、IAA、GA3和ABA进行处理,通过综合检测组织中DNA、MDA、Vc、Pro含量和CAT活性等生理生化指标,研究木枣果实成熟生理及植物生长调节剂的调控作用,为调控枣果实成熟衰老机制的建立奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料木枣为吕梁当地品种,采集于柳林县孟门镇小垣则村黄河边。
1.1.2 主要试剂与仪器三氯乙酸、硫代巴比妥酸、过氧化氢、磷酸、盐酸、氢氧化钠、冰醋酸、茚三酮、乙醇、Pro、IAA、GA3、ABA和6-BA腺嘌呤。
1.1.3 仪器主要仪器TU-1901紫外可见分光光度计(北京普析)、KH-1000高速离心机(山东科华)、ALB-224电子天平(赛多利斯)、恒温水浴锅(金坛市杰瑞尔)、SHB-ⅢA循环水式多用真空泵(郑州长城科工贸)。
1.2 方法 1.2.1 实验材料的选取及分组2014年在山西柳林孟门镇小垣则村黄河滩地,选择树龄均一,大小适度的木枣28株,分成4组,每组7株。
1.2.2 实验材料的处理在木枣白熟期(2014年8月20日左右),分别以25、50、75、100和125 mg/L的ABA与GA3、IAA和6-BA喷洒木枣果实,各处理均以喷清水为对照,单枝小区,每个处理喷50个左右枣果,重复2次。于成熟期(2014年9月25日)采摘。冰冻保存。
1.2.3 DNA提取和含量测定采用改良CTAB法,参照陈碧华和李登科等[13, 14]的提取方法进行。
1.2.4 MDA含量测定采用硫代巴比妥酸法(TB-A),参照文献[15]中的方法进行。
1.2.5 Pro含量测定采用茚三酮法,参照文献[16]进行。
1.2.6 维生素C含量测定采用2,6-二氯酚靛酚法,参照文献[17]进行。
1.2.7 CAT活性测定采用紫外吸收法,参照文献[18]进行。
2 结果 2.1 木枣果实组织中DNA含量变化图 1显示,生长调节剂处理枣组织中DNA含量大小的变化为ABA>6-BA>IAA>GA3,其中,ABA和6-BA处理DNA含量最高。结果表明,6-BA、IAA、GA3和ABA是两类生理作用不同的植物激素,在诱导激素响应的表达方式也不同。

|
| 图 1 不同激素处理对木枣组织中DNA含量的影响 |
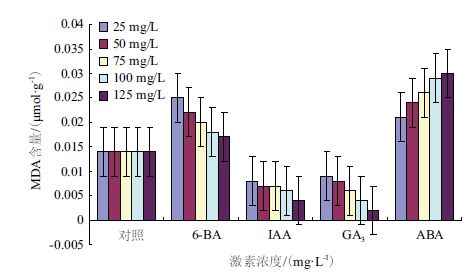
图 2显示,GA3和IAA处理枣组织中MDA含量明显低于对照组,而6-BA和ABA处理效果则相反。其中IAA处理枣组织中MDA含量最低,ABA处理则最高。结果表明,IAA、GA3与6-BA、ABA在诱导枣组织内MDA产生方面存在着相反的生理效应,6-BA处理所表现出的“意外”效果,值得进一步研究,这可能与枣果实成熟衰老的过程有别于其它核果成熟衰老的原因。
|
| 图 2 不同激素处理对木枣组织中MDA含量的影响 |
图 3显示,6-BA、IAA和GA3处理枣组织中Pro含量均明显低于对照组,ABA处理效果则相反,且效果显著。结果表明,6-BA、IAA、GA3与ABA在诱导枣组织内Pro产生方面存在着完全不同的生理效应。尤其是在诱导枣组织成熟衰老的过程中表现为相互拮抗的生理效应,这可能与它们调控枣果实成熟衰老有关。

|
| 图 3 不同激素处理对木枣组织中Pro含量的影响 |
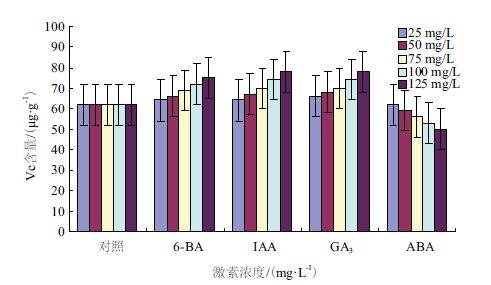
图 4显示,除ABA处理外,处理枣组织中,其它处理Vc含量均高于对照组。结果表明,6-BA、IAA和GA3促进了Vc积累,有利于增强组织抗氧化能力;ABA抑制了Vc积累,降低了组织抗氧化能力。6-BA、IAA、GA3与ABA在诱导枣组织内Vc产生方面也表现为相互拮抗的生理效应,这可能与它们调控枣果实成熟衰老有关。
|
| 图 4 不同激素处理对木枣组织中Vc含量的影响 |
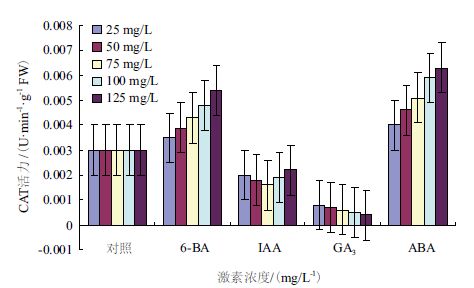
图 5显示,处理组枣组织中CAT活性表现差异很大,ABA和6-BA处理CAT活性显著高于对照组,IAA和GA3处理效果则相反。
|
| 图 5 不同激素处理对木枣组织中CAT活性的影响 |
在枣果发育阶段,不同的植物激素可诱导并激活它们各自的信号转导通路,最终通过信息的传递诱导激素响应基因的表达和表现出不同的生理现象,枣组织中DNA含量变化是激素诱导响应基因表达的结果。6-BA、IAA和GA3处理增加了DNA含量,保证了细胞分裂的正常进行;而ABA处理后枣组织中DNA含量的变化与诱导成熟衰老有关。
在植物衰老生理研究中MDA和Pro是一个常用生理指标,MDA和Pro含量变化可间接确定膜系统受损程度和体内代谢水平和发育状态。ABA处理促进了枣组织中MDA和Pro含量明显升高,可造成膜脂质过氧化和加快枣组织成熟衰老的过程。6-BA、IAA和GA3处理枣组织中MDA和Pro含量低,说明了枣组织膜脂质过氧化程度低,植物生长情况良好,有延缓枣组织成熟衰老的作用。而6-BA处理后枣组织中Pro含量表现出的 “意外效果”,需进一步研究。
Vc和CAT是植物体内对自由基伤害产生的相应保护系统成员,其含量和活性的变化,可作为抗氧化、抗衰老的重要生理指标。在枣果实成熟衰老期,ABA处理抑制了枣组织中Vc积累和提高了CAT活性,可降低枣组织抗氧化能力和加快成熟衰老的过程。6-BA、IAA和GA3处理促进了Vc积累和降低了CAT活性,有利于增强组织抗氧化能力;而有关6-BA处理诱导枣组织中CAT活性增加的原因目前还不清楚。
总之,枣果实的成熟衰老是一个复杂的生理生化过程,与植物激素的调节控制密切相关。植物激素诱导并激活了它们各自的信号转导通路,最终通过信息的传递诱导响应基因的表达和表现出不同的生理现象。
4 结论ABA处理木枣果实增加了组织中DNA、MDA和Pro含量,抑制了Vc的积累和提高了CAT活性。6-BA、IAA和GA3处理促进了枣组织中Vc积累和降低了CAT活性,减少了MDA和Pro含量。
6-BA、IAA、GA3与ABA的生理作用在多方面表现为相互促进与互为拮抗的关系,有调控木枣果实成熟衰老的作用。
| [1] | Wolters H, Jurgens G. Survival of the flexible: Hormonal growth control and adaptation in plant development[J]. Nat Rev Genet, 2009, 10: 305-317. |
| [2] | 熊国胜, 李家洋, 王永红. 植物激素调控研究进展[J]. 科学通报, 2009, 54(18): 2716-2733. |
| [3] | Santner A, Calderon-Villalobos LIA, Estelle M. Plant hormones are versatile chemical regulators of plant growth[J]. Nat Chem Biol, 2009, 5: 301-307. |
| [4] | 李红卫, 韩涛, 李丽萍. ABA、GA3 处理对冬枣采后果肉活性氧代谢的影响[J]. 园艺学报, 2005, 32(5): 793-797. |
| [5] | 李红卫, 冯双庆. 脱落酸和乙烯对冬枣果实成熟衰老的调控[J]. 食品科学, 2003, 24(2): 147-150. |
| [6] | 杨卫民, 杜京旗, 赵君. ABA与NO, GA3在枣果实发育期的网络关系与拮抗效应探讨[J]. 山西农业科学, 2014, 42(2): 195-198, 202. |
| [7] | 薛梦林, 张平, 张继澍, 王莉. 脆枣采后赤霉素处理对其生理生化的影响[J]. 园艺学报, 2003, 30(2): 147-151. |
| [8] | 甘霖, 谢永红, 吴正琴, 嘉平. 大枣果实发育过程中维生素C的变化及其相关性研究[J]. 果树学报, 2002, 19(4): 240 -242. |
| [9] | 魏天军, 窦云萍. 灵武长枣果实发育成熟期生理生化变化[J]. 中国农学通报, 2008, 24(4): 235-239. |
| [10] | 王如福. 鲜枣耐贮性的影响因素及调控机理研究[D]. 北京: 中国农业大学, 2002: 1-79. |
| [11] | 张有林, 陈锦屏. 葡萄、鲜枣采后贮期脱落酸变化与呼吸非跃变性研究[J]. 西北植物学报, 2002, 22(5): 1197-1202. |
| [12] | 张有林, 陈锦屏. 鲜枣贮期脱落酸与品质变化关系的研究[J]. 农业工程学报, 2000, 16(5): 106-109. |
| [13] | 李登科, 黄丛林, 田建保, 等. 高质量枣树基因组DNA提取方法的研究[J]. 分子植物育种, 2005, 3(4): 579-583. |
| [14] | 陈碧华. 一种改良的CTAB法提取马尾松基因组DNA[J]. 广东林业科技, 2009, 25(2): 26-29. |
| [15] | 魏天军, 窦云萍. 灵武长枣果实发育成熟期生理生化变化[J]. 中国农学通报, 2008, 24(4): 235-239. |
| [16] | 张殿忠, 王沛洪, 赵会贤. 测定小麦叶片游离Pro含量的方法[J]. 植物生理学通讯, 1990(4): 62-65. |
| [17] | 鲁周民, 张丽, 尹蓉, 张忠良. 酶解条件对红枣汁主要成分的影响[J]. 农业工程学报, 2009, 25(1): 300-302. |
| [18] | 刘世鹏, 曹娟云, 陈宗礼. 鲜枣中过氧化氢酶活性的测定[J]. 北方园艺, 2011, 17: 22-24. |



