食物过敏是食品安全面临的严峻问题[1],是由食物中致敏物质引起的免疫介导不良反应。食物过敏性疾病发病率呈逐年上升趋势,据统计全球约有3%-5% 的成年人和5%-8% 的儿童受过敏性疾病的困扰[2, 3]。为保障公众健康,美国和欧盟从2007年开始执行新的食品致敏原标签法规,要求生产企业明确标明其产品中是否含有8大类和12 种主要的食物致敏原,包括小麦、大豆、花生、芝麻、芥末、芹菜、坚果、畜禽产品和水产品等,我国国家标准《预包装食品中的致敏原成分》和《预包装食品标签通则》也对预包装食品中的主要致敏原成分及对这些成分进行标识标注的要求作了具体规定[4, 5]。大豆和芹菜含有多种复杂致敏成分[6, 7, 8, 9, 10],其食用致敏症状主要表现为过敏性皮炎、鼻炎等,严重的可能导致休克、甚至危及生命[1, 11]。而目前尚没有食物过敏的特效疗法,严格避免食入含这类成分的食物是过敏患者的最佳选择,这很大程度上依赖于标签标注。因此评价和检测食物致敏原日益受到重视。
致敏原的体外检测技术主要集中于依赖蛋白的免疫学方法和依赖于核酸的PCR方法等[12]。而基于时效性与准确性方面的优势,实时荧光PCR方法已成为食品中致敏原检测的首选[13],针对不同种类的致敏成分,很多学者在此领域作过深入细致的研究[14, 15, 16]。不过多数研究集中在传统PCR法或单重实时荧光PCR法,每个反应仅能检测出一种致敏原成分,而在一个PCR反应中同时检测出大豆和芹菜两种致敏原成分的研究尚未见报道。而如何选择合适的靶基因是进行PCR反应的前提,研究表明编码大豆凝集素的核基因lectin[17],编码线粒体ATP合成酶亚单位的atp A基因[18]都可以达到此目的,相比核基因组DNA,线粒体DNA是真核细胞核外遗传物质,基因组中无间隔系列、无组织特异性、种内遗传稳定、种间高度变异、个体不同组织中均含有大量的线粒体,可以获得较高的拷贝数[18, 19],已作为此类研究的首选。编码甘露醇脱氢酶的芹菜管家基因mtd以其种类高度保守性一直受到此类研究者的青睐[20]。因此,本研究特选择大豆atp A基因和芹菜mtd基因作为研究对象,通过对反应条件优化及方法参数评价等,建立能同时检测食品中大豆和芹菜致敏原成分的实时荧光PCR方法,旨为食品致敏原的标签监管、检测提供可靠的技术支撑。
1 材料与方法 1.1 材料 1.1.1 试验样本大豆、芹菜及各种动、植物样本购自合肥市农贸市场。
1.1.2 主要试剂和仪器Taq DNA聚合酶、dNTP、10×PCR缓冲液购自TaKaRa生物工程公司,DNA提取试剂盒购自基因科技(上海)有限公司(Cat No:526-050)。实时荧光PCR仪为ABI公司7500系列产品。
1.1.3 引物与探针序列根据GenBank中公布的大豆atp A基因(atp A,GenBank No. Z14031)和芹菜mtd(mtd,GenBank No. AF067082)基因序列,运用ABI Primer Express 软件,设计引物和探针序列(表 1),引物和探针由上海生工生物工程公司合成。待测片段长度,如图 1所示。

|
| A:大豆atpA基因扩增片段(113 bp);B:芹菜mtd基因扩增片段(150 bp) 图 1 大豆(A)和芹菜(B)基因扩增片段 |
采用DNA提取试剂盒(离心柱型)进行,提取方法详见试剂盒使用说明书。
1.2.2 实时荧光PCR反应条件的建立通过普通PCR方法,优化大豆atp A基因和芹菜mtd基因两个单重PCR反应的退火温度。在此基础上建立单重实时荧光PCR方法,反应体系:10×Taq Buffer(含Mg2+)5 μL,dNTP Mixture(2.5 mmol/L)4 μL,正、反向引物(10 μmol/L)各1 μL,探针(5 μmol/L)1 μL,Taq酶(5 U/μL)1.25 U,模板DNA(1-100 ng/μL)2.5 μL,补水至50 μL。PCR反应条件:37℃ 5 min;95℃预变性5 min,95℃变性15 s,适宜的退火温度退火延伸50 s,同时收集荧光,进行40个循环。
在上述反应体系基础上采用等量模板,引物与探针两两组合(浓度同上),建立能同时扩增大豆和芹菜成分的双重实时荧光PCR反应体系。以Ct 值、荧光增量为考察依据,优化dNTP、Taq酶在双重体系中的最适浓度,其中dNTP 的用量采用4 μL、5 μL和6 μL进行试验,Taq酶的用量采用1.25 U、2.5 U和5 U进行试验,每次只改变一个变量。
1.2.3 大豆atpA基因和芹菜mtd基因特异性检测选取大豆、芹菜、大米、小麦、大麦、花生、芝麻、玉米、马铃薯、蕃茄、核桃、开心果、腰果、葵花籽、杏仁、苹果、梨和草莓等植物类样本和猪肉、牛肉、羊肉和鱼肉等动物类样本的基因组DNA作为PCR反应的模板,以去离子水作为阴性对照模板,进行实时荧光PCR扩增。
1.2.4 大豆atp A基因和芹菜mtd基因灵敏度检测提取大豆、芹菜、大米基因组DNA后将浓度调整为100 ng/µL,然后将1 µL大豆DNA、1 µL芹菜DNA与8 µL大米DNA混合得到10%的大豆和10%芹菜DNA混和样本。用TE将10%的大豆和芹菜DNA混和样本进行10倍系列稀释从而获得同体积条件下绝对含量相当于1%、0.1%、0.01%和0.001%的大豆或芹菜DNA样本,作为PCR反应的模板,以去离子水作为阴性对照模板。
1.2.5 模拟实物样品检测本研究采取摸拟实物样本,以盲样的方式进行试验。按照大豆、芹菜制品加工配方,制备含有大豆或芹菜的样本4组,每组4个平行,样本配方如表 2所示。
为了获得满意的退火温度,通过普通PCR方法,发现大豆atp A基因在60℃、58℃、芹菜mtd基因在62℃、60℃时均能有效扩增,所以选择60℃为两个单重反应适宜的退火温度。在此基础上,按1.2.2的反应体系和反应条件进行实时荧光PCR扩增,分别收集FAM荧光和HEX荧光,两个单重反应都能出现稳定的扩增曲线。
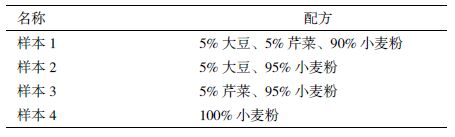
同时经优化筛选,在等量模板,两对引物和探针浓度均一致的前提下,dNTP的用量为5 μL、Taq酶的用量为2.5 U时,双重体系中的每个基因均能稳定扩增,且FAM荧光增量和HEX荧光增量相接近。其中阳性样本以大豆和芹菜基因组DNA作为模板,阴性对照以去离子水作为模板,PCR扩增结果见图 2。
|
| 1,2:阳性样本(大豆FAM、芹菜HEX);3,4:阴性对照(去离子水) 图 2 大豆和芹菜致敏原成分实时荧光PCR扩增曲线 |
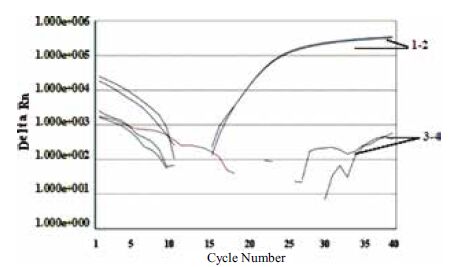
为了获得待选序列的特异性情况,按1.2.3进行特异性实验,结果表明,仅大豆atp A基因和芹菜mtd基因的DNA作为模板的阳性对照品能收集到明显的荧光扩增曲线,而其余20种常见动植物种类样本的DNA及去离子水作为模板时,FAM和HEX荧光扩增均为阴性(Ct>40)。扩增结果如图 3所示。因此本研究选择的引物和探针序列特异性符合要求。
|
| 1,2:大豆、芹菜(FAM、HEX);3,44:大米、小麦、大麦、花生、芝麻、玉米、马铃薯、蕃茄、核桃、开心果、腰果、葵花籽、杏仁、苹果、梨、草莓、猪肉、牛肉、羊肉、鱼肉和阴性对照(FAM、HEX荧光) 图 3 方法特异性研究扩增曲线 |
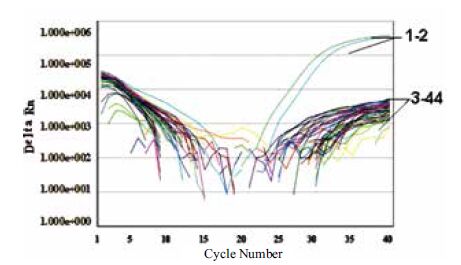
为了获得方法的最低检出限,按1.2.4进行灵敏度实验,结果表明,以含10%、绝对含量相当于1%、0.1%和0.01%的大豆atp A基因和芹菜mtd基因DNA样本作为模板时,能收集到明显的FAM荧光和HEX荧光扩增曲线,而以绝对含量相当于0.001%的大豆和芹菜的DNA样本和去离子水作为模板时,FAM荧光和HEX荧光扩增为阴性(图 4)。因此本方法的最低检出限达0.01%。
|
| 1:10%大豆和芹菜(FAM、HEX);2:1%大豆和芹菜(FAM、HEX);3:0.1%大豆和芹菜(FAM、HEX);4:0.01%大豆和芹菜(FAM、HEX);5:0.001%大豆和芹菜(FAM、HEX);6:阴性对照(FAM、HEX) 图 4 方法灵敏度研究扩增曲线 |
为了对方法的实际结果进行评价,采取摸拟实物样本,以盲样的方式进行试验。结果表明,样本1四个平行均检出大豆和芹菜成分,样本2四个平行均检出大豆成分,样本3四个平行均检出芹菜成分,样本4四个平行均未检出大豆或芹菜成分,检测结果与实际情况完全吻合。
3 讨论传统的依赖于蛋白质的食品致敏原免疫学检测方法,因食物在生产加工过程中蛋白质易变性和降解而导致假阴性结果,使得依赖于核酸的检测方法,尤其是PCR法已成为当前食品安全检测机构的主流检测方法[13]。本研究运用双重实时荧光PCR技术,首次将大豆和芹菜两种食品致敏原成分在同一个体系中实现同时检测。方法主要从靶基因的选择,双重体系的优化等方面着手,选择大豆atp A基因和芹菜mtd基因作为靶基因,设计两对具有相近的Tm值和熔解温度的引物,扩增片段长度分别为113 bp和150 bp;同时对双重体系中dNTP、Taq酶浓度进行了优化,最终确定dNTP的用量为5 μL、Taq酶的用量为2.5 U时在双重体系中两个反应都能达到较好的效果。后续研究表明建立的方法行之有效。
当然每种方法都有各自的优越性,在致敏原检测领域,一些新技术新方法的应用,也是对 PCR 等常规检测方法的丰富和发展。如以核酸为研究对象,Mustorp等[21]应用多重连接探针扩增技术(MLPA),一次性从食品样本中检测出花生、芝麻等多种致敏原成分,该技术结合了DNA探针杂交和PCR技术,反应的通量更大,特异性更强。刘昊等[22]应用环介导等温扩增技术(LAMP)建立了一种食品中开心果致敏原的快速检测方法,操作简便,不需要通过昂贵的仪器用肉眼就能观察到反应结果。当然因这些方法对样本的纯度要求高,操作不慎易受污染等因素目前还没有得到广泛应用。同时以核酸为研究对象的检测方法如PCR 等无法检测到过敏蛋白,某些食品生产加工程序可能导致蛋白和 DNA分离,因此检测结果不能与食物的真正致敏性相关,使得这类检测方法也有一定的局限性。Cucu等[23]利用质谱的方法快速检测并筛选胰蛋白酶酶解的大豆片段的稳定性,研究说明来自大豆球蛋白的G1401Val-Arg410和β-伴大豆球蛋白α'链518Gln-Arg528最稳定,这些多肽可用来作为研发大豆过敏原检测方法的靶肽。表明以致敏蛋白为研究对象的质谱方法在未来致敏原检测领域将有很大的发展空间,它能弥补单纯依赖核酸检测方法的局限性和不足。
4 结论本研究基于双重实时荧光PCR技术,根据大豆atp A基因和芹菜mtd基因设计特异性引物,利用不同荧光素标记的TaqMan探针,建立了一种实时荧光PCR检测方法,可同时检测食物中大豆和芹菜致敏原成分。并对方法的特异性和灵敏度等参数进行评价,测试结果表明方法特异好,灵敏度高,对大豆和芹菜成分的检出限均达0.01%。同时应用本方法对摸拟实物样本进行试验,检测结果与实际情况完全吻合。因此本方法可以作为同时检测食品中大豆和芹菜致敏原成分的高效检测方法。
| [1] | Taylor SL, Hefle SL. Food allergen labeling in the USA and Europe[J]. Curr Op in Allergy Clin Immunol, 2006, 6(3): 186-190. |
| [2] | Sicherer SH, Sampson HA. Food allergy[J]. Journal of Allergy and Clinical Immunology, 2010, 125(2): 116-125. |
| [3] | Gendel SM. Comparison of international food allergen labeling regulations[J]. Regul Toxicol Pharmacol, 2012, 63(2): 279-285. |
| [4] | 中国国家标准化管理委员会. GB/T 23779-2009 国家标准: 预包装食品中的致敏原成分[S]. 北京: 中国标准出版社, 2009. |
| [5] | 中华人民共和国卫生部. GB 7718-2011 食品安全国家标准: 预包装食品标签通则[S]. 北京: 中国标准出版社, 2011. |
| [6] | Franke AA, Halm BM, Ashburn LA. Isoflavones in children and adults consuming soy[J]. Archives of Biochemistry and Biophysics, 2008, 476(2): 161-170. |
| [7] | Chiu ML, Lawi W, Snyder ST, et al. Matrix effected a challenge toward automation of molecular analysis[J]. The Association for Laboratory Automation(J ALA), 2010, 36(3)233-242. |
| [8] | Torp AM, Olesen A, Sten E, et al. Specific, semi-quantitative detec-tion of the soybean allergen Glym Bd 30K DNA by PCR[J]. Food Control, 2006, 17(1): 30-36. |
| [9] | Franck P, Vautrin MD, Dousset B, et al. The allergenicity of soybean-based products is modified by food technologies[J]. International Archivesof Allergyand Immunology, 2002, 128(3): 212-219. |
| [10] | Ogawa T, Samoto M, Takahashi K. Soybean allergens and hypoallergenic soybean products[J]. Nutritional Science and Vitaminology, 2000, 46(6): 271-279. |
| [11] | 方旭前, 朱友林, 邱丽娟. 大豆过敏原与低过敏原种质创新[J]. 遗传, 2006, 28(8): 1043-1050. |
| [12] | 郑义成, 华萍, 杨安树, 等. 食物中过敏原检测技术研究进展[J]. 食品科学, 2010, 31(21): 417-420. |
| [13] | Poms RE, Klein CL, Anklam E. Methods for allergen analysis in food: a review[J]. Food Addit Contam, 2004, 21(1): 1-31. |
| [14] | Piknova L, Pangallo D, Kuchta T. A novel real-time polymerase chain reaction(PCR)method for the detection of hazelnuts in food[J]. Eur food Res Technol. 2008, 226(2): 1155-1158. |
| [15] | Zeltner D, Glomb MA, Maede D. Real-time PCR systems for the detection of the gluten-containing cereals wheat, spelt, kamut, rye, barley and oat[J]. Eur Food Res Technol, 2009(3): 321-330. |
| [16] | 曹际娟, 邵娟, 于珂, 等. 实时荧光PCR方法检测含麸质的谷类产品管家基因[J]. 辽宁师范大学学报: 自然科学版, 2010, 33(3): 374-379. |
| [17] | Soares S, Mafra I, Amaral JS, et al. A PCR assay to detect trace amounts of soybean in meat sausages[J]. International Journal of Food Science and Technology, 2010, 45(12): 2581-2588. |
| [18] | Bauer T, Kirschbaum K, Panter S, et al. Sensitive detection of soy(Glycine max)by real-time polymerase chain reaction targeting the mitochondrial atpA gene[J]. J AOAC Int, 2011, 94(6): 1863-1873. |
| [19] | Momcilovic D, Rasooly A. Detection and analysis of animal mater-ials in food and feed[J]. J Food Prot, 2000, 63: 1602-1609. |
| [20] | Hupfer C, Waiblinger HU, Busch U. Development and validation of a real- time PCR detection method for celery in food[J]. Eur Food Res Technol, 2007, 225: 329-335. |
| [21] | Mustorp SL, Drømtorp SM, Holck AL, et al. Multiplex, quantitative, ligation-dependent probe amplification for determination of allergens in food[J]. Agric Food Chem, 2011, 59: 5231-5239. |
| [22] | 刘昊, 黄文胜, 邓婷婷, 等. LAMP法检测食品中开心果过敏原成分[J]食品科学, 2013, 34(22): 128-132. |
| [23] | Cucu T, Demeulenaer B, Devreese B. MALDI based identification of soybean protein markers: possible analytical targets for allergen detection in processed foods[J]. Peptides, 2012, 33(2): 187-196. |