近年来,长链非编码RNA(Long noncoding RNAs,lncRNAs)的研究进展迅猛,已成为分子生物学领域的最新研究热点。 lncRNA是一类转录本长度超过 200 nt 的RNA分子,它们并不编码蛋白质,而是以RNA的形式在多种层面上调控基因的表达水平[1]。LncRNA起初被认为是基因组转录的“噪音”,是RNA聚合酶Ⅱ转录的副产物,不具有生物学功能。但近年来的研究表明,lncRNA参与了表观遗传调控、转录调控以及转录后调控等多种重要的调控过程,与干细胞维持和分化、胚胎发育、细胞增殖与凋亡、细胞代谢、免疫调节等几乎所有的生理或病理过程的调控密切相关,因此lncRNA的功能及其调控机制的阐明对现代生命科学具有重大的意义[2]。
肺癌转移相关转录本1(Metastasis-associated lung adenocarcinoma transcript 1,MALAT-1),又名核富集常染色体转录产物2(Nuclera-enriched autosomal transcript2,NEAT2)属lncRNA家族重要成员,2003年在非小细胞肺癌(Non-small cell lung cancer,NSC-LC)研究中被发现,近年来已逐步引起学者关注。MALAT1在多种肿瘤、组织中表达,已有研究表明,MALAT1能特异性招募SR蛋白家族成员、并参与表观遗传调控以及细胞周期调控等;MALAT1高表达于多种肿瘤中,能促进肿瘤细胞的增殖、转移和侵袭等;MALAT1在血管生成过程中也发挥重要作用。本研究主要介绍MALAT1的发现、特性、并描述其已知的功能、作用机制和相互作用的分子,以及对近年来的研究作一系统综述。
1 MALAT1的发现2003年,Ji等[3]从初期非小细胞肺癌患者的肿瘤细胞中筛选出数个差异表达基因,其中包括含一个与肺癌转移和预后相关的未知转录物,采用RACE法扩增到一个长约 940 nt 的片段,经检索比对,该片段定位于人染色体 11q13,属于长约 8.7 kb 的a基因。Ji等[3]根据其与NSCLC发生发展的关系,将a基因转录物重命名为肺癌转移相关转录本1(MALAT1),后来也被称作NEAT2。MALAT1缺乏有意义的开放性编码框,在体外无法翻译蛋白质,属长链非编码RNA。MALAT1是第一个与肺癌疾病相关联的长链非编码RNA。10多年前发现关于MALAT1的大量数据积累,包括MALAT1与其他癌症细胞或疾病的关联、对其生物合成的见解、与其他细胞的相互作用及分子机制等。
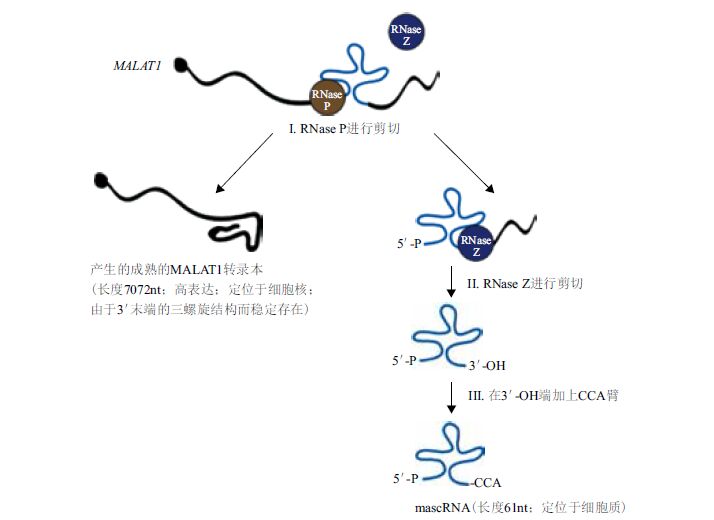
2 MALAT1的特性 2.1 MALAT1的结构特点MALAT1编码基因定位于染色体11q13.1,转录本序列长约 8 kb,属于基因间转录本。在转录后水平,两个内源RNA酶-RNase P 和 RNase Z可以修饰MALAT1[4]。初生的转录产物MALAT1在其多聚腺苷酸位点上游几百碱基处可形成tRNA样三叶草二级结构,此结构能被RNase P特异识别,RNase P结合三叶草结构后迅速在其最近上游端进行剪切,形成大小为 7 072 nt 的MALAT1成熟转录本和近3'端小转录本两个片段。小转录本被转运至胞浆,经RNase Z剪切加工,并在CCA添加酶的作用下,其3'端加上CCA臂后形成大小约为 61 nt 的胞浆成熟tRNA样转录本[4],称为MALAT1-associated small cytoplasmic RNA(mascRNA),随后被运送到细胞质(图 1)[5, 6]。研究发现,RNA转录后的修饰,如剪切、加帽等可大大增加RNA功能的多样性,但mascRNA的功能迄今未知[5]。因此,目前在功能上无法将mascRNA与MALAT1联系起来。
MALAT1的5'端没有帽子结构,不参与蛋白质的翻译,3'端没有ploy(A)尾,但其是一个非常稳定的lncRNA,最新研究发现,可能是由于在3'末端形成了三螺旋结构[8, 9]。Wilusz等[8]研究发现MALAT1 3'末端形成的三螺旋结构可保护MALAT1 3' 端免受 3'-5' 核酸外切酶的剪切,从而维持MALAT1的完整性。
2.2 MALAT1的核定位LncRNA的功能在很大程度上决定于亚细胞结构定位的特性。与MALAT1同一家族的成员,核富集常染色体转录物1(Nuclera-enriched autosomal transcript,NEAT1)参与核内的超核小斑结构的组装和结构维持[10]。与NEAT1相似,MALAT1基因特异性定位于细胞核核小体核斑(Nuclearspeckles)区,在该区进行转录,但其在该核斑区富集是以RNA聚合酶Ⅱ依赖的转录被激活为前提[11]。进一步研究发现,干扰MALAT1不影响某些核斑的表达、定位,因此MALAT1可能不是组成核斑的结构成分[12]。同时,MALAT1序列本身还存在两个必需的独立结构域指导其定位于核斑,分别位于MALAT1序列的 1 961-3 040 nt和 6 387-7 011 nt,这两个区域中的任何一个基因突变都导致MALAT1定位失常,游离到细胞质中,失去功能[13]。例如,用siRNA干扰MALAT1后,MALAT1分散到核质中,失去调节基因表达的功能。
2.3 MALAT1的高度保守性MALAT1在哺乳动物进化中高度保守,核苷酸序列3' 末端 5 kb 左右人鼠同源性高达90%,这都提示其在进化过程中MALAT1扮演了重要角色。MALAT1的全序列存在 4 个人鼠高度同源区域,提示这些区域极可能为MALAT1的功能性区域。杨敏慧等[14]将人鼠同源序列集中区域(3 207-8 441 bp,覆盖4个人鼠高同源区),即MALAT1的功能性区域作为研究对象,构建真核重组表达载体,并转染人大肠癌细胞株SW620,为进一步研究MALAT1的结构、功能及其与人大肠癌的关联奠定基础。
3 MALAT1相关作用机制 3.1 MALAT1调节剪接已知mRNA前体加工过程中,核内核小斑的丝氨酸/精氨酸富集蛋白(Serine/arginie riched protein,SR protein)家族成员具有重要作用。SR蛋白的分子结构包含N末端的RNA结构域和C末端RS结构域,N末端的RNA结构域可以与mRNA前体相互作用。SR蛋白从核小斑转移到转录活化部位,结合mRNA前体,并招募多种剪接因子,介导mRNA前体加工[15, 16]。Tripathi等[17]通过RNA-FISH实验,使用MALAT1和U2-snRNA特异性探针和SR剪接因子抗体,证实核富集的MALAT1与丝氨酸精氨酸SR蛋白相互作用,影响剪接因子的配送等。沉默MALAT1或过表达SR蛋白可以不同程度的改变内源性前mRNA的选择性剪接。磷酸化是决定SR蛋白功能活化的重要步骤,研究还发现,MALAT1在细胞水平调节SR蛋白质的磷酸化和去磷酸化水平,从而控制其活性。Wang等[18]发现,在GC细胞系,过表达SF2/ASF的核仁中,MALAT1异常高表达,当下调MALAT1表达时,SF2/ASF的核分布和表达显著受损,MALAT1可调控SF2/ASF的核内定位。
3.2 MALAT1与表观遗传多梳蛋白2(Polycomb 2,PC2)是PcG蛋白家族的一员,是一种重要的基因转录抑制因子。Pc2蛋白甲基化后聚集在转录因子E2F1的靶基因启动子区,与转录本TUG1结合定位于亚核结构多梳体(Polycomb body,PcG body),此结构含有多种转录抑制因子,抑制E2F1靶基因的转录[19]。丝裂因子刺激后,甲基化的Pc2去甲基,转而与MALAT-1结合,共同作为一种分子支架,特异性定位于亚核结构染色质间颗粒(Interchromatin granule,ICG)中[20]。MALAT-1作为停泊位点与去甲基的Pc2结合后,不仅促进生长基因从PcG重新定位到ICG,而且还通过组装多种共调节复合体,与多种基因激活相关蛋白相互作用,促进基因表达。与此同时,Pc2作为组蛋白的阅读器[21],MALAT-1与之结合后可改变Pc2对组蛋白的识别能力,从识别组蛋白H3K9me3转换为阅读组蛋白H2AK5ac和组蛋白H2AK13ac,而这两种蛋白是基因激活的标志物。
3.3 MALAT1与细胞周期最近的研究表明在哺乳动物细胞中几个lncRNAs可以调节细胞周期的进程。研究表明,在正常细胞周期进程中,MALAT1参与调节。Tripathi等[22]对人二倍体成纤维细胞进行了全基因组和转录组学分析,证实MALAT1调控细胞周期相关基因的表达,并且它是有丝分裂进程所必须的基因。MALAT1的沉默导致p53及其靶基因的活化,同时细胞周期进程取决于p53的表达变化,这暗示着p53是MALAT1的主要下游介质。此外,在MALAT1沉默的细胞中,B-MYB(MybrelatedproteinB)表达降低,B-MYB是一个参与G2/M期的进程的致癌转录因子,MALAT1改变了B-MYB 前体mRNA上的剪接结合因子结合位点和它的异常剪接。在人类成纤维细胞中,MALAT1通过调节细胞周期相关转录因子的表达促进细胞增殖。Yang等[23]发现,在G2 / M期,MALAT1的转录物由细胞核移位进入细胞质。调查还发现,在此过程中,MALAT1与核糖核蛋白C(Heterogeneous nuclear ribonucleoprotein C,hnRNP C)相互作用。利用功能缺失实验,MALAT1的表达下调抑制了hnRNP C在G2/M期的转录,并导致G2/ M期阻滞。这些发现提供了有关MALAT1在调节细胞增殖作用机理的见解。
4 MALAT1与肿瘤MALAT1广泛表达于哺乳动物正常组织,并在诸多人类恶性肿瘤中异常表达,其异常表达改变了肿瘤细胞的生物学表型。虽然MALAT1不直接编码蛋白,但其对肿瘤的增殖、凋亡、侵袭转移、耐药都有不同程度的影响,发挥重要作用。有关MALAT1在多种肿瘤中的调节和功能汇总于表 1。
Tano等[24]为了研究MALAT1是否与肺癌的转移有关,用siRNA干扰了MALAT1的表达发现,细胞的运动性受损,同时也影响众多基因的表达,其中包括CTHRC1、CCT4、HMMR或ROD1基因,降低受MALAT1调控的这些基因的表达都明显抑制细胞迁移。因此,MALAT1是一种通过从转录和转录后水平调控运动相关基因表达促进细胞运动的非编码RNA。Schmidt等[25]研究发现,MALAT1在人类的非小细胞肺癌细胞系中表达明显高于癌旁正常组织。并在非小细胞肺癌A549中,用siRNA介导的方法干扰MALAT1,抑制了细胞的迁移以及裸鼠中肿瘤的形成,而在NIH 3T3细胞中过表达MALAT1,显著增加细胞迁移,说明MALAT1具有促进肺癌形成的能力。Schmidt等[25]还对非小细胞肺癌组织进行原位杂交检测,揭露鳞状细胞肺癌中,MALAT1的高表达与预后不良有关。这表明MALAT1有望成为肺癌预后的新指标。Gutschner等[26]发现,在肺癌细胞中,MALAT1不会改变剪接,而是积极调节基因表达,包括一组转移相关基因。Weber等[27]研究证明,可以根据人外周血细胞中MALAT1表达的差异区分癌症患者和正常志愿者。因此,MALAT1可作为诊断非小细胞肺癌的血液生物标志物的候选者。Shen等[28]还研究了在 78 例非小细胞肺癌中,与非脑转移组织相比,肺癌脑转移组织MALAT1的水平显著升高。由此可见,MALAT1的表达水平与患者生存相关联。同时,沉默MALAT1抑制脑转移肺癌细胞侵袭和转移。因此MALAT1 非常有希望成为治疗肺癌的脑转移的靶标。
4.2 MALAT1与宫颈癌Guo等[29]发现在人属宫颈癌细胞系CaSki中沉默MALAT1的表达,可以抑制细胞的增殖和迁移。对细胞周期分析发现,干扰MALAT1后,G1期细胞明显增多,S期细胞减少,说明MALAT1可以促进细胞从G1期到S期的转换,从而加速细胞增殖。进一步研究发现,在干扰MALAT1时,诱导了凋亡基因caspase-3、caspase-8和Bax的表达,而降低了Bcl-2和Bcl-xL的表达。说明MALAT1参与调控宫颈癌细胞生长、增殖和凋亡。Jiang等[30]研究证明,宫颈癌细胞系与正常宫颈鳞状细胞样品进行比较,MALAT1表达上调。亦证明MALAT1能够促进细胞的迁移和增殖,值得注意的是,MALAT1的表达下降与HPV16 E6/ E7的敲低有关,这表明,HPV是导致MALAT1在宫颈癌鳞状细胞癌中活化的重要因素之一。
4.3 MALAT1与肝癌Luo等[31]根据转录分析,发现MALAT1过度表达在肝母细胞瘤HPBL,肝细胞癌HCC,以及相邻的肝硬化组织。Lin等[32]发现在肝癌组织中,MALAT1的表达较癌旁组织高出 6 倍,并且MALAT1可能成为肝癌诊断的潜在分子标志。Lai等[33]收集包括 9 种不同细胞系,其中1种正常的肝细胞系L02和8种不同的肝癌细胞系(HepG2、Hep3B、SMMC7721、HUH7、MHCC97L、MHCC97H、HCCLM3和SKhep1),同时收集了112例HCC病例样品(其中有 60 例接受了肝移植的病人),并用qPCR检测了MALAT1的表达量发现,高表达MALAT1显著增加了肝移植病人肝癌复发的风险。多因素分析,MALAT1是预测肝癌复发的独立预后因素,可作为一种新的标志物用于预测肝移植后肝癌的复发。此外,在HepG2细胞中抑制MALAT1的表达,能有效降低细胞活力、运动、侵袭,并增加细胞凋亡的敏感性。Wang等[34]发现癌蛋白相关蛋白(YAP)可以通过对丝氨酸/富含精氨酸的剪接因子1(Recombinant serine/arginine-rich splicing factor 1,SRSF1)发挥抑制作用,进而从转录和转录后水平上调MALAT1的表达。过表达的YAP通过与血管动蛋白(Human angiomotin,AMOT)的相互作用,使核内的SRSF1受损。而SRSF1本身对MALAT1有拮抗作用,通过YAP对SRSF1的抑制,使这种拮抗作用解除,从而上调MALAT1的表达。Wang等还发现,过表达YAP与同时降低SRSF1的表达将导致细胞移动性显著增强,肿瘤快速增殖。总之,在SRSF1、YAP和MALAT1之间,这些数据提供了一个新颖的平衡机制,但关于YAP调节长链非编码RNA的具体机制尚不清楚。
4.4 MALAT1与膀胱癌Ying等[35]通过qPCR检测了膀胱癌中MALAT1的含量,证实了MALAT1在膀胱癌组织的表达高于癌旁组织。用siRNA干扰MALAT1,膀胱癌细胞的迁移能力下降。MALAT1表达下调后,与EMT相关的锌指E盒结合同源盒蛋白1(Zinc-finger E-box binding homeobox 1,ZEB1)、ZEB2和锌指转录因子Slug等蛋白表达降低,与细胞黏附相关的钙黏连蛋白E-cadherin表达增加,同时Wnt信号通路中的关键分子β-连环蛋白也减少。Ying等推测,膀胱癌中高表达的MALAT1可能通过激活Wnt信号通路促进癌细胞的上皮-间质转化(Epithelial-to-mesenchymal transition,EMT)来促进癌细胞转移。2014年,Fan等[36]又发现MALAT1可与抑制剂zeste 12结合,而这种结合会导致E-cadherin和N-caherind表达增加。Han等[37]检测了 36 例膀胱尿路上皮癌组织,证实膀胱尿路上皮癌与正常上皮相比较,MALAT1的表达上调。同时在膀胱尿路上皮癌T24和5637细胞中,干扰MALAT1的表达,抑制细胞增殖,诱导细胞凋亡,降低细胞运动性。到目前为止,尽管人们对lncRNA的认识还不够全面,但是人们发现lncRNA可与microRNA相互调控,从而对肿瘤发挥作用。Han等[38]发现hsa-miR-125b可以通过下调MALAT1的表达而抑制膀胱癌的发展。
4.5 MALAT1与食管鳞状细胞癌MALAT1已被证明是各种人类恶性肿瘤的重要参与者,但其在食管鳞状细胞癌的作用仍知之甚少。Hu等[39]通过qPCR分析了临床组织中MALAT1的含量发现,MALAT1过度表达于食管鳞状细胞癌。在体内和体外,沉默MALAT1抑制了肿瘤的增殖,以及细胞侵袭和迁移能力。MALAT1的沉默也使细胞周期阻滞在G2/M期,诱导细胞凋亡。同时,Western Blot结果显示,MALAT1的沉默使与阻滞G2 / M期相关联的ATM-CHK2通路磷酸化。数据表明,MALAT1作为食管癌的癌基因,它通过作用于ATM-CHK2通路调节食管癌的增长,具体调节机制尚不清楚。Wang等[40]发现在食管癌细胞中,miR-101和miR-217转录后调控MALAT1沉默,MALAT1这种转录后沉默可显著抑制食管癌细胞的增殖,通过阻滞阻滞G2 / M期,这可能是由于MALAT1介导的上调p21和p27表达和下调B-MYB表达的作用。
4.6 MALAT1与其他肿瘤在其他肿瘤中,如乳腺癌中,用siRNA干扰MALAT1后,可以观察到细胞迁移受到抑制,这说明MALAT1在乳腺癌中起到促进迁移的作用[41]。在胃癌SGC-7901细胞中,干扰MALAT1,可以观察到细胞阻滞在G0/G1期,同时也伴随着细胞增殖的显著抑制[42]。在结肠直肠癌细胞中,干扰MALAT1,可促进肿瘤的生长和转移,此外PRKA激酶锚蛋白9(A kinase anchor protein 9,AKAP-9)在mRNA和蛋白质水平显著上调,而AKAP-9的敲除阻断MALAT1介导的癌细胞的增殖、迁移和侵袭,证明MALAT1可调节靶蛋白AKAP-9促进结直肠癌增殖、迁移和侵袭[43]。在人骨肉瘤细胞中,Dong等[44]发现在体内和体外,MALAT1的沉默显著抑制细胞的增殖和侵袭和转移,推测MALAT1可能通过抑制PI3K / AKT信号通路而促进肿瘤的生长和转移,总之,MALAT1可以视为人骨肉瘤的治疗靶点。MALAT1在许多肿瘤中都高表达,其功能失调普遍存在于人类多种恶性肿瘤中,说明了MALAT1与肿瘤具有重要关系。
5 MALAT1对血管内皮细胞的作用最近研究发现MALAT1也参与调控内皮细胞的血管生成。已有关于microRNA调控血管内皮细胞功能、血管生长和重塑的报道,但人们对lncRNAs在内皮细胞中的功能知之甚少[45]。
Michalik等[46]发现了长链非编码RNA在人脐静脉内皮细胞HUVEC中的高表达特征,界定了在体内和体外,MALAT1 对内皮细胞和血管生成的功能性作用。在体外,通过siRNA干扰MALAT1的表达,可增加内皮细胞基础出芽和促进细胞迁移,反之内皮细胞的出芽也会受到抑制。在siRNA干扰MALAT1表达的基础上,进一步用VEGF刺激血管内皮细胞,可诱导内皮细胞不连续的出芽生长,并影响细胞周期进程,使细胞分裂期S期减少。同时,利用广泛性抑制长链非编码RNA的抑制剂——GapmeR抑制MALAT1的表达,也出现了促进内皮细胞出芽和迁移的现象,加入VEGF后,也诱导内皮细胞的不连续出芽、影响细胞周期进程。由此证实了在体外,MALAT1对内皮细胞出芽、迁移和增殖都有作用。在体内,Michalik等利用植物凝集素-B4对出生5 d小鼠的视网膜进行染色,可以使视网膜可视化。在敲除MALAT1的小鼠的视网膜切片中可观察到视网膜的血管丛密度降低,并观察到视网膜血管内皮细胞的增殖受到抑制。在小鼠的单侧下肢缺血模型中,利用GapmeRs抑制MALAT1可减少血流的恢复和后肢局部缺血后毛细血管的密度。由此证实了,在体内,沉默MALAT1可减少血管内皮细胞增殖、抑制新生血管化、减少后肢局部缺血后的血流恢复和毛细血管密度。为了研究MALAT1对内皮细胞增殖的作用,利用qRT-PCR检测干扰MALAT1表达后的细胞周期相关基因表达,结果显示MALAT1的沉默调控各种细胞周期调控因子的表达,分裂期S期的调控蛋白CCNA2、CCNB1、CCNB2等表达下调,细胞周期抑制剂因子p21、p27Kip1等表达上调,进一步证实MALAT1促进内皮细胞增殖。
治疗性血管新生(Therapeutic angiogenesis)是一种有应用前景的治疗策略,以促进缺血组织的再生[46]。lncRNAs已经描述了在内皮细胞出芽过程中起关键作用,但对于在血管生成lncRNAs的作用还没有被研究[45]。lncRNA MALAT1高度表达于内皮细胞,它是由缺氧诱导,并是内皮细胞增殖的需要。GapmeRs 的沉默或MALAT1基因缺失减少小鼠中新生血管形成。因此,增强MALAT1是可以促进血管新生治疗一个潜在的战略。
Puthanveetil等[47]用含有不同葡萄糖水平的培养基培养人的脐静脉内皮细胞,12 h后发现高葡萄糖水平会引起MALAT1的表达增加。随后又证明MALAT1的增加与血清中淀粉样蛋白抗原3(SAA3)的增加相关,而SAA3的增加进一步伴随着肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)和白细胞介素6(Interleukin-6,IL-6)的mRNA和蛋白水平增加。这项研究的结果表明,MALAT1通过活化淀粉样蛋白抗原3(Serum amyloid A3,SAA3)而上调葡萄糖诱导的炎性介质TNF-α和IL-6。这些关于MALAT1的新的调节机制的发现对于糖尿病微观和宏观血管并发症的研究具有重要意义。
Liu等[48]发现沉默MALAT1能明显改善糖尿病患者的视网膜病变(Diabetic retinopathy,DR),如周细胞损失、毛细管变性、微血管渗漏和视网膜炎症。此外,沉默MALAT1可以调节视网膜血管内皮细胞增殖、迁移和体外血管的生成。研究表示MALAT1的低表达可作为糖尿病相关的微血管并发症的标志。
6 展望近年来,随着研究的深入,更多的lncRNA被发现,更多的疾病与lncRNA的异常表达有关。MALAT1作为其中的一员,具有高度保守性,定位于细胞核,参与基因的剪接,并且通过表观遗传控制基因的表达。MALAT1高度表达在肿瘤细胞中,其功能失调普遍存在于多种恶性肿瘤中,对肿瘤的增殖、凋亡、侵袭转移都有不同程度的影响,发挥重要作用,但是其在肿瘤中的生物特性、作用途径、作用靶点、调节机制仍未完全研究清楚,还需进行深入研究和探讨。例如,目前普遍采用干扰MALAT1的方式,也可过表达MALAT1,MALAT1功能的过表达研究可以有助于确定相关的潜在分子机制。除了肿瘤细胞,还可探索MALAT1在其他细胞中的作用,如心肌细胞、平滑肌细胞、炎症细胞或心脏成纤维细胞等。相信通过体内外的深入研究将会在更广的层面上揭示MALAT1的功能及调控机制,为人类创造更多新的突破口。
| [1] | Ponting CP, Belgard TG. Transcribed dark matter: meaning or myth?[J]. Hum Mol Genet, 2010, 19(R2): R162-168. |
| [2] | Gutschner T, Diederichs S. The hallmarks of cancer: a long non-coding RNA point of view[J]. RNA Biol, 2012, 9: 703-719. |
| [3] | Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031-8041. |
| [4] | Kuhn CD, Wilusz JE, Zheng Y, et al. On-enzyme refolding permits small RNA and tRNA surveillance by the CCA-adding enzyme[J]. Cell, 2015, 160(4): 644-658. |
| [5] | Wilusz JE, Freier SM, Spector DL, et al. 3' end processing of a long nuclear-retained noncoding RNA yields a tRNA-like cytoplasmic RNA[J]. Cell, 2008, 135(5): 919-932. |
| [6] | Fejes-Toth K, Sotirova V, Sachidanandam R, et al. Post- transcriptional processing generates a diversity of 5'- modified long and short RNAs[J]. Nature, 2009, 457(7232): 1028-1032. |
| [7] | Gutschner T, Hammerle M, Diederichs S, et al. MALAT1—a paradigm for long noncoding RNA fuction in cancer[J]. J Mol Med(Berl), 2013, 91(7): 791-801. |
| [8] | Wilusz JE, Jnbaptiste CK, Lu LY, et al. A triple helix stabilizes the 3' ends of long noncoding RNAs that lack poly(A)tails[J]. Genes Dev, 2012, 26(21): 2392-2407. |
| [9] | Brown JA, Valenstein ML, Yario TA, et al. Formation of triple-helical structures by the 3'-end sequences of MALAT1 and MENbeta noncoding RNAs[J]. Proc Natl Acad Sci USA, 2012, 109(47): 19202-19207. |
| [10] | Wilusz JE, Sunwoo H, Spector DL, et al. Long noncoding RNAs: functional surprises from the RNA world[J]. Genes Dev, 2009, 23(13): 1494-1504. |
| [11] | Clemson CM, Hutchinson JN, Sara SA, et al. An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles[J]. Mol Cell, 2009, 33(6): 717-726. |
| [12] | Bernard D, Prasanth KV, Tripathi V, et al. A long nuclear-retained non-coding RNA regulates synaptogenesis by modulating gene expression[J]. EMBO J, 2010, 29(18): 3082-3093. |
| [13] | Miyagawa R, Tano K, Mizuno R, et al. Identification of cis- and trans-acting factors involved in the localization of MALAT-1 noncoding RNA to nuclear speckles[J]. RNA, 2012, 18(4): 738-751. |
| [14] | 杨敏慧, 王双双, 王晓燕, 等. 非编码基因MALAT1功能性序列真核表达载体的构建及其在SW620细胞中的表达[J]. 热带医学杂志, 2010, 10(3): 248-257. |
| [15] | Mukherjee B, Tomimatsu N, Amancherla K, et al. The dual PI3K/mTOR inhibitor NVP-BEZ235 is a potent inhibitor of ATM- and DNA-PKCs-mediated DNA damage responses[J]. Neoplasia, 2012, 14(1): 34-43. |
| [16] | Graveley BR. Sorting out the complexity of SR protein functions[J]. RNA, 2000, 6(9): 1197-1211. |
| [17] | Tripathi V, Ellis JD, Shen Z, et al. The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J]. Mol Cell, 2010, 39(6): 925-938. |
| [18] | Wang JQ, Su LP, Chen XH, et al. MALAT1 promotes cell proliferation in gastric cancer by recruiting SF2/ASF[J]. Biomed Pharmacother, 2014, 68(5): 557-564. |
| [19] | Bantignies F, Roure V, Comet I, et al. Polycomb- dependent regulatory contacts between distant Hox loci in Drosophila[J]. Cell, 2011, 144(2): 214-222. |
| [20] | Spector DL, Lamond AI. Nuclear speckles[J]. Cold Spring Harb Perspect Biol, 2010,(2): a005546. |
| [21] | Bernstein E, Duncan EM, Masui O, et al. Mouse polycomb proteins bind differentially to methylated histone H3 and RNA and are enriched in facultative heterochromatin[J]. Mol Cell Biol, 2006, 26(7): 2560-2569. |
| [22] | Tripathi V, Shen Z, Chakraborty A, et al. Long noncoding RNA MALAT1 controls cell cycle progression by regulating the expression of oncogenic transcription factor B-MYB[J]. PLoS Genet, 2013, 9(3): e1003368. |
| [23] | Yang F, Yi F, Han X, et al. MALAT-1interacts with hnRNP C in cell cycle regulation[J]. FEBS Lett, 2013, 587(19): 3175-3181. |
| [24] | Tano K, Mizuno R, Okada T, et al. MALAT-1 enhances cell motility of lung adenocarinoma cells by influencing the expression of motility-related genens[J]. FEBS Lett, 2010, 584(22): 4575-4580. |
| [25] | Schmidt LH, Spieker T, Koschmieder S, et al. The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth[J]. J Thorac Oncol, 2011, 6(12): 1984-1992. |
| [26] | Gutscher T, Hämmerle M, Eissmann M, et al. The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J]. Cancer Res, 2013, 73(3): 1180-1189. |
| [27] | Weber DG, Johnen G, Casjens S, et al. Evaluation of long noncoding RNA MALAT1 as a candidate blood-based biomarker for the diagnosis of non-small cell lung cancer[J]. BMC Res Notes, 2013, 6: 518. |
| [28] | Shen L, Chen L, Wang Y, et al. Long noncoding RNA MALAT1 promotes brain metastasis by inducing epithelial-mesenchymal transition in lung cancer[J]. J Neurooncol, 2015, 121(1): 101-108. |
| [29] | Guo F, Li Y, Liu Y, et al. Inhibition of metastasis-associated lung adenocarinoma transcript 1 in CaSki human cervical cancer cells suppresses cell proliferation and invasion[J]. Acta Biochim Biophys Sin(Shanghai), 2010, 42(3): 224-229. |
| [30] | Jiang Y, Li Y, Fang S, et al. The role of MALAT1 correlates with HPVin cervical cancer[J]. Oncol Lett, 2014, 7: 2135-2141. |
| [31] | Luo JH, Ren B, Keryanov S, et al. Transcriptomic and genomic analysis of human hepatocellular carcinomas and hepatoblastomas[J]. Hepatology, 2006, 44(4): 1012-1024. |
| [32] | Lin R, Maeda S, Liu C, et al. A large noncoding RNA is a marker for murine hepatocellular carcinomas and a spectrum of human carcinomas[J]. Oncogene, 2007, 26(6): 851-858. |
| [33] | Lai M C, Yang Z, Zhou L, et al. Long non-coding RNA MALAT1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation[J]. Med Oncol, 2012, 29(3): 1810-1816. |
| [34] | Wang JY, Wang HM, Zhang Y, et al. Mutual inhibition between YAP and SRSF1 maintains long non-coding RNA, MALAT1-induced tumourigenesis in liver cancer[J]. Cellular Signalling, 2014, 26(5): 1048-1059. |
| [35] | Ying L, Chen Q, Wang Y, et al. Upregulated MALAT-1 contributes to bladder cancer cell migration by inducing epithelial-to-mesenchymal transition[J]. Mol Biosyst, 2012, 8: 2289-2294. |
| [36] | Fan Y, Shen B, Tan M, et al. TGF-β-induced upregulation of malat1 promotes bladder cancer metastasis by associating with suz12[J]. Clin Cancer Res, 2014, 20(6): 1531-1541. |
| [37] | Han Y, Liu Y, Nie L, et al. Inducing cell proliferation inhibition, apoptosis, and motility reduction by silencing long noncoding ribonucleic acid metastasis-associated lung adenocarcinoma transcript 1 in urothelial carcinoma of the bladder[J]. Urology, 2013, 81(1): 209. e1-7. |
| [38] | Han Y, Liu Y, Zhang H, et al. Hsa-miR-125b suppresses bladder cancer development by down-regulating oncogene SIRT7 and oncogenic long nocoding RNA MALAT1[J]. FEBS Lett, 2013, 587(23): 3875-3882. |
| [39] | Hu L, Wu Y, Tan D, et al. Up-regulation of long noncoding RNA MALAT1 contributes to proliferation and metastasis in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2015, 34: 7. |
| [40] | Wang X, Li M, Wang Z, et al. Silencing of long noncoding RNA MALAT1 by miR-101 and miR-217 inhibits proliferation, migration, and invasion of esophageal squamous cell carcinoma cells[J]. J Biol Chem, 2015, 290(7): 3925-3935. |
| [41] | Zhao Z, Chen C, Liu Y, et al. 17β-Estradiol treatment inhibits breast cell proliferation, migration and invasion by decreasing MALAT-1RNA level[J]. Biochem Biophys Res Commun, 2014, 445(2): 388-393. |
| [42] | Wang J, Su L, Chen X, et al. MALAT1 promotes cell proliferation in gastric cancer by recruiting SF2/ASF[J]. Biomed Pharmacother, 2014, 68(5): 575-564. |
| [43] | Yang MH, Hu ZY, Xu C, et al. MALAT1promotes colorectal cancer cell proliferation/migration/invasion via PRKA kinase anchor protein 9[J]. Biochim Biophys Acta, 2015, 1852: 166-174. |
| [44] | Dong Y, Liang G, Yuan B, et al. MALAT1 promotes the proliferation and metastasis of osteosarcoma cells by activating the P13K/Akt pathway[J]. Tumour Biol, 2015, 36(3): 1477-1486. |
| [45] | Thum T, Fiedler J. LINCing MALAT1 and angiogenesis[J]. Circulation Research, 2014, 114(9): 1366-1368. |
| [46] | Michalik KM, You X, Manavski Y, et al. Long noncoding RNA MALAT1 regulates endothelial cell function and vessel growth[J]. Circulation Research, 2014, 114(9): 1389-1397. |
| [47] | Puthanveetil P, Chen S, Feng B, et al. Long non-coding RNA MALAT1 regulates hyperglycaemia induced inflammatory process in the endothelial cells[J]. J Cell Mol Med, 2015, DOI: 10. 1111/jcmm. 12576. |
| [48] | Liu JY, Yao J, Li XM, et al. Pathogenic role of lncRNA-MALAT1 in endothelial cell dysfunction in diabetes mellitus[J]. Cell Death Dis, 2014, e1506. DOI: 10.1038/cddis. 2014. 466. |
| [49] | Wu XS, Wang XA, Wu WG, et al. MALAT1 promotes the proliferation and metastasis of gallbladder cancer cells by activating the ERK/MAPK pathway[J]. Cancer Biol Ther, 2014, 15(6): 806-814. |
| [50] | Ma KX, Wang HJ, Li XR, et al. Long noncoding RNA MALAT1 associates with the malignant atatus and poor prognosis in glioma[J]. Tumour Biol, 2015, DOI: 10.1007/s13277-014-2969-7. |
| [51] | Pang EJ, Yang R, Fu XB, et al. Overexpression of long non-coding RNA MALAT1 is correlated with clinical progression and unfavorable prognosis in pancreatic cancer[J]. Tumour Biol, 2015, 36(4): 2403-2407. |