2. 广东省微生物研究所 省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广州 510070
2. State Key Laboratory of Applied Microbiology Southern China,Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application,Guangdong Open Laboratory of Applied Microbiology,Guangdong Institute of Microbiology,Guangzhou 510070
深海是全球最大的独立生态系统,生活于深海的海洋微生物处于独特的物理、化学和生态环境中,形成了特殊的遗传机制和代谢系统,使深海微生物能产生结构新颖、活性独特的次级代谢产物。因此,深海微生物具有重要的研究和应用价值,可为开发新的生物活性物质提供优异的种质资源[1, 2, 3]。海洋真菌是海洋微生物的重要组成部分,具有巨大的开发潜力[4]。为了发掘深海真菌活性次级代谢产物,本课题组前期对分离自南海沉积物的深海真菌进行培养条件优化、活性筛选和化学筛选,发现菌株FS86具有生长速度快、代谢产物丰富、抗真菌活性强等特点。本研究以该菌株为研究对象,根据其培养特征和形态特征及ITS序列分析对该菌株进行鉴定,并测试其发酵提取物对病原真菌和肿瘤细胞株的抑制活性,旨在为进一步开发新的抗菌、抗肿瘤活性物质提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株来源菌株FS86分离自南海(12° 58.551' E,17° 0.646' N)1598 m深处的海洋沉积物。
1.1.2 供试菌株及肿瘤细胞株病原真菌:白色念珠菌(Candida albicans)、黑曲霉(Aspergillus niger)、黄曲霉(Aspergillus flavus)、绿色木霉(Trichoderma viride)、胶孢炭疽菌(Colletotrichum gloeosporioides)、柱枝双孢霉(Cylindrocladium scoparium)、新月弯孢菌(Curvularia lunata)、链格孢(Alternaria alternata)。肿瘤细胞株:人肺癌细胞株NCI-H460、人乳腺癌细胞株MCF-7、人神经胶质瘤细胞株SF-268、人肝癌细胞株HepG-2。以上菌株和肿瘤细胞株均保存于广东省微生物研究所。
1.1.3 培养基分离培养基:含3%粗海盐的PDA培养基;液体发酵培养基:马铃薯200 g、葡萄糖10 g、甘露醇20 g、酵母膏3 g、蛋白胨5 g、味精5 g、粗海盐3 g,水1 L。病原真菌采用PDA培养基;肿瘤细胞株采用RPMI-1640培养基。
1.1.4 试剂二甲基亚砜(DMSO),Sulforhodamine B sodium salt(SRB),均购自Sigma公司;三氯醋酸(分析纯),广州化学试剂一厂;RPMI-1640培养基,吉诺生物医药技术有限公司。
1.1.5 仪器PYX-DHS电热恒温培养箱,湖北省黄石医疗器械厂;YXQ.WY21-600电热高压蒸汽灭菌锅,广州市华南医疗器械有限公司;超净工作台,上海恒益科技有限公司;RE-2000旋转真空蒸发仪,上海亚荣生化仪器厂;2123-2二氧化碳培养箱,Shellab公司;DMI3000B倒置显微镜,Leica公司;MULTISKAN GO全波长酶标仪,Thermo公司。
1.2 方法 1.2.1 菌株的分离纯化无菌操作取适量海洋沉积物样品用含3%粗海盐的无菌水稀释到10%,28℃振荡20 min,取0.1 mL均匀涂布在分离培养基中,28℃恒温箱培养,待菌落长出后,挑取平板中单一菌落转接至含有新鲜分离培养基的培养皿中,继续培养,经多次分离纯化直至获得纯菌株后,转接至斜面培养3-5 d 后保存于4℃冰箱。
1.2.2 菌株的鉴定 1.2.2.1 形态特征将菌株FS86接种于PDA培养基平板上,28℃下培养7 d,肉眼观察菌株的培养特征;利用光学显微镜和电子显微镜观察其菌丝、分生孢子梗、分生孢子等形态特征。
1.2.2.2 ITS序列测定和系统发育分析采用真菌基因组DNA提取试剂盒提取菌株的基因组DNA,作为PCR扩增的模板。PCR扩增采用真菌rDNA内转录间隔区(rDNA ITS)通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3',正向)和ITS4(5'-TCCTCCGCTTATTGATATGC-3',反向)扩增分离菌株的rDNA ITS区。PCR采用20 μL 反应体系,通过Ex Taq(TaKaRa)进行。反应条件:93℃预变性3 min;93℃变性45 s,55℃复性45 s,72℃延伸1.5 min,共30个循环;最后72℃延伸10 min。PCR产物由上海美吉生物医药科技有限公司进行测序。获得的序列通过BLAST程序在GenBank上进行相似性序列检索,下载相关序列,以Cercospora beticola CBS 124.31(KF251298)为外类群,运用MEGA 5软件通过邻接法(Neighbor-Joining),构建系统发育树,Bootstrap 设置为1 000次重复。
1.2.3 菌株的发酵与提取物的制备将菌株FS86接种到液体发酵培养基中,28℃,120 r/min 培养7 d后将发酵产物用乙酸乙酯冷浸提取多次至提取液基本无色,合并提取液,经55℃下减压浓缩至干,得发酵提取物。将提取物浸膏用二甲基亚砜(DMSO)溶解,配制成50 mg/mL浓度,备用。
1.2.4 抗菌活性测定取对数生长期的白色念珠菌用生理盐水稀释至浓度为106 CFU/mL的菌液;其它真菌调整至孢子数为106 个/mL的孢子悬液,吸取制备好的菌液或孢子悬浮液1 mL于培养皿中,倒入已冷却至合适温度的PDA培养基,混合均匀,用无菌镊子夹取厚度为1.5 mm、直径为6 mm的滤纸片置于含菌平板上,在滤纸片上分别滴加提取液5 μL作为样品组,以DMSO代替发酵提取液作为空白对照组,以制霉菌素作为阳性对照,将平板置于28℃恒温箱培养72 h,用十字测量法测量抑菌圈直径的大小。
1.2.5 最低抑菌浓度的测定将提取物溶液用DMSO分别稀释至浓度为4、2、1、0.5、0.2、0.1、0.05 mg/mL。按1.2.4方法测定,观察滤纸片周围的抑菌圈,以周围有抑菌圈的滤纸片所含样品的最低溶液浓度为最低抑菌浓度(MIC值)。
1.2.6 细胞毒活性测定采用SRB法[5]测定提取物对肿瘤细胞毒活性:取对数生长期的NCI-H460、SF-268、MCF-7、HepG-2细胞,用胰酶消化,台盼蓝染色计数,台盼蓝排斥实验检测细胞活力大于95%后,用新鲜培养基调整细胞浓度为3 × 104个/mL,细胞接种于96孔板,每孔加入180 μL的细胞悬液,并设空白孔调零,于37℃、5% CO2 培养箱培养24 h。待细胞贴壁后,每孔加入20 μL待测样品,阴性对照加20 μL培养基,以顺铂作阳性对照。置CO2培养箱中培养72 h后,加入50 μL 50%冷三氯醋酸固定细胞,4℃放置1 h 后用蒸馏水洗涤5次,空气中自然干燥。然后每孔加入由1%冰醋酸配制的浓度为4 mg/mL的SRB溶液100 μL,室温中染色30 min,去上清,用1%冰醋酸洗涤5次,空气干燥。最后每孔加入浓度为10 mmol/mL的Tris 溶液200 μL,用酶标仪测定570 nm处的吸光度(A)值,按以下公式计算提取物对细胞生长的抑制率,采用SigmaPlot 10.0 软件计算IC50值。
细胞生长抑制率(%)=(1-A样品组/药物组/A阴性组)×100%。
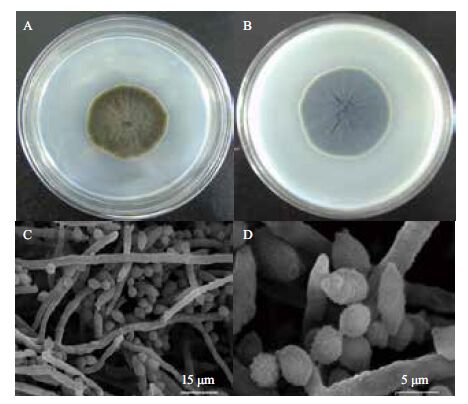
2 结果 2.1 菌株FS86的鉴定 2.1.1 菌株培养特征与形态特征菌株FS86在PDA培养基上28℃培养7 d,直径达35 mm,菌落正面橄榄褐色,有辐射状沟纹,中央稍隆起,边缘白色,绒毛状;菌落背面灰黑色。菌丝有隔,粗3-5 µm,分生孢子梗直立或稍弯曲,分枝或不分枝,圆柱形,(60-165)µm×(3-5)µm,具分隔;枝孢圆柱形或纺锤形,(7-21)µm×(3-3.5)µm,具1-4个分隔;分生孢子黄褐色至橄榄褐色,球形、近球形或卵圆形,(3.5-6.3)µm×(3.1-4.2)µm,单孢,表面具疣突,孢脐明显(图 1)。参照Bensch等[6]的分类系统,菌株FS86鉴定为球孢枝孢(Cladosporium sphaerospermum)。
|
| A和B:分别为菌株FS86在PDA培养基上正、背面的培养特征;C和D:扫描电镜下菌株FS86的微观特征 图 1 菌株FS86的培养特征及扫描电镜下的形态特征 |
将测序获得的序列信息提交至GenBank,登录号为KF294264。BL-AST结果显示,菌株FS86与C. sphaerospermum AT-CC MYA-4645(HQ263345)的相似度为99.4%。从构建的系统发育树(图 2)看,菌株FS86与4条C. sphaerospermum序列聚为高度自展支持的一支,彼此间遗传距离极小。因此,通过分子系统学分析确定菌株FS86为球孢枝孢。

|
| 图 2 菌株FS86与相关菌株的系统发育树 |
从表 1和图 3可以看出,菌株FS86的发酵提取物对8种病原真菌都具有明显的抑制作用,抑菌圈直径均达30 mm以上;其中对白色念珠菌的抑制作用最为显著,抑菌圈直径达45.2 mm,对黑曲霉和黄曲霉的抑菌圈直径为40 mm左右,对其他病原真菌的抑菌圈直径为30-37 mm。

|
| A:白色念珠菌;B:黑曲霉;C:黄曲霉;D:绿色木霉;E:柱枝双胞霉;F:胶孢炭疽菌;G:新月弯孢霉;H:链格孢 图 3 菌株FS86对病原真菌的抑制效果 |
通过菌株FS86的发酵提取物对8种供试真菌最低抑制浓度的测试,结果(表 2)显示该提取物对白色念珠菌和新月弯孢霉的最低抑制浓度(MIC值)仅为0.1和0.25 mg/mL,对其他真菌的最低抑制浓度为1-4 mg/mL。
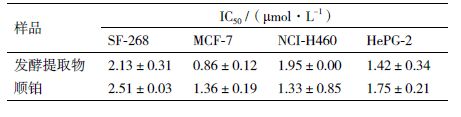
菌株FS86发酵提取物的细胞毒活性测试结果(表 3)显示,该提取物对4种肿瘤细胞株SF-268、MCF-7、NCI-H460、HepG-2均表现出很强的细胞毒活性,其中对MCF-7的抑制效果优于阳性对照药物顺铂,IC50值仅为0.86 μg/mL,对其它细胞株的IC50值均接近阳性对照药物,IC50值为1.42-2.13 μg/mL。
枝孢属(Cladosporium)真菌种类繁多,分布广泛[4]。研究表明,枝孢属真菌的代谢产物具有多种生物活性,是寻找活性物质的重要资源。如分离自芽枝状枝孢(C. cladosporioides)的枝孢菌素(Cladosporin)对红蜘蛛、蚜虫和纷壳虫等害虫有较强的毒杀作用[7, 8];来源于植物的芽枝状枝孢还能产生石杉碱甲、紫杉醇等活性物质[9, 10];分离自栓皮栎的枝孢菌(C. sp. I(R)9-2)能产生抗真菌活性的布雷菲尔德菌素(Brefeldin A)[11],该细胞毒素还具有抗肿瘤、抗病毒、抗有丝分裂等活性[12];从银杏中分离的尖孢枝孢(C. oxysporum R2)其发酵粗提物对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)具有明显的抑制作用[13]。目前,关于海洋来源的枝孢属真菌活性代谢产物的报道还不多,Shigemori等[14]从分离自海藻的枝孢菌(C. sp. L037)中分离得到12元大环内酯sporiolides A,它对新型隐球菌(Cryptococcus neoformans)和粗糙脉孢菌(Neurospora crassa)具有抑菌活性;林涛等[15]从分离自海口红树林泥土的球孢枝孢(C. sphaerospermum PJX-41)中分离得到2个具有抗肿瘤活性的喹唑啉酮生物碱类化合物lapatin A和tryptoquivaline;Wu等[16]从太平洋深海来源的球孢枝孢(C. sphaerospermum 2005-01-E3)中发现化合物Cladosin C对流感病毒A H1N1具有抑制活性。本研究发现来源于南海深海沉积物的球孢枝孢(C. sphaerospermum FS86)发酵提取物具有明显的抗真菌和细胞毒活性,因此该菌株具有重要的研究价值,其活性代谢产物有待进一步深入研究,以期开发出新型的抗真菌和抗肿瘤活性物质。
4 结论本研究通过形态学和ITS系统发育分析,将深海真菌FS86鉴定为球孢枝孢(C. sphaerospermum)。经抗菌活性测试发现,该菌株的发酵提取物对所有的供试真菌均有明显的抑制作用,抑菌圈直径均达30 mm以上,其中对白色念珠菌的抑制活性尤其显著,其最低抑制浓度(MIC值)为0.1 mg/mL;经细胞毒活性测试发现,该菌株的发酵提取物对供试的4种肿瘤细胞有显著的抑制活性,其中对细胞株MCF-7的活性尤为显著,其IC50值为0.86 μmol/L,低于阳性对照药物顺铂。
| [1] | 赵昌会, 叶德赞, 魏文铃. 深海微生物的研究进展[J]. 微生物学通报, 2006, 33(3):142-146. |
| [2] | 肖湘, 王风平. 深海微生物的研究开发[J]. 中国抗生素杂志, 2006, 31(2):87-89. |
| [3] | 张宇, 肖湘. 深海微生物的研究与开发[J]. 生命科学, 2010, 24(9):986-990. |
| [4] | Saleem M, Ali M, Hussain S, et al. Marine natural products of fungal origin[J]. Nat Prod Rep, 2007, 24(5):1142-1152. |
| [5] | Skehan P, Storeng R, Scudiero D, et al. New colorimetric cytotoxicity assay for anticancer drug screening[J]. J Natl Cancer Inst, 1990, 82:1107-1112. |
| [6] | Bensch K, Braun U, Groenewald JZ, et al. The genus Cladosporium[J]. Stud Mycol, 2012, 72:1-401. |
| [7] | Scott PM, Van Walbeek W. Cladosporin, a new antifungi metabolite from Cladosporium cladosporioides[J]. J Antibiot, 1971, 24:747-755. |
| [8] | 谢卿嵋, 黄建河. 芽枝抱霉素的初步研究[J]. 福建林学院学报, 1988, 8(1):29-36. |
| [9] | Zhang ZB, Zeng QG, Yan RM, et al. Endophytic fungus Cladosporium cladosporioides LF70 from Huperzia serrata produces Huperzine A[J]. World J Microbiol Biotechnol, 2011, 27(3):479-486. |
| [10] | Zhang P, Zhou PP, Yu LJ. An endophytic taxol-producing fungus from Taxus media, Cladosporium cladosporioides MD2[J]. Curr Microbiol, 2009, 59(3):227-232. |
| [11] | Wang FW, Jiao RH, Cheng AB, et al. Antimicrobial potentials of endophytic fungi residing in Quercus variabilis and brefeldin A obtained from Cladosporium sp. [J]. World J Microbiol Biotechnol, 2007, 23:79-83. |
| [12] | Harri E, LoeMer W, Singh HP, et al. Die constitution von brefeldin A[J]. Helv Chem Acta, 1963, 46:1235-1243. |
| [13] | 汪涯, 李希茜, 张志斌, 等. 银杏内生真菌菌株R2 的鉴定及其抑菌活性[J]. 江西农业大学学报, 2012, 34(4):718-723. |
| [14] | Shigemori H, Kasai Y, Komatsu K, et al. Sporiolides A and B, new cytotoxic twelve-membered macrolides from a marine-derived fungus Cladosporium species[J]. Mar Drugs, 2004, 2(4):164-169. |
| [15] | 林涛, 谭涛, 刘天行, 等. 红树林来源真菌PJX -41次级代谢产物及其抗肿瘤活性研究[J]. 南京农业大学学报, 2013, 36(3):117-123. |
| [16] | Wu G, Sun X, Yu G, et al. Cladosins A-E, hybrid polyketides from a deep-sea-derived fungus, Cladosporium sphaerospermum[J]. J Nat Prod, 2014, 77(2):270-275. |