毕赤酵母(Pichia pastoris)是重要的外源蛋白真核表达系统[1],但目前仍有许多外源蛋白难以在毕赤酵母中高效表达[2, 3, 4]。一些提高外源蛋白表达量的方法,如优化外源基因密码子、增加外源基因拷贝数、与高表达蛋白融合及优化发酵条件等[5, 6, 7],虽然对表达量有所改善,但效果仍很不理想。近年来的研究发现,影响外源蛋白在毕赤酵母中分泌表达的限速步骤与内质网密切相关[8]。内质网是分泌型蛋白及某些胞内蛋白完成翻译、翻译后修饰、转运等过程的第一个重要场所,多种定位于内质网的分子伴侣参与这一过程。未完成正确折叠的外源多肽会对内质网造成压力,并激活UPR(unfolded protein response)、ERAD(ER-associated degradation)及ER自噬(ER-phagy)等途径[9],具体表现为很多分子伴侣的表达水平发生明显的改变。外源多肽在分子伴侣的帮助下进行重新折叠、或被分子伴侣引导进入降解途径,因此,定位于内质网的各种分子伴侣在外源蛋白向胞外分泌过程中起着非常重要的作用。
Kar2p是Hsp70家族的分子伴侣,由karyogamy基因编码[10, 11],定位在所有真核细胞内质网,在内质网压力监控体系中起重要作用[12]。有证据表明,Kar2p能够与新合成的多肽结合[13, 14],防止它们在内质网聚集和沉淀,也阻止错误折叠的多肽离开内质网,并引导其进入降解途径[15, 16],另外,Kar2p还帮助蛋白从内质网向细胞膜的转运[17]。但Kar2p如何辨别多肽链折叠错误,目前尚不清楚。
在酿酒酵母(Saccharomyces cerevisiae)中,Kar2p的过表达可以提高牛凝乳酶[18]、水蛭素[19]的表达量,但对植物甜蛋白的表达却无明显作用[18],在汉逊酵母(Hansenula polymorpha)中,Kar2p的过表达反而导致米曲霉葡萄糖氧化酶(Aspergillus niger glucose oxidase,GOX)的表达量下降10倍[20]。在毕赤酵母中,外源蛋白Anti-CD3 immunotoxin能够促进Kar2p的过表达,部分Kar2p甚至会被分泌到胞外[21]。Kar2p的功能目前尚无确切定论,本研究尝试以表达假黑盘菌素的重组毕赤酵母为研究对象,通过过表达Kar2p以便分析它对假黑盘菌素分泌表达的影响。
1 材料与方法 1.1 材料毕赤酵母菌株GS115、表达载体pPIC9k购自Life Technologies,大肠杆菌top10感受态、克隆载体pEASY-T、DNA凝胶回收试剂盒购自北京全式金生物技术有限公司,DNA限制性内切酶、连接酶及DNA修饰酶购自NEB,酵母总RNA提取试剂盒购自原平皓生物技术有限公司,RT-PCR试剂盒、荧光定量PCR试剂盒购自TaKaRa公司,假黑盘菌素成熟多肽基因的合成由北京英茂盛业生物科技有限公司完成,DNA测序由农作物基因资源与基因改良国家重大科学工程开放实验室完成,溶壁微球菌(Micrococcus lysodeikticus)购自中国普通微生物菌种保藏管理中心,所有生化试剂购自北京化学试剂商店。
1.2 方法 1.2.1 假黑盘菌素表达载体的构建根据已公布的毕赤酵母甘油醛-3-磷酸脱氢酶组成型启动子pGAP DNA序列(GenBank U62648.1)合成上下游引物G-F:5'-TAGAGCTCTTTTTTGTAGAAATGTC-TTGGTGT-3'和G-R:5'-TAGGATCCTGTGTTTTG- ATAGTTGTTCAATTG-3',以毕赤酵母基因组DNA为模板,扩增pGAP,扩增条件:94℃预变性2 min,94℃变性30 s,55℃退火40 s,72℃延伸1 min,30个循环,72℃延伸10 min。扩增产物连接到T载体内,转化大肠杆菌top10,挑取阳性克隆并测序正确后,用SacⅠ和BamHⅠ双酶切将pGAP从T载体切下,与经同样双酶切的pPIC9K质粒连接,得到质粒9K-G。
假黑盘菌素成熟多肽基因用XhoⅠ和NotⅠ从中间载体切下,然后与同样酶切的9K-G质粒连接,得到表达载体mp-9KG。为便于后续的二次转化,将载体mp-9KG经XmaⅠ酶切,然后用T4 DNA聚合酶补平后自连,得到卡那霉素(G418)抗性基因缺陷型表达载体mp-9KGH。
1.2.2 Kar2p基因的克隆与表达载体的构建酵母总RNA的提取以及RNA反转录成cDNA完全参照试剂盒说明书,根据已知Kar2p基因序列(GenBank:U62648.1),合成上下游引物:Kar-F:GGATCCAAACGATGCTGTCGTTAAAACCATCTTGGC及Kar-R:GCGGCCGCCTACAACTCATCATGATCATAGTC。以cDNA为模板,经RT-PCR扩增得到Kar2p基因,将其T载体后得到中间质粒Kar-T,转化大肠杆菌top10,挑取阳性克隆并测序正确后,用BamHⅠ和NotⅠ酶切回收Kar2p基因片段,与经同样酶切的pPIC9k载体连接,得到表达载体Kar-9K。
1.2.3 毕赤酵母的转化和筛选毕赤酵母的转化参照产品说明书,将载体mp-9KGH经SalⅠ线性化,电击转化至菌株GS115感受态中,涂布于RDB(1 mol/L sorbitol,2% dextrose,1.34% YNB,4×10-5% biotin,0.005% amino acids,2% agar)平板,28℃静置2-3 d,至菌落长出。随机挑取单菌落,接种于5 mL YPDD(1% yeast extract,2% peptone,2% dextrose)培养基中,28℃ 200 r/min震荡培养3 d,离心收集发酵液上清进行抑菌实验,随机选取一株具有抑菌活性的转化子,命名为P-Ple并用于后续实验。
载体Kar-9K经BglⅡ线性化后,按照上述转化方法,对P-Ple进行再次转化,将转化液涂布于含有0.1-2 mg/mL G418的YPDD固体平板上,28℃静置2-3 d,至菌落长出。随机挑取单菌落,接种于含有0.5 mg/mL G418的5 mL YPDD培养基中,28℃ 200 r/min震荡培养3 d,提取转化子基因组DNA为模板进行PCR检测(上下游引物分别为:AOX-F:GACTGGTTCCAATTGACAAGC;3'端引物AOX-R:GGCAAAT GGCATTCTGACATCCTC),验证Kar2p基因是否已整合到P-Ple基因组中。随机选取一株PCR阳性转化子,命名为P-PleKar并用于后续实验。
1.2.4 荧光定量PCR测定Kar2p的转录水平分别挑取P-Ple和P-PleKar两个转化子的单菌落,接种于5 mL YPDD培养基中,28℃ 200 r/min震荡培养24 h,再按照1%接种量转接至5 mL YPDD培养基中,28℃震荡培养24 h,取2 mL菌液收集菌体,按照试剂盒说明书方法,提取总RNA,反转录成cDNA;其余菌液离心收集菌体,重悬至3 mL YPDM(1% yeast extract,2% peptone,0.5% methanol)培养基中,28℃ 200 r/min震荡培养24 h,取2 mL菌液收集菌体,提取总RNA,反转录成cDNA。分别以上述甲醇诱导前和诱导后的cDNA为模板,以kar-qF:CTACTTCAACGACGCTCAA和kar-qR:CCACCCTCAATAGAAAGCAGA为上下游引物,荧光定量PCR(按照试剂盒说明书)测定Kar2p的转录水平,以持家基因AOX2为内参,所用的上下游引物分别为:AOX-qF:GACTCTGATGAGGGGCACAT和AOX-qR:TTGGAAACTCCCAACTGTCC。
1.2.5 毕赤酵母菌体生长量测定分别挑取P-Ple和P-PleKar两个转化子的单菌落,接种于5 mL YPDD培养基中,28℃ 200 r/min震荡培养24 h,再按照1%接种量接种至50 mL YPDD培养基中,28℃ 200 r/min震荡培养24 h,5 000 r/min离心5 min,收集菌体,分别将两个转化子的菌体重悬于YPDM培养基中,并用YPDM培养基调节OD600至一致,28℃ 200 r/min震荡培养,每隔24 h,测定OD600,并补加0.5%的甲醇,绘制生长曲线。
1.2.6 假黑盘菌素的表达与抗菌活性测定将溶壁微球菌接种至2 mL液体LB培养基中,37℃ 200 r/min震荡培养过夜,取5 μL于200 mL的45℃融化状态的固体LB培养基中,混匀倒平板,待凝固后用直径为5 mm的打孔器在固体培养基上打孔,将50 μL待测发酵液加入孔中,37℃静置过夜,观察并测量抑菌圈直径。
2 结果 2.1 表达载体的构建载体mp-9KGH已携带假黑盘菌素基因,在pGAP启动子调控下,可组成型分泌表达假黑盘菌素重组蛋白。在该载体中,卡那霉素(Kanamycin)抗性基因被移码突变,转化酵母细胞后转化子不具有G418抗性,但能以HIS4缺陷型作为选择标记。载体Kar-9K携带Kar2p基因,在乙醇氧化酶诱导型启动子pAOX1调控下,可胞内表达Kar2p伴侣蛋白,在该载体中,含有卡那霉素抗性基因,酵母转化子具有G418抗性,可作为转化子筛选标记(图 1)。
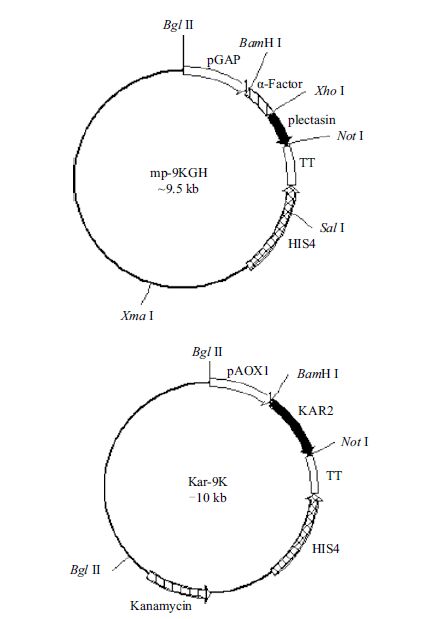
|
| 图 1 表达载体mp-9KGH和Kar-9K结构示意图 |
载体mp-9KGH经SacⅠ和NotⅠ双酶切,以同样双酶切的9K-G质粒作为阴性对照,载体mp-9KGH因携带有假黑盘菌素成熟蛋白基因,可切下一个约900 bp的DNA片段,略大于9K-G质粒切下的DNA片段(图 2中泳道1和2),与预期的结果相一致。Kar-9K经BamHⅠ和NotⅠ双酶切,可切下一个约2 kb的DNA片段,比以同样双酶切的pPIC9k切下的DNA片段要大很多(图 2中的泳道3和4),证实mp-9KGH和Kar-9K载体构建正确。
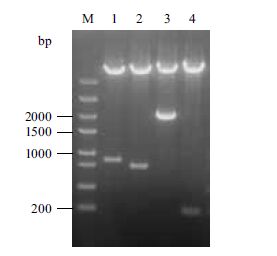
|
| M:DNA marker;1:mp-9KGH经Sac I和Not I双酶切;2:9K-G经Sac I和Not I双酶切;3:Kar-9K经BamH I和Not I双酶切;4:pPIC9k经BamH I和Not I 图 2 mp-9KGH和Kar-9K的酶切鉴定 |
载体mp-9KGH经SalⅠ线性化,电转化至毕赤酵母菌株GS115中,经组氨酸缺陷型培养基筛选和PCR验证,获得阳性酵母转化子P-Ple。利用P-Ple发酵液上清进行体外抑菌实验,发现该发酵上清能够在溶壁微球菌固体平板上产生明显的抑菌圈。
P-Ple对G418不再具有抗性,因此以G418为筛选压,利用Kar-9K可对P-Ple进行二次转化,将转化菌液等量涂布于含不同浓度G418的YPDD平板上,28℃培养48 h。如图 3所示,当G418浓度为0.1 mg/mL时,背景菌布满平板,表明G418浓度太低无筛选作用;当G418浓度高于1.0 mg/mL时,平板上无菌落长出,表明G418浓度过高,转化子无法生长;当G418浓度为0.5 mg/mL时,平板上产生了一定数量的单菌落,从中随机挑取10个单菌落进行菌落PCR检测,发现它们均携带有Kar2p基因。利用这10株转化子发酵液上清进行体外抑菌实验,发现其中9株都能产生抑菌圈,只有一株无抑菌活性,可能是由于二次转化导致假黑盘菌素基因丢失。从9株具有抑菌活性的转化子中随机选取一株,命名为P-PleKar,连续转接3代,发酵液上清抑菌活性没有改变,表明外源基因可稳定遗传。
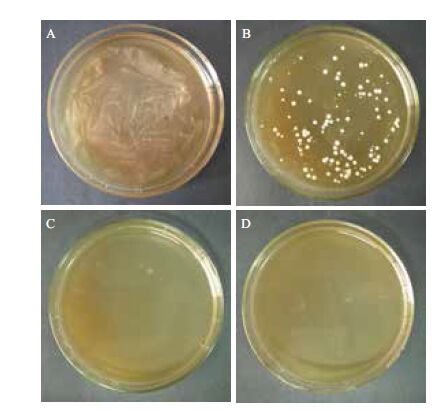
|
| A:0.1 mg/mL G418;B:0.5 mg/mL G418;C:1.0 mg/mL G418;D:2.0 mg/mL G418 | 图 3 Kar-9K二次转化的G418抗性筛选
为研究P-PleKar中KAR2基因能否在细胞内诱导表达,利用荧光定量PCR(Applied Biosystems® 7500 Real-Time PCR Systems)检测了P-Ple和P-Ple-Kar两种转化子中KAR2基因的转录水平,扩增曲线在合理的范围内(图 4-A)。以P-Ple中KAR2基因的转录水平为对照,计算P-PleKar中KAR2基因的相对转录水平。研究发现,在甲醇诱导前(诱导0 h),P-Ple和P-PleKar中KAR2的转录水平相当,在甲醇诱导24 h后,P-PleKar中KAR2的转录水平达到P-Ple的18倍,表明Kar2p已经在P-PleKar中过表达(图 4-B)。
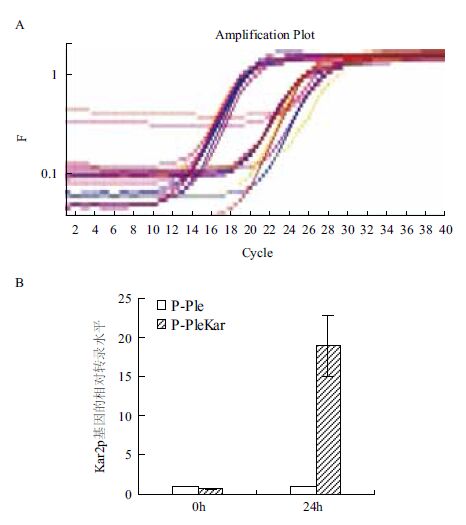
|
| 图 4 qPCR扩增图谱(A)及qPCR测定Kar2p的相对转录水平(B) |
为研究Kar2p过表达对宿主细胞生长的影响,测定了各转化子的生长曲线(图 5)。发现随着诱导时间延长,P-Ple和P-PleKar两种转化子生长曲线基本吻合,表明Kar2p过表达对宿主细胞生长无明显影响。
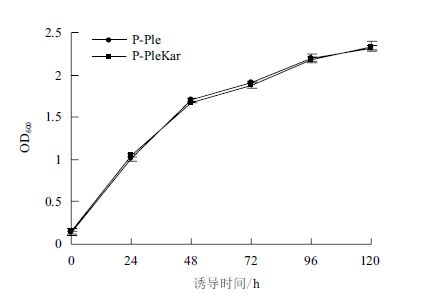
|
| 图 5 Kar2p的过表达对宿主的细胞生长的影响 |
分别对P-Ple和P-PleKar两个转化子发酵液上清进行抑菌活性测定,测量抑菌圈直径(图 6),以直径的长度为纵坐标,以发酵时间为横坐标绘制线性图(图 7),发现P-Ple发酵液在甲醇诱导48 h时,抑菌圈直径达到2.6 cm,表明此发酵液中的假黑盘菌素浓度最高(图 6下孔3),但随着诱导培养时间的延长,其抑菌活性逐渐降低,当诱导培养至120 h时,抑菌圈完全消失,这表明此时发酵液中的假黑盘菌素浓度最低。

|
| 1-6:分别为甲醇诱导0、24、48、72、96及120 h的发酵液上清抑菌圈 图 6 P-PleKar和P-Ple发酵液在溶壁微球菌平板上产生的抑菌圈 |
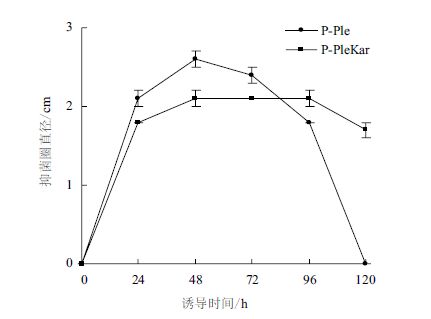
|
| 图 7 P-PleKar和P-Ple发酵液抑菌圈直径相对于发酵时间的变化 |
P-PleKar发酵液上清抑菌活性随时间的变化与P-Ple不同,在诱导培养48 h时,抑菌圈直径也达到最大值。但仅有2.1 cm,远低于P-Ple的2.6 cm(图 6上孔3),随着培养时间延长至96 h,抑菌圈直径仍保持不变,表明发酵液中的假黑盘菌素较稳定,能始终维持最大浓度,而P-Ple则变化比较大,在培养后期,发酵液中的假黑盘菌素浓度快速下降。该结果表明,Kar2p过表达对发酵液中的假黑盘菌素浓度产生了影响,这种变化既涉及假黑盘菌素表达量的改变也涉及假黑盘菌素的胞外降解过程。
3 讨论为进一步了解分子伴侣Kar2p的功能,本研究克隆了毕赤酵母GS115菌株的Kar2p基因,通过二次转化,探索Kar2p如何影响假黑盘菌素在毕赤酵母中的表达。结果发现,Kar2p的过表达对宿主细胞的生长无明显影响,即酵母细胞的生长与死亡速率在二次转化前后无明显变化,但对外源蛋白假黑盘菌素的表达确实产生了一定的抑制作用,受Kar2p的影响,在诱导培养48 h时,假黑盘菌素的最高抑菌活性降低。这种抑制表达不单单针对假黑盘菌素,对毕赤酵母自身的蛋白酶表达和分泌也同样起到了一定的抑制作用,具体表现在分泌到培养液中的假黑盘菌素在发酵后期仍然能保持较高抑菌活性,而没有被发酵液中的累积的蛋白酶快速降解。酵母细胞具有严密的蛋白质合成质量控制系统[22],内质网相关的质量控制系统对分泌蛋白的合成起到关键作用[23]。Kar2p是内质网质量控制系统的感受器[12]。因此可以推测,本研究中Kar2p的过表达将激活内质网的UPR途径,细胞中物质和能量代谢将优先投入到多种分子伴侣的上调表达中,外源蛋白假黑盘菌素和宿主细胞蛋白酶等其它蛋白分子的表达量则下调,这样既不影响细胞的正常生长,又降低了物质和能量的消耗。而有关假黑盘菌素和蛋白酶表达下调的具体分子机制本研究室将做进一步研究。
本研究使用的二次转化方法,利用了同一表达载体的两个不同筛选标记,通过移码突变,造成宿主细胞原卡那霉素抗性基因丧失,方便对其进行二次转化和筛选转化子。该方法无需另外插入其它抗性基因,排除了两个转化子中假黑盘菌素基因拷贝数的差异,使两个转化子的目标蛋白表达量具有可比性。此方法操作简便,节省资源,是一种可以广泛使用的二次转化方法。
除Kar2p外,毕赤酵母的分子伴侣蛋白还有很多种,它们对外源蛋白的表达和分泌也起着到非常重要的作用,采用类似的方法,可对它们的功能逐一鉴定,这对于最终弄清毕赤酵母的外源蛋白分子表达机制是十分有益的。
4 结论本研究克隆了毕赤酵母菌株GS115的Kar2p基因,并将Kar2p基因二次转化至假黑盘菌素的毕赤酵母表达菌株中,采用0.5 mg/mL G418作为筛选压,获得了二次转化子P-PleKar,P-PleKar中Kar2p基因的转录水平是P-Ple的18倍,Kar2p的过表达对宿主细胞的生长无明显影响,但在最高表达量略有降低的同时,可以维持假黑盘菌素更长时间的稳定表达。
| [1] | Schaeffer S, Piontek M, Ahn SJ, et al. Recombinant hepatitis B vaccines-characterization of the viral disease and vaccine production in the methylotrophic yeast Hansenula polymorpha[M]// Dembrowsky K, Stadler P. Novel Therapeutic Proteins. New York:VCH-Weinheim, 2001:245-273. |
| [2] | Gellissen G. Heterologous protein production in methylotrophic yeast[J]. Applied Microbiology and Biotechnology, 2000, 54:741-750. |
| [3] | Sue MP, Mariana LF, Brian M, et al. Heterologous protein production using the Pichia pastoris expression system[J]. Yeast, 2005, 22:249-270. |
| [4] | Porro D, Sauer M, Branduardi P, et al. Recombinant protein production in yeasts[J]. Molecular Biotechnology, 2005, 31:245-259. |
| [5] | Hohenblum H, Gasser B, Maurer M, et al. Effects of gene dosage, promoters, and substrates on unfolded protein stress of recombinant Pichia pastoris[J]. Biotechnology and Bioengineering, 2004, 85(4):367-75. |
| [6] | Resina D, Maurer M, Cos O, et al. Engineering of bottlenecks in Rhizopus oryzae lipase production in Pichia pastoris using the nitrogensource-regulated FLD1 promoter[J]. New Biotechnology, 2009, 25(6):396-403. |
| [7] | Marx H, Mecklenbräuker A, Gasser B, et al. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus[J]. FEMS Yeast Research, 2009, 9(8):1260-1270. |
| [8] | Smith MH, Ploegh HL, Weissman J S. Road to ruin:targeting proteins for degradation in the endoplasmic reticulum[J]. Science, 2011, 25, 334(6059):1086-1090. |
| [9] | Gasser B, Saloheimo M, Rinas U, et al. Protein folding and conform-ational stress in microbial cells producing recombinant proteins:a host comparative overview[J]. Microbial Cell Factories, 2008, 4(7):11-29. |
| [10] | Rose MD, Misra LM, Vogel JP. KAR2, a karyogamy gene, is the yeast homolog of the mammalian BiP/GRP78 gene[J]. Cell, 1989, 57(7):1211-1221. |
| [11] | Normington K, Kohno K, Kozutsumi Y, et al. S. cerevisiae encodes an essential protein homologous in sequence and function to mammalian BiP[J]. Cell, 1989, 57:1223-1236. |
| [12] | Gething MJ, Sambrook J. Protein folding in the cell[J]. Nature, 1992, 355:33-45. |
| [13] | Dorner A, Kaufman R. The levels of endoplasmic reticulum proteins and ATP affect folding and secretion of selective proteins[J]. Biologicals, 1994, 22(2):103-112. |
| [14] | Xu CL, Wang S, Thibault G, et al. Futile protein folding cycles in the ER are terminated by the unfolded protein O-mannosylationpat-hway[J]. 2013, 340(6135):978-981. |
| [15] | Nishikawa S, Fewell S, Kato Y, et al. Molecular chaperones in the yeast endoplasmic reticulum maintain the solubility of proteins for retrotranslocation and degradation[J]. The Journal of Cell Biology, 2001, 153(5):1061-1070. |
| [16] | Young BP, Craven RA, Reid PJ, et al. Sec63p and Kar2p are required for the translocation of SRP-dependent precursors into the yeast endoplasmic reticulum in vivo[J]. The EMBO Journal, 2001, 20:262-271. |
| [17] | Lyman SK, Schekman R. Binding of secretory precursor polypeptides to a translocon subcomplex is regulated by BiP[J]. Cell, 1997, 88:85-96. |
| [18] | Harmsen MM, Bruyne MI, Raue H A, et al. Overexpression of binding protein and disruption of the PMR1 gene synergistically stimulate secretion of bovine prochymosin but not plant thaumatin in yeast[J]. Applied Microbiology and Biotechnology, 1996, 46:365-370. |
| [19] | Kim MD, Han KC, Kang HA, et al. Coexpression of BiP increased antithrombotic hirudin production in recombinant Saccharomyces cerevisiae[J]. Journal of Biotechnology, 2003, 101:81-87. |
| [20] | Smith JD, Tang BC, Robinson AS. Protein disulfide isomerase, but not binding protein, overexpression enhances secretion of a non-disulfide-bonded protein in yeast[J]. Biotechnology and Bioengineering, 2004, 85:340-345. |
| [21] | Liu YY, Woo JH, Neville DM Jr. Overexpression of an anti-CD3 immunotoxin increases expression and secretion of molecular chaperone BiP/Kar2p by Pichia pastoris[J]. Applied and Environmental Microbiology, 2005, 71(9):5332-5340. |
| [22] | Monica CR, Ramanujan SH. Design principles of protein biosynth-esis-coupled quality control[J]. Developmental Cell, 2012, 23(5):896-907. |
| [23] | Hery U, Estefanie D, Fernanda L, et al. When ER stress reaches a dead end[J]. Biochimica et Biophysica acta, 2013, 1833:3507-3517. |




