吩嗪-1-甲酰胺(Phenazine-1-carboxamide,PCN)是一种天然的吩嗪类化合物,具有广谱的抗真菌活性,主要由假单胞菌属合成[1, 2, 3]。与已经获得的农药药证的第一代吩嗪类生物农药——申嗪霉素[4, 5]相比,该抗生素具有更好的安全性、稳定性及对植物病原真菌的抑菌活性[6, 7],在防治水稻纹枯病和小麦赤霉病等方面具有重要的应用价值[8]。据报道,目前能合成PCN的微生物菌株有绿针假单胞菌PCL1391[2],铜绿假单胞菌PAO1[9],PUPa3[10],PUP6[11],MML221[8]等,但由于PCN产率较低,尚未能大规模推广应用。
由清华大学和北京思清源生物科技公司合作研发的常压室温等离子体(Atmospheric and room temperature plasma,ARTP)诱变育种系统利用了ARTP在放电时产生的各种电子流对微生物基因进行损伤从而诱导其进行诱变,能在常压室温下操作,具有成本低、安全性高、操作简便等优越性,取得了良好的实际应用效果[12, 13]。绿针假单胞菌HT66为本实验室从水稻根际分离的一株可以天然合成吩嗪-1-甲酰胺(PCN)的野生型菌株,PCN产量可达425 mg/L,是目前国际上报道的吩嗪化合物产量最高的野生菌株;张平原[14]从绿针假单胞菌HT66出发,经过多轮的紫外线和亚硝基胍处理,获得了高产突变株P3,PCN产量为野生株的3.9倍。为了避免长期使用相同诱变技术导致菌株出现钝化现象,本研究以P3为出发菌株,尝试以一种新型的ARTP技术进行诱变育种[15, 16],并对突变株的发酵条件进行初步的优化,进一步提高PCN产量。
1 材料与方法 1.1 材料出发菌株:绿针假单胞菌P3(Pseudomonas Chlororaphis P3),由实验室保存。
King’s B固体培养基[17, 18](g/L):蛋白胨20,甘油 18.915,K2HPO4 0.514,MgSO4 0.732,琼脂20,pH 7.5。
种子培养基(g/L):成分除无琼脂外同King’s B固体培养基,60 mL装于250 mL凹槽三角瓶中。
发酵培养基(g/L):基础成分同种子培养基,具体成分实验中优化。
1.2 方法 1.2.1 PCN检测方法取24 h发酵液0.4 mL,加入20 μL 6 mol/L盐酸酸化后,用3.6 mL乙酸乙酯震荡萃取5 min,取0.4 mL萃取液吹干后加入1 mL乙腈溶解,以HPLC检测。
HPLC检测条件:色谱柱为WondaSil-WR反相柱,流动相为乙腈-25 mmol/L乙酸铵,流动相比例:0-2 min,8%乙腈-92% 25 mmol/L乙酸铵;2-20 min,乙腈浓度由8%升至60%,乙酸铵浓度由92%下降至40%;20-21 min,8%乙腈-92%乙酸铵。检测波长254 nm,柱温30℃,流速1.0 mL/min。
1.2.2 ARTP诱变本实验以PCN高产突变株P3作为出发菌,利用ARTP技术对菌株进行诱变处理。取对数期的P3菌悬液(OD600值为0.6左右),用0.01 mol/L PBS缓冲液洗涤3次后取10 μL的菌液均匀涂抹于金属载片。设置仪器功率为100 W,气流量10 SLM,照射距离2 mm。实验中以时间为变量,各组处理时间分别为0 s、20 s、30 s、45 s、60 s、90 s、120 s,制作致死率曲线。根据致死率,以20 s照射时长为最佳诱变条件重复等离子体的照射诱变,以获得最佳诱变效果。将诱变菌液稀释后涂布King’s B平板,观察菌株在平板上的生长情况,根据菌落产生PCN晶体的时间和大小初步筛选出高产突变株,最后进行摇瓶发酵,HPLC检测PCN产量。
1.2.3 不同营养因子对PCN发酵的影响 1.2.3.1 碳源的影响在King’s B培养基中,以等摩尔数的碳原子为基准分别添加甘油、麦芽糖、葡萄糖、蔗糖作为碳源,28℃,180 r/min,摇床培养24 h后检测PCN产量,每组设3个平行实验。
1.2.3.2 氮源的影响根据不同氮源的含氮量,往King’s B培养基中分别添加相同摩尔量的有机氮源(蛋白胨、玉米浆、牛肉膏)和无机氮源(硫酸铵)作为氮源,其他条件同上。
1.2.3.3 微量元素的影响根据植物根际中矿物质成分分布,分别添加Cu2+、Fe3+、Mn2+和Zn2+四种阳离子为考察对象,阳离子最终浓度为1 mmol/L,保持阴离子为Cl-,其他条件同上。
1.2.3.4 氨基酸的影响分别添加等摩尔浓度(1 mmol/L或5 mmol/L)的苯丙氨酸、酪氨酸、色氨酸到King’s B培养基中,并设空白对照组,其他条件同上。
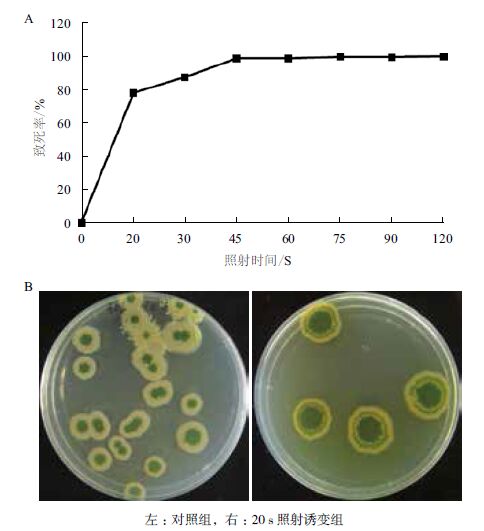
2 结果 2.1 诱变菌株的筛选 2.1.1 ARTP诱变致死率曲线根据致死率公式制作绿针假单胞菌P3株的诱变致死率曲线,如图 1所示。

由图 1-A可知,等离子体照射与P3株的致死率存在着明显的剂量效应关系。照射时间20 s时,致死率为77.54%;照射时间45-90 s时,致死率在98%以上;照射时间为120 s时,菌株被完全杀死。为保证较高的正突变率,可使致死率保持在75%左右,因此本实验选择20 s为最适宜的照射时长,并进行多次诱变实验,结果如图 1-B所示。
|
| 左:对照组,右:20 s照射诱变组 图 1 绿针假单胞菌P3株的ARTP致死率曲线(A)和平板培养菌落图(B) |
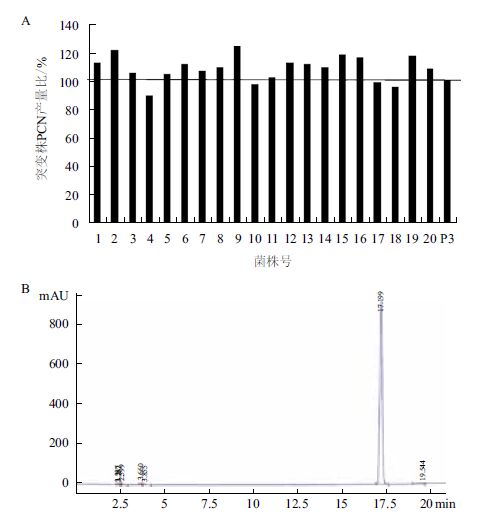
经过ARTP诱变处理,根据固体平板培养基上单菌落产生绿色结晶(PCN)时间的先后和晶体量筛选出20株突变株,进行在King’s B培养基中摇瓶培养,并通过HPLC检测PCN产量,如图 2所示。大部分初筛的诱变菌株PCN产量与出发菌株P3相比均有提高,只有少量菌株产量降低(图 2-A);其中,诱变株P3-9产量最高,为P3株的125%左右,达到2 093 mg/L,说明ARTP诱变对于提高菌株PCN产量有着良好的效果,并选择突变株P3-9进行后续实验。图 2-B为突变株P3-9的HPLC检测图,PCN保留时间为17.199 min。
|
| 图 2 ARTP诱变初筛菌株与出发菌株P3的PCN产量比(A)和菌株P3-9的HPLC检测图(B) |
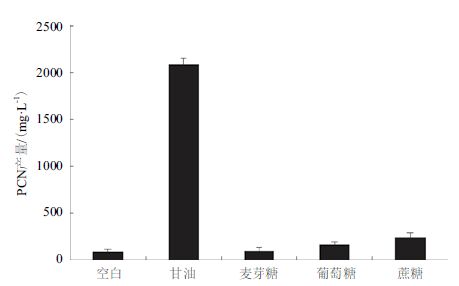
考察5种发酵常用碳源对PCN产量的影响,结果(图 3)表明不同的碳源对PCN产量影响差异很大。其中,以甘油为碳源的培养基中PCN产量最高,为2 100 mg/L左右,而以麦芽糖作为碳源PCN产量仅为不到100 mg/L,以葡萄糖及蔗糖为碳源时的PCN产量稍高于空白组,分别为161 mg/L和234 mg/L。
|
| 图 3 碳源对PCN合成的影响 |
分别以有机氮源蛋白胨、牛肉膏、玉米浆和无机氮源硫酸铵、硝酸钾为对象,考察不同氮源对PCN产量的影响,结果见图 4。由图 4可知,以蛋白胨为氮源进行发酵PCN产量最高,达2 031 mg/L,而添加工业常用的玉米浆和无机氮源硫酸铵、硝酸钾几乎无PCN产生。以牛肉膏为氮源PCN的产率与蛋白胨相比相对较低,仅为231 mg/L。

|
| 图 4 不同氮源对PCN合成的影响 |
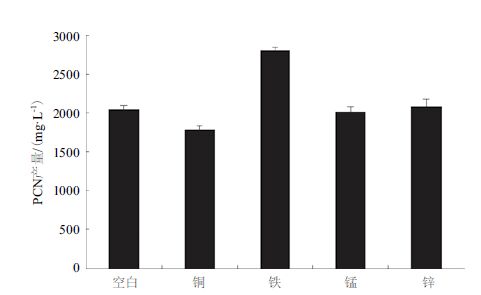
本实验以Cu2+、Fe3+、Mn2+和Zn2+四种阳离子为考察对象,添加各种阳离子(浓度为1 mmol/L)到King’s B培养基中,阴离子均为Cl-,发酵24 h后检测PCN产量,结果(图 5)表明,与空白对照组相比,加入Cu2+的实验组中PCN产量反而降低,加入Mn2+和Zn2+对于PCN产量无明显影响;而加入Fe3+对于PCN的积累有明显促进作用,比空白对照组高出约760 mg/L,高达2 810 mg/L。
|
| 图 5 不同微量元素对PCN产量的影响 |
为了进一步验证铁离子对PCN产量的促进作用,并探究不同价态铁离子和不同阴离子对PCN合成的影响,本实验分别考察了2 mmol/L浓度的氯化亚铁、氯化铁、硫酸亚铁和硫酸铁对PCN合成的影响。结果(图 6)显示,空白对照组中PCN产量为2 073 mg/L,而添加了Fe2+和Fe3+的实验组的PCN产量普遍保持在2 800 mg/L左右,产量提高了35%,说明Fe2+和Fe3+对于促进PCN积累均有显著效果。在同种阳离子条件下,阴离子种类对于PCN产量的影响不明显,进一步验证了铁离子对于PCN产量的影响。此外,与添加Fe3+相比,添加Fe2+的PCN产量略低20-30 mg/L,且Fe2+不稳定,高温下易被氧化,故可考虑在培养基中添加适量FeCl3溶液,提高PCN产量。

|
| 图 6 添加Fe2+和Fe3+对PCN产量的影响 |
外源添加浓度为1 mmol/L和5 mmol/L氨基酸,研究苯丙氨酸、酪氨酸和色氨酸对PCN合成的影响。由结果(图 7)可知,与空白对照组相比,添加色氨酸后 PCN产量略微降低,由此推测可能高浓度的色氨酸对合成途径存在一定的反馈抑制作用。添加1 mmol/L的苯丙氨酸和酪氨酸对于PCN产量无明显影响,而当添加浓度为5 mmol/L时,苯丙氨酸和酪氨酸对于PCN的积累有轻微的促进作用。

|
| 1:1 mmol/L Phe;2:5 mmol/L Phe;3:1 mmol/L Trp;4:5 mmol/L Trp;5:1 mmol/L Tyr;6:5 mmol/L Tyr 图 7 不同氨基酸对PCN产量的影响 |
假单胞菌产生吩嗪类抗生素吩嗪-1-甲酰胺具有广谱的抑菌性,具有良好的应用前景[1, 2, 3],但大部分研究仍处于实验室阶段,与工业化生产仍有较大差距[8, 9, 10, 11]。本研究利用ARTP诱变育种方法对P3株进行处理,并筛选到一株产量为P3株125%的高产突变株P3-9,并对菌株P3-9的发酵培养基进行了优化。单因素实验结果显示,生物柴油合成工业的副产物甘油及常作为发酵氮源的蛋白胨均有利于P3-9株在发酵过程中PCN的的积累。微量元素作为生物活性物质的组成成分或新陈代谢过程中生理活性作用的调节因子,对绿针假单胞菌PCL1391中PCN的合成[19]和铜绿假单胞菌M18中吩嗪-1-羧酸(PCA)的合成[20]有着重要的影响。本研究中,外源添加Fe3+可有效促进菌株PCN的合成,与Tjeerd van Rij等[19]的结果一致,推测Fe3+可能是特定酶的辅助因子或者参与了吩嗪化合物的氧化还原反应,从而明显地促进了次级代谢产物的合成,具体的作用机理有待进一步研究[21]。在假单胞菌的代谢网络中,吩嗪化合物与芳香族氨基酸共用部分合成途径[19]。但本研究中外源添加低浓度的苯丙氨酸、酪氨酸和色氨酸对于PCN产量效果并未像PCL1391中所报道的PCN产量提高数倍的情况[19],分析可能由于培养基中的复杂氮源已经包含少量氨基酸类物质所造成。后续可通过响应面[22]等方法研究不同营养因素对绿针假单胞菌中的PCN合成的影响,并确定最优培养基组分。另外,发酵条件如温度、溶氧量及pH值也是影响次级代谢产物积累的重要因素,通过对发酵条件进行优化可进一步为实现工业化生产提供可能。
4 结论(1)通过ARTP诱变实验,制定致死率曲线并确定了最佳诱变时间20 s,并通过初筛获得了20株诱变突变株,其中突变株P3-9的PCN产量最高,为出发菌株P3株的125%左右。由此可知,ARTP诱变育种是一种提高绿针假单胞菌PCN产量的有效手段。
(2)初步探索了培养基中各营养因子对诱变高产株合成PCN的影响,确定了用于发酵积累PCN的最佳碳源和氮源分别为甘油和蛋白胨,外源添加Fe3+和Fe2+对于积累PCN有显著的促进作用。外源添加少量苯丙氨酸、色氨酸和酪氨酸对于PCN产量无显著影响。
(3)由于工业育种技术的不断发展和假单胞菌自身对环境的敏感性,诱变育种及发酵优化可以作为有效的手段来提高吩嗪类抗生素的产量。
| [1] | Jane BL, John N. Phenazine natural products:biosynthesis, synthetic analogues, and biological aActivity[J]. Chem. Rev, 2004, 104:1663-1685. |
| [2] | Chin-A-Woeng TFC, Thomas-Oates JE, Lugtenberg BJJ, et al. Introduction of the phzH gene of Pseudomonas chlororaphis PCL1391 extends the range of biocontrol ability of phenazine-1-carboxylic acid-producing Pseudomonas spp. strains[J]. Mol Plant-Microbe Interact, 2001, 14:1006-1015. |
| [3] | Chin-A-Woeng TFC, Bloemberg GV, Mulders IHM, et al. Root colonization by phenazine-1-carboxamide-producing bacterium Pseudomonas chlororaphis PCL1391 is essential for biocontrol of tomato foot and root rot[J]. Mol Plant-Microbe Interact, 2000, 13:1340-1345. |
| [4] | 许煜泉. 绿色微生物源抗菌剂申嗪霉素(M18)[J]. 精细与专用化学品, 2004, 12(20):8-17. |
| [5] | 沈丽娟. 高效、广谱、安全生物杀菌剂——申嗪霉素[J]. 世界农药, 2011, 33(3):58. |
| [6] | 申慧峰. 在铜绿假单胞菌根际株M18中高效转化吩嗪-1-羧酸为吩嗪-1-甲酰胺[D]. 上海:上海交通大学, 2012. |
| [7] | Chin-A-Woeng TFC, Bloemberg GV, van der Bij AJ, et al. Biocontrol by phenazine-1-carboxamide-producing Pseudomonas chlororaphis PCL1391 of tomato root rot caused by Fusarium oxysporum f. sp. radicis-lycopersici[J]. Mol Plant-Microbe Interact, 1998, 11:1069-1077. |
| [8] | Shanmugaiah V, Mathivanan N, Varghese B. Purification, crystal structure and antimicrobial activity of phenazine-1-carboxamide produced by a growth-promoting biocontrol bacterium, Pseudomonas aeruginosa MML2212[J]. Journal of Applied Microbiology, 2010, 108(2):703-711. |
| [9] | Mavrodi DV, Bonsall RF, Delaney SM, et al. Functional analysis of genes for biosynthesis of pyocyanin and phenazine-1-carboxamide from Pseudomonas aeruginosa PAO1[J]. Journal of Bacteriology, 2001, 183(21):6454-6465. |
| [10] | Kumar RS, Ayyadurai N, Pandiaraja P, et al. Characterization of antifungal metabolite produced by a new strain Pseudomonas aeruginosa PUPa3 that exhibits broad-spectrum antifungal activity and biofertilizing traits[J]. Journal of Applied Microbiology, 2005, 98(1):145-154. |
| [11] | Naik PR, Sakthivel N. Functional characterization of a novel hydrocarbonoclastic Pseudomonas sp. strain PUP6 with plant-growth-promoting traits and antifungal potential[J]. Research in Microbiology, 2006, 157(6):538-546. |
| [12] | 王光耀. 高产率生产L-乳酸拟干酪乳杆菌的高通量选育方法建立及应用[D]. 上海:华东理工大学, 2013. |
| [13] | 施跃峰, 桑金隆, 竺莉红, 等. 等离子体处理选育之江菌素产生菌[J]. 核农学报, 2002, 16(4):208-211. |
| [14] | 张平原. 一株高产吩嗪-1-甲酰胺绿针假单胞菌HT66的鉴定与改造[D]. 上海:上海交通大学, 2014. |
| [15] | 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3):461-467. |
| [16] | 蔡友华, 李文锋, 卢伟宁, 等. 新型常压室温等离子体(ARTP)快速诱变高产苏氨酸的突变株[J]. 现代食品科技, 2013, 29(8):1888-1892. |
| [17] | Shtark O, Shaposhnikov AI, Kravchenko LV. The production of antifungal metabolites by Pseudomonas chlororaphis grown on different nutrient sources[J]. Mikrobiologiia, 2003, 72:645-650. |
| [18] | 陈鸿锐, 陈碧瑶, 陈玲玲. 吩嗪-1-羧酸发酵培养基配方的初步确定[J]. 生物技术世界, 2012(3):21. |
| [19] | van Rij ET, Wesselink M, Chin-A-Woeng TFC, et al. Influence of environmental conditions on the production of phenazine-1-carboxamide by Pseudomonas chlororaphis PCL1391[J]. MPMI, 2004, 17(5):557-566. |
| [20] | 李雅乾. 假单胞菌株M18吩嗪合成基因簇表达调控及其产物发酵优化研究[D]. 上海:上海交通大学, 2009. |
| [21] | Wang Y, Wilks JC, Danhorn T, et al. Phenazine-1-carboxylic acid promotes bacterial biofilm development via ferrous iron acquisition[J]. J Bacteriol, 2011, 193(14):3606-3617. |
| [22] | Du X, Li Y, Zhou W, et al. Phenazine-1-carboxylic acid production in a chromosomally non-scar triple-deleted mutant Pseudomonas aeruginosa using statistical experimental designs to optimize yield[J]. Appl Microbiol Biotechnol, 2013, 97:7767-7778. |




