脯氨酸、谷氨酰胺的剪接因子(Splicing factor proline and glutamine rich,SFPQ),最先被人们发现与前体mRNA剪切相关的蛋白,分子量为72 kD,由707个氨基酸组成,碱基序列中GC含量丰富,为广泛分布在动物体内的核蛋白[1, 2]。SFPQ对DNA的修复、细胞凋亡、转录调控和RNA的转运起到至关重要的作用[3],不仅可以单独参与DNA损伤的修复,它还可以介导DNA修复蛋白RAD51D来对DNA进行修复[4, 5, 6, 7],对DNA的修复起到极大的作用。
SFPQ同时也是体内重要的抑癌蛋白。在人结直肠腺癌上皮细胞中,SFPQ的沉默会导致通过caspase-3途径的细胞凋亡的产生[8]。在人体内,SFPQ可以与非编码RNA MALAT-1特异性结合,调控人体内肿瘤的形成[10];人们已经发现在小鼠体内,SFPQ可以和非编码RNA Vl30特异性结合来调节下游基因的表达[11, 12, 13]。
在小鼠大脑中,SFPQ大量富集于分化的神经元中,表明它可能与神经特异性剪切有关[14]。SFPQ也在斑马鱼的大脑发育中发挥重要作用,SFPQ缺陷的斑马鱼胚胎发育28 h后即出现死亡[15]。我们比对分析了斑马鱼SFPQ和人的SFPQ,发现斑马鱼SFPQ同样存在RNA结合域。本研究从斑马鱼胚胎中提取总RNA,将RNA逆转为cDNA,以cDNA为模板扩增出斑马鱼SFPQ基因,构建SFPQ原核表达载体,并对蛋白进行诱导和纯化,旨在为后续研究SFPQ在斑马鱼中的作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 斑马鱼斑马鱼取自四川大学生物治疗国家重点实验室斑马鱼中心。
1.1.2 表达载体及菌株pET28a(+)原核表达载体由本实验室保存;DH5α大肠杆菌购自南京唯赞生物公司;大肠杆菌BL21(DE3)感受态细胞购自全式金生物。
1.1.3 酶类与抗体PCR扩增用酶PrimeSTARHS购自TaKaRa公司;各种限制性内切酶、T4DNA连接酶和去磷酸化酶购自Thermo公司。斑马鱼SFPQ蛋白抗提购自ABCAM公司。
1.1.4 生化试剂与试剂盒TRIzol® Reagent购自Invitrogen公司;逆转录试剂盒购自Life Technologies公司;DNA marker购自Biomed公司;质粒提取试剂盒、胶回收试剂盒购自OMEGA公司;Ni-NTA琼脂糖镍柱购自QIAGEN公司;蛋白纯化柱购自Bio-Rad公司;Western blot显色液购自milipore公司。
1.2 方法 1.2.1 斑马鱼SFPQ基因的扩增取发育48 h的斑马鱼胚胎,用TRIzol® Reagent提取斑马鱼胚胎总RNA,以RNA为模板,用逆转录试剂盒转录出cDNA,保存备用;在GenBank上得到斑马鱼SFPQ的全序列,根据所得序列,设计出斑马鱼扩增引物,上游引物包含Xho I 酶切位点,序列为5'-3' CCGCTCGAGCGG atggggatgcgcggtggcat,下游引物包含BamH I 酶切位点,序列为5'-3' CGCGGATCCGCGTCAGAAGCGTGGCTTCTTGG;以所得cDNA 为模板扩增斑马鱼SFPQ基因。
1.2.2 原核表达载体的构建用Xho I和BamH I双酶切pET28a(+)载体,去磷酸化酶处理质粒,胶回收备用;将通过PCR得到的SFPQ片段用Xho I和BamH I酶切过夜,胶回收备用;将片段连入pET28a(+)中,转化入DH5α大肠杆菌感受态细胞中,用带有卡纳抗性的平板培养基37℃培养10-12 h,挑取单菌落,提取质粒后双酶切鉴定,将鉴定为阳性的质粒送去测序。
1.2.3 SFPQ蛋白的诱导表达将测序正确的pET28a-SFPQ质粒转化入BL21(DE3)大肠杆菌中,分别设置不同IPTG浓度、时间、来探索蛋白表达的最佳条件。IPTG浓度:其他条件不变,用含有卡纳抗性的LB液体培养基37℃培养细菌,待OD600值达到0.6时,分别向菌液中加入终浓度为0.25、0.5,0.75和1 mmol/L的IPTG进行诱导;诱导时间:其他情况不变,分别设置4、6、8、10、12 h进行诱导。待诱导完毕后,收集菌体,弃培养基,用PBS吹悬菌体,加入终浓度为80 mg/mL的溶菌酶,冰上放置30 min,超声波裂解细菌,超声10 s,间歇10 s,重复6次,5 000×g离心菌体15 min,SDS-PAGE分析。
1.2.4 SFPQ蛋白的纯化取500 μL的Ni-NTA琼脂糖镍柱,加入纯化柱中,用蒸馏水重悬珠子,待水从纯化柱下方流出后,用Binding buffer(NaH2PO4 50 mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)10 mmol/L,最终调pH为8.0)重悬,重复2次,备用;从50 mL菌液中收集细菌,5 000×g 10 min,用Binding buffer重悬菌体,加入8 mg溶菌酶,冰上放置30 min,然后用超声波裂解细菌,30%功率,超声10 s,间歇10 s,3 000×g离心15 min,取5 μL上清SDS-PAGE跑胶分析;将离心得到的上清加入含有琼脂糖珠子的纯化柱中,4℃在旋转仪上与珠子孵育2 h后,将上清从纯化柱下方流出,取5 μL SDS-PAGE跑胶分析;用wash buffer(NaH2PO4 50 mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)20 mmol/L,最终调pH为8.0)洗涤树脂,重复4次,分别取5 μL漂洗液SDS-PAGE胶分析;漂洗完毕后用elution buffer(NaH2PO4 50 mmol/L,NaCl 0.5 mol/L,咪唑(pH6.0)0.25 mol/L,最终调pH为8.0)洗脱蛋白,每200 μL洗脱1次,重复1次,分别取5 μL漂洗液SDS-PAGE胶分析,纯化好的蛋白-80℃保存备用。
1.2.5 质谱分析将纯化所得蛋白送去公司进行质谱分析。
1.2.6 Western blot分析将纯化得到的SFPQ蛋白用10% SDS-page电泳分离,90 V 1 h 将蛋白转至PVDF膜上,5%脱脂牛奶封闭1 h,用鼠抗斑马鱼的SFPQ一抗室温孵育1 h,用山羊抗鼠的二抗孵育1 h,显色液显色检测。
2 结果 2.1 斑马鱼SPFQ基因的扩增以逆转录得到的cDNA为模板进行PCR扩增,设置不同的退火温度,将扩增产物用1%琼脂糖凝胶检测,如图 1所示,当退火温度为55.6℃时,斑马鱼SFPQ基因扩增效率最高,扩增出的片段位于marker的2 kb处,与GenBank上给出的大小符合,表明成功的扩增出斑马鱼SFPQ基因。

|
| M:1 kb ladder marker;1:退火温度50℃;2:退火温度51℃;3:退火温度53.2℃;4:退火温度55.6℃;5:退火温度58℃; 图 1 斑马鱼SFPQ基因的扩增 |
将含有卡纳抗性的平板培养基上的单菌落挑出,用LB液体培养基培养过夜,提取质粒,用Xho I和BamH I双酶切鉴定,用1%琼脂糖凝胶进行检测,结果如图 2所示,在2 kb处有一被切下的片段,表明SFPQ基因已被连入pET28a质粒中,所得的阳性质粒测序结果显示,序列中无任何突变,阅读框正常,表明重组pET28a-SFPQ质粒成功构建。

|
| M:1 kb ladder marker;1:重组质粒双酶切鉴定 图 2 阳性重组子双酶切鉴定 |
将重组pET28a-SFPQ质粒转化到BL21感受态细胞中,37℃ 200 r/min培养至OD600为0.6时,加入终浓度分别0.25、0.5、0.75和1 mmol/L的IPTG诱导过夜,裂解细菌,分别取裂解液沉淀和上清用10%SDS PAGE胶电泳检测,结果如图 3-A所示,泳道2-5和泳道7-10中,在72 kD区域均出现了目的条带,表明SFPQ蛋白成功被诱导,且在IPTG浓度为0.75 mmol/L时,SFPQ诱导量达到最大。在探究诱导时间对SFPQ蛋白表达的影响中,分别设置了4、6、8、10、12 h不同的时间来诱导,实验结果(图 3-B)表明,当诱导时间为10 h时,得到的SFPQ蛋白的量最大。

|
| (A)不同IPTG浓度诱导斑马鱼SFPQ蛋白的表达,M:蛋白marker;1:BL21大肠杆菌沉淀阴性对照;2:0.25 mmol/L IPTG诱导BL21大肠杆菌裂解液沉淀;3:0.5 mmol/L IPTG诱导BL21大肠杆菌裂解液沉淀;4:0.75 mmol/L IPTG诱导BL21大肠杆菌裂解液沉淀;5:1 mmol/L IPTG诱导BL21大肠杆菌裂解液沉淀;6:BL21大肠杆菌裂解液上清阴性对照;7:0.25 mmol/L IPTG诱导BL21大肠杆菌裂解液上清;8:0.5 mmol/L IPTG诱导BL21大肠杆菌裂解液上清;9:0.75 mmol/L IPTG诱导BL21大肠杆菌裂解液上清;10:1 mmol/L IPTG诱导BL21大肠杆菌裂解液上清。(B)不同时间诱导斑马鱼SFPQ蛋白的表达,M:蛋白marker;1:阴性对照;2:诱导4 h;3:诱导6 h;4:诱导8 h;5:诱导10 h;6:诱导12 h 图 3 斑马鱼SFPQ蛋白的诱导表达 |
将收集好菌液后,用超声波裂解细菌,将裂解得到的上清与Ni-NTA琼脂糖镍柱孵育,带有his标签的SFPQ蛋白会与镍柱特异性结合,如图 4第2泳道为与纯化柱孵育后的上清,在72 kD左右的区域未见明显条带,表明诱导得到的SFPQ蛋白已结合在镍柱上,经过4轮的漂洗,非特异性结合在镍柱上的分子被洗脱下来,泳道7和8分别为第1次洗脱和第2次洗脱,在72 kD左右区域均出现明显条带,表明SFPQ蛋白被成功洗脱下来。

|
| M:蛋白marker;1:细菌裂解后上清;2:与纯化柱孵育后的上清;3:第1次漂洗;4:第2次漂洗;5:第3次漂洗;6:漂洗第4次;7:第1次洗脱;8:第2次洗脱 图 4 斑马鱼SFPQ蛋白的纯化 |
为确定纯化所得的蛋白为斑马鱼SFPQ蛋白,进行了质谱分析,质谱分析结果如图 5所示,质谱得到的肽段为PKIQSAPPKIQSP,经NCBI查询,所得肽段位于斑马鱼SFPQ中。
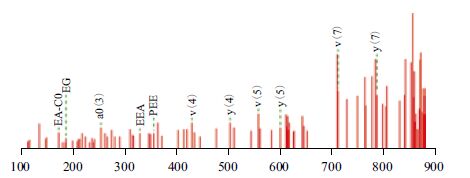
|
| 图 5 纯化SFPQ蛋白质谱结果 |
为了进一步确定我们所纯化的蛋白就是所需要的斑马鱼SFPQ蛋白,用了小鼠抗斑马鱼SFPQ蛋白的抗体作为一抗,以辣根过氧化物标记的山羊抗鼠的lgG作为二抗,进行Western blot检测(图 6),在72 kD区域左右,PVDF膜上有明显的反应条带,表明斑马鱼SFPQ蛋白抗体能够与我们纯化得到的蛋白特异性结合,说明纯化得到的蛋白即为斑马鱼SFPQ蛋白。
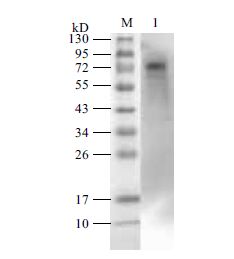
|
| M:蛋白marker;1:纯化所得SFPQ 图 6 斑马鱼SFPQ Western Blot检测 |
SFPQ广泛存在于脊椎动物中,它的高级结构中存在DNA结合域和RNA结合域,这对于参与核酸的相互作用具有重要的意义[2, 16, 17]。我们分析了人、小鼠、大鼠和斑马鱼中SFPQ的序列,发现其RNA结合域1高度保守。据报道,SFPQ在小鼠中与非编码RNA VL30结合,调控下游反应;在人中与非编码RNA NEAT1相结合,调控IL8的表达,发挥重要作用。因此可以选择斑马鱼作为模式动物,研究SFPQ与非编码长链RNA的相互作用。
SFPQ最开始被发现为前体mRNA的剪切因子[9],有研究发现,在患有老年痴呆症和皮克氏病的患者大脑中SFPQ是异常表达[18, 19, 20];在小鼠中,SFPQ参与调控P450scc基因的表达,对于胆固醇的形成具有重要的调节作用[21]。在斑马鱼中,SFPQ蛋白的缺失导致斑马鱼胚胎在发育28 h内即死亡,表明SFPQ对斑马鱼胚胎细胞的生长具有重要的作用,尤其对斑马鱼大脑发育起至关重要的作用[16]。
本实验从斑马鱼胚胎着手,用Trizol法提取了斑马鱼总RNA,并逆转录为cDNA,以cDNA为模板扩增出了斑马鱼SFPQ基因,经限制性内切酶酶切后,连入pET28a载体中,为了确保我们构建的载体中没有突变,将质粒测序,测序结果显示构建的载体没有发生碱基的替换、移码等突变。为了得到原核蛋白,将重组质粒转化入大肠杆菌BL21感受态细胞中,用不同浓度的IPTG对蛋白进行诱导,结果显示在终浓度为0.75 mmol/L时,SFPQ蛋白表达量最大,为了测定不同的诱导时间对蛋白表达的影响,我们分别取4、6、8、10、12 h为时间点对蛋白表达进行检测,结果表明在诱导时间为10 h时,SFPQ蛋白表达量达到最大。为了确认我们纯化得到的蛋白即为SFPQ蛋白,进行了质谱分析,同时以小鼠抗斑马鱼SFPQ蛋白的抗体作为一抗做Western blot检测,结果显示在72 kD区域出现了明显的条带,说明纯化得到的蛋白为斑马鱼SFPQ蛋白,并且具有抗原活性,可以用来研究非编码RNA调控SFPQ蛋白在斑马鱼大脑发育中的机制。
4 结论本实验成功构建了斑马鱼SFPQ原核表达载体,纯化得到了重组斑马鱼SFPQ蛋白,质谱结果和Western blot结果显示,纯化所得蛋白为斑马鱼SFPQ蛋白,可以用于研究非编码RNA调控SFPQ蛋白在斑马鱼大脑发育中的机制。
| [1] | Patton JG, Porro EB, Galceran J, et al. Cloning and characterization of PSF, a novel pre-mRNA splicing factor[J]. Genes Dev, 1993, 7:393-406. |
| [2] | Lee M, Sadowska A, et al. The structure of human SFPQ reveals a coiled-coil mediated polymer essential for functional aggregation in gene regulation[J]. Nucleic Acids Research, 2015, 43(7):3826-3840. |
| [3] | Shav-Tal Y, Zipori, D. PSF and p54(nrb)/NonO-multi-functional nuclear proteins[J]. FEBS Letter, 2002, 531:109-114. |
| [4] | Ha K, Takeda Y, Dynan WS. Sequences in PSF/SFPQ mediate radioresistance and recruitment of PSF/SFPQ-containing complexes to DNA damage sites in human cells[J]. DNA Repair(Amst), 2011, 10(3):252-259. |
| [5] | Morozumi Y, Takizawa Y, Takaku M, et al. Human PSF binds to RAD51 and modulates its homologous-pairing and strand-exchange activities[J]. Nucleic Acids Res, 2009, 37:4296-4307. |
| [6] | Rajesh C, Baker DK, Pierce AJ, et al. The splicing-factor related protein SFPQ/PSF interacts with RAD51D and is necessary for homology-directed repair and sister chromatid cohesion[J]. Nucleic Acids Res, 2011, 39:132-145. |
| [7] | Salton M, Lerenthal Y, Wang SY, et al. Involvement of Matrin 3 and SFPQ/NONO in the DNA damage response[J]. Cell Cycle, 2010, 9:1568-1576. |
| [8] | Tsukahara T, Matsuda Y, Haniu H. PSF knockdown enhances apoptosis via downregulation of LC3B in human colon cancer cells[J]. Biomed Res Int, 2013, 2013:204973. |
| [9] | Passon DM, Lee M, Rackham O, et al. Structure of the heterodimer of human NONO and paraspeckle protein component 1 and analysis of its role in subnuclear body formation[J]. PNAS, 2012, 109(13):4846-4850. |
| [10] | Imamura K, Imamachi N, Akizuki G, et al. Long noncoding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli[J]. Mol Cell, 2014, 53:393-406. |
| [11] | Zhang JQ L, LiuX, et al. Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J]. Br J Cancer, 2014, 111: 736-748. |
| [12] | Song X, Sun Y, Garen A. Roles of PSF protein and VL30 RNA in reversible gene regulation[J]. Proc Natl Acad Sci USA, 102, 12189-12193. |
| [13] | Song X, Sui AW, Garen A. Binding of mouse VL30 retrotransposon RNA to PSF protein induces genes repressed by PSF:Effects on steroidogenesis and oncogenesis[J]. PNAS, 2004(101):621-626 |
| [14] | Chanas-Sacre G, Mazy-Servais C, Wattiez R. Identification of PSF, the polypyrimidine tract-binding protein-associated splicing factor, as a developmentally regulated neuronal protein[J]. J Neurosci Res, 1999, 57:62-73. |
| [15] | Lowery LA, Sive RJ, H. Whitesnake/sfpq is required for cell survival and neuronal development in the zebrafish[J]. Dev Dyn, 2007, 236:1347-1357. |
| [16] | Kowalska E, Ripperger JA, Muheim C, et al. Distinct roles of DBHS family members in the circadian transcriptional feedback loop[J]. Mol Cell Biol, 2012, 32:4585-4594. |
| [17] | Duong HA, Robles MS, Knutti D. A molecular mechanism for circadian clock negative feedback[J]. Science, 2011, 332:1436-1439. |
| [18] | Guttula VS, Allam A, Gumpeny RS. Analyzing microarray data of Alzheimer’s using cluster analysis to identify the biomarker genes[J]. International Journal of Alzheimer’s Disease, 2012:649456. |
| [19] | Ke Y, Dramiga J, Schu U. Tau-mediated nuclear depletion and cytoplasmic accumulation of SFPQ in Alzheimer’s and Pick’s disease[J]. PLoS ONE, 7(4):e35678. |
| [20] | Götz J, Matamales M, Götz NN, et al. Alzheimer’s disease models and functional genomics— How many needles are there in the haystack?[J]Frontiers in Physiology, 2012, 3:320. |
| [21] | Urban RJ, Bodenburg Y, Kurosky A, et al. Polypyrimidine tract-binding protein-associated splicing factor is a negative regulator of transcriptional activity of the porcine p450scc insulin-like growth factor response element[J]. Mol Endocrinol, 2000, 14(6):774-82. |




