2.中国农业科学院兰州畜牧与兽药研究所 甘肃省牦牛繁育工程重点实验室,兰州 730050
2. Key Laboratory of Yak Breeding Engineering of Gansu Province,Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences,Lanzhou 730050
牦牛是分布于海拔2 000 m以上,以我国青藏高原为中心及其毗邻的高山亚高山地区的牛种之一,为牧民提供奶、肉、毛、役力、染料等生产和生活必需品[1]。牦牛肉属于半野生天然绿色食品,富含蛋白质、氨基酸、铁元素以及胡萝卜素、钙等微量元素,脂肪含量低,但牦牛肉的嫩度制约着其市场的接受度,因此,影响牦牛肉嫩度的候选基因成为当今研究的热点之一。
钙蛋白酶是一种存在于细胞内的非溶酶体性的限制性蛋白水解酶,与肉的嫩度和风味等食用品质密切相关。钙蛋白酶系统基因是理想的肉质嫩度分子标记[2]。CAPN3基因作为影响肉嫩度的候选基因,其分子生物学特性和生理调控功能是近年来研究的热点之一。CAPN3(Calpain3)是最典型的组织特异性钙蛋白酶,其在骨骼肌细胞中呈现高度表达特异性[3]。Lian等[4]的研究揭示了CAPN3的mRNA水平和蛋白质水平与肉的嫩度之间存在显著相关性。鸭骨骼肌发育过程中,CAPN3基因与肌纤维类型和肌纤维的生长发育密切相关。CAPN3基因的变异影响肉的品质[5]。侯冠彧等[6]对CAPN3基因的5'区域进行SNP检测和基因型分析,初步断定该基因本座位有影响肉牛生长及牛肉嫩度的倾向。Kimberly等[7]发现CAPN3的活性影响鼠肌肉的营养。延边黄牛CAPN3在位点5 556发生G→A突变,导致该位点的脂肪酸和氨基酸含量在不同基因型之间存在差异[8]。CAPN3的活性和表达水平影响肉质嫩度,并且与肢带型肌营养不良密切相关,存在着很强的遗传效应[9, 10, 11]。CAPN3在组织中的表达具有特异性,猪CAPN3和CAST基因在背最长肌中有较高的表达量[20]。姚慧等[13]分析了CAPN1和CAST基因在牦牛不同组织中的表达差异。CAPN3基因在牦牛不同组织中表达情况尚未见报道。
本实验克隆CAPN3基因的CDs区,并进行生物信息学分析,以期为深入研究牦牛CAPN3基因的定位与表达调控奠定基础。同时采用荧光定量PCR技术,检测CAPN3基因在牦牛不同组织的表达量,为进一步揭示CAPN3基因的分子生物学功能提供理论依据。
1 材料与方法 1.1 材料 1.1.1 组织样、细菌菌株和载体本实验选择3头成年青海省大通牦牛,屠宰后分别采集心脏、肝脏、脾脏、肺脏、肾脏、胰脏、背最长肌组织,放入液氮保存。
1.1.2 主要试剂E.coli DH5α购于宝生物公司;pGEM-T easy克隆载体购于Promega公司。TaKaRa反转录试剂盒、Trizol试剂、LA Taq DNA聚合酶购自宝生物工程有限公司,DNA Marker DL2000、DNA纯化回收试剂盒、高纯度质粒小量提取试剂盒、SYBR Green荧光定量试剂盒购于TIANGEN公司。
1.1.3 引物的设计与合成根据GenBank中普通牛CAPN3基因cDNA序列(登录号:149197.1)应用Primer5软件设计引物(表 1),由Sangon公司合成。
以成年牦牛背最长肌为材料,参照RNA提取试剂盒说明书提取RNA。总RNA用无菌DEPC水溶解,用琼脂糖凝胶电泳检测RNA的完整性。
1.2.2 PCR扩增与测序RNA反转录为cDNA:反应总体系为10 μL:5×gDNA Eraser Buffer(2.0 μL),gDNA Eraser(1.0 μL),Total RNA(1.0 μL),Rrime Script RT Enzyme Mix(1.0 μL),RT Primer Mix(1.0 μL),5×RrimeScript Buffer(4.0 μL),RNase Free H2O(10 μL)。PCR反应条件为:42℃ 25 min,85℃ 5 s,4℃保存。
PCR扩增双链:总反应体系25 μL:LA Premix 12.5 μL,上下游引物各0.5 μL,cDNA模板1.0 μL,RNase Free H2O 10.5 μL。PCR反应条件为:94℃预变性4 min;94℃变性30 s,55℃退火40 s,72℃延伸3 min,共30个循环;72℃延伸10 min,4℃保存。PCR产物用1%的琼脂糖凝胶电泳检测。
用DNA凝胶回收试剂盒回收PCR扩增产物,连接到pGEM-T easy载体上,16℃过夜。转化E.coli DH5α感受态细胞,接种转化后的DH5α于含有Amp的LB固体培养基上,37℃培养12-16 h后,挑取阳性菌落接种于含有Amp的LB液体培养基中,37℃条件下220 r/min振荡培养8 h,对菌液进行PCR鉴定后,送至Sangon公司测序。
1.2.3 实时荧光定量PCR反应体系和条件根据NCBI中下载的牦牛CAPN3基因(登录号:NM-174260.2)应用Primer5.0设计1对引物(表 1)。实时荧光定量PCR反应体系为10 μL,SYBRI Mix 5 μL,模板cDNA 0.6 μL,上下游引物各0.2 μL,RNase Free H2O 4 μL。PCR反应程序:95℃预变性30 s;95℃变性15 s,60℃退火30 s,40个循环。
2 结果 2.1 CAPN3基因的克隆及理化性质分析PCR产物用10 g/L的琼脂糖凝胶电泳分析,可见3条DNA片段(图 1),大小分别为2 064、1 057和1 104 bp,与预期DNA片段大小一致。重组质粒测序结果(图 2)表明,本研究克隆测序得到的序列为3 180 bp,通过BLAST比对确定该序列为牦牛CAPN3基因,其中开放阅读框长2 469 bp,编码822个氨基酸,起始密码子为ATG,终止密码子为TGA,CAPN3基因编码的蛋白分子量约为94.58 kD,理论等电点为5.70。含有20种基本氨基酸,其中含量最高的是Glu(7.5%),含量最低的是His(1.9%);含有带负电荷的残基122个,正电荷残基107个,酸性氨基酸为14.84%,碱性氨基酸为14.96%。

|
| M:DL2000 DNA Marker;1-3:PCR扩增产物 图 1 牦牛CAPN3基因PCR扩增产物的电泳图 |

|
| 图 2 牦牛CAPN3基因和编码蛋白序列 |
依据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律可知,牦牛CAPN3基因氨基酸序列的第491位Arg具有最低的分值-3.967,其亲水性最强;第481位Phe具有最高分值2.978,其疏水性最强。可知,整个多肽链表现为亲水性(图 3)。

|
| 图 3 牦牛CAPN3基因编码蛋白的疏水性预测 |
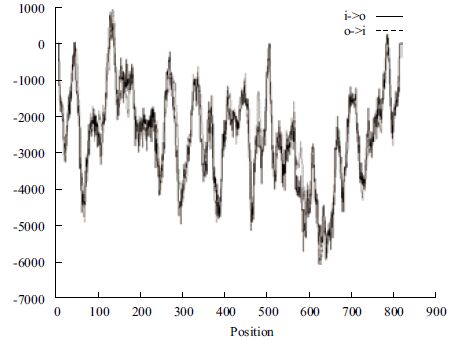
蛋白信号肽分析表明,CAPN3编码的蛋白不存在信号肽,属于非分泌蛋白。编码蛋白所有氨基酸都位于膜表面,可知其是一种表面蛋白(图 4)。
|
| 图 4 牦牛CAPN3基因编码蛋白跨膜分析 |
牦牛CAPN3基因编码蛋白的亚细胞定位分析结果可知,其分布在细胞质和细胞核中的可能性为39.1%,分布在线粒体中的可能性为8.7%,分布在液泡、细胞外基质和细胞骨架的可能性为4.3%。
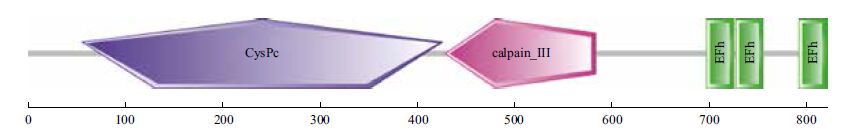
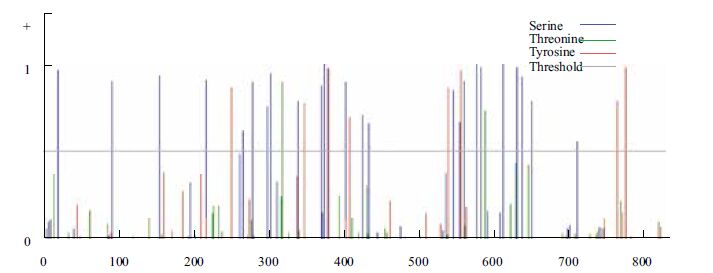
2.5 牦牛CAPN3基因编码蛋白结构域和蛋白质功能位点预测用Interpro软件对CAPN3基因编码蛋白进行结构域预测,结果(图 5)显示,该序列在56-426氨基酸序列之间有CysPc家族蛋白功能域,在429-583氨基酸序列之间有calpain-Ⅲ家族蛋白功能域,在697-725、727-755、792-820氨基酸序列之间有EFh家族蛋白功能域。运用Netphos软件对CAPN3基因编码蛋白分析,可知该蛋白有25个丝氨酸磷酸化位点,2个苏氨酸磷酸化位点,8个酪氨酸磷酸化位点(图 6)。
|
| 图 5 牦牛CAPN3基因编码蛋白结构域预测 |
|
| 图 6 牦牛CAPN3基因编码蛋白磷酸化位点预测 |
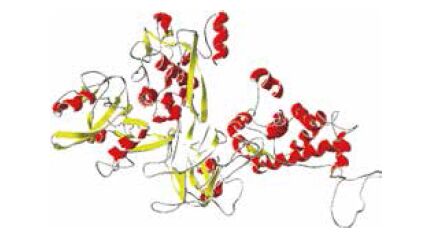
用SOPMA服务器预测CAPN3基因编码蛋白的二级结构,结果(图 7)表明,该蛋白包含35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角。可推断α-螺旋和无规则卷曲是牦牛CAPN3编码蛋白主要的二级结构元件。采用同源建模法,结果(图 8)显示,该蛋白主要由α-螺旋、无规则卷曲和β-折叠组成,与二级结构预测结果基本一致。

|
| 红色e:伸展链;橘黄色c:无规则卷曲;蓝色h:α-螺旋;绿色t:β-转角 图 7 牦牛CAPN3基因编码蛋白的二级结构预测 |
|
| 图 8 牦牛CAPN3蛋白三级结构预测图 |
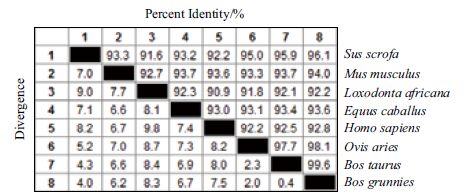
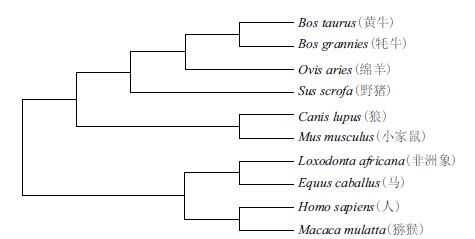
使用MegAlign软件进行同源性分析(图 9)发现,牦牛CAPN3基因编码蛋白与其他物种CAPN3基因编码蛋白具有很高的同源性,均在90%以上。使用MEGA5.1中的NJ法构建CAPN3基因的系统发育树,结果(图 10)表明,牦牛与黄牛、绵羊和猪在系统发育树种距离较近,这与动物学分类一致。
|
| 图 9 不同物种CAPN3蛋白氨基酸序列同源性比较 |
|
| 图 10 CAPN3基因的系统发育树 |
CAPN3基因在所检测牦牛的心脏、肝脏、脾脏、肺脏、肾脏、胰脏、背最长肌组织中均有表达,而背最长肌、胰脏中的表达高于其他组织(图 11)。
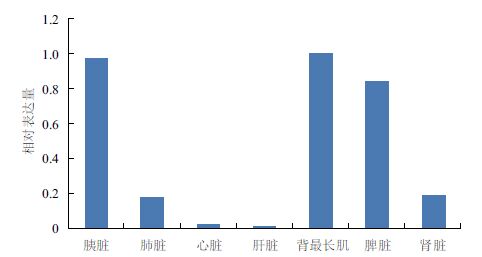
|
| 图 11 牦牛CAPN3基因在不同组织中的表达量 |
CAPN3作为影响肉质性状的候选基因,近年来得到了越来越广泛的重视,CAPN3 可通过自溶降解肌联蛋白和伴肌动蛋白,在宰后肉的嫩化中扮演重要角色[6]。本研究采用RT-PCR技术,克隆获得CDs区长2 469 bp,其编码822个氨基酸,其编码的蛋白质为亲水性蛋白质,说明该蛋白为水溶性蛋白。亚细胞定位推断牦牛CAPN3基因编码蛋白可能主要在细胞质和细胞核中发挥生物学作用。磷酸化是一种重要的蛋白质翻译后修饰,蛋白磷酸化与多种生物学过程密切相关[14],该蛋白有35个磷酸化位点,可推测CAPN3在行使生理化功能前或者与其他蛋白互作时可能需要磷酸化的活化。二硫键可以使不同区域的氨基酸靠拢并形成稳定的空间拓扑结构,同时疏水氨基酸残基围绕着二硫键可形成局部疏水中心,利于形成稳定的高级结构域[15],这对CAPN3蛋白功能的发挥可以产生重要的影响。在一定的生理条件下,氨基酸序列决定了它的二级结构和空间构象。牦牛CAPN3蛋白由35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角组成,不同的二级结构元件构成了CAPN3蛋白特定的高级结构,进而可以行使特定的生理生化功能。牦牛与黄牛、绵羊和猪在系统发育树种距离最近,这与Walder等[16]研究结果相似。
据Kinbara等[17]报道,CAPN3在成年动物中几乎只在骨骼肌中表达,而Missa等[11]用免疫印迹法分析小鼠的不同器官(骨骼肌、心脏、肝脏、子宫、肾脏、小肠和肺脏)CAPN3的表达量,发现其在骨骼肌中的表达是受限的[18]。张增荣等[19]研究山地乌骨鸡和商品鸡CAPN3基因在不同组织中的表达,发现CAPN3基因在胸肌和腿肌中的表达量最高,且CAPN3基因在10周龄商品鸡中所有组织的表达量高于10周龄的山地乌骨鸡。刘博洋等[20]研究发现草原红牛脾脏中的CAPN3基因表达量显著高于其他组织。本研究采用实时荧光定量PCR方法对牦牛不同组织中CAPN3基因表达水平差异进行检测,结果显示,CAPN3基因在所检测牦牛的心脏、肝脏、脾脏、肾脏、胰脏及背最长肌7种组织中均有表达,不同组织中表达水平不同。本研究发现所检测的牦牛的各组织中,胰脏、背最长肌中的CAPN3基因表达量显著高于其他组织。因此,背最长肌中CAPN3基因表达量显著高于其他组织,为改良牦牛肉的嫩度提供了理论依据。
4 结论牦牛CAPN3基因的CDs区长2 469 bp,其编码822个氨基酸,其编码的蛋白质为亲水性蛋白质,说明该蛋白为水溶性蛋白。牦牛CAPN3蛋白由35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角组成,不同的二级结构元件构成了CAPN3蛋白特定的高级结构,进而可以行使特定的生理生化功能。结果显示,所检测的牦牛的各组织中,胰脏、背最长肌中的CAPN3基因表达量显著高于其他组织。
| [1] | 阎萍. 牦牛遗传资源保护及综合开发利用[J]. 畜牧与兽医, 2005, 37(4):21-22. |
| [2] | 邱莫寒, 鲜凌瑾, 张平. 钙蛋白酶系统基因的研究进展[J]. 安徽农业科学, 2009, 37(28):13628-13631. |
| [3] | Nakajima T, Fukiage C, Azuma M, et al. Different expression patte-rns for ubiquitous calpains and CAPN3 splice variants in monkey ocular tissues[J]. Biochimica Biophysica Acta, 2001, 15(19):55-64. |
| [4] | Lian MA, Bekhit AED, Stevenson B, et al. Up and down regulation of longissimus tenderness parallels changes in the myofibril bound calpain 3 protein[J]. Meat Science, 2004, 67(5):433-455. |
| [5] | 朱文奇, 徐文娟, 束婧婷, 等. 鸭骨骼肌早期发育过程中钙蛋白酶3(CAPN3)基因的表达及其与肌纤维性状的关联[J]. 畜牧兽医学报, 2014, 45(3):385-390. |
| [6] | 侯冠彧, 曾鸿普, 王东劲, 等. 钙蛋白酶3(CAPN3)基因多态性与牛胴体性状的关联分析[J]. 畜牧兽医学报, 2010, 41(4):398-402. |
| [7] | Kimberly A, Huebsche K, Christine MW. Mdmmuscular dystrophy:interactions with calpain 3 and a novel functional role for N2A domain[J]. Human Mole Genet, 2005, 19(14):2801-2811. |
| [8] | 金鑫, 张立春, 任春宇, 等. 延边黄牛CAPN3基因多态性与氨基酸含量关系研究[J]. 安徽农业科学, 2010, 38(7):3485-3487. |
| [9] | Blzquez L, Azpitarte M, Senz A, et al. Characterization of calpain l3 transcripts in mammalian cells:expression of alternatively-spliced variants in non-muscle cell types[J]. Neurogenetics, 2008, 9(3):173-282. |
| [10] | Geesink GH, Taylor RG, Koohmaraie M. Calpain 3/p94 is not involved in postmortem proteolysis[J]. J Anim Sci, 2005, 83(7):1646-1652. |
| [11] | Todorva A, Georgieva B, Tournev I, et al. A large deletion and novel point mutations in the calpain 3(CAPN3)in Bulgarian LGMD2A patients[J]. Neurogenetics, 2007, 8(5):225-229. |
| [12] | FelicioAM, Boschiero C, Balieiro JCC, et al. Identification and association of polymorphisms in CAPN1 and CAPN3 candidate genes related to performance and meat quality traits in chickens[J]. Genetics and Molecular Research, 2013, 12(1):47-482. |
| [13] | 姚慧, 陈智华, 钟金城, 等. CAPN1和CAST基因在牦牛不同组织中表达差异研究[J]. 河南农业科学, 2014, 43(3):139-140. |
| [14] | Nascimbeni AC, Fanin MTasca E, Angelini C. Transcriptional and translational effects of intronic CAPN3 gene mutations[J]. Human Mutation, 2010, 31(9):1658-1669. |
| [15] | Gandolfi G, Pomponio L, Ertbjerg P, et al. Investigation on CAST, CAPN1 and CAPN3 porcine gene polymorphism and expression in relation to post-mortem calpain activity in muscle and meat quality[J]. Meat Science, 2011, 88(7):694-700. |
| [16] | Walder K, McMillan J, Lapsys N, et al. Calpain 3 gene expression in skeletal muscle is associated with body fat content and measures of insulin resistance-DRO[J]. Nature Publishing Group, 2002, 26(4):442-449. |
| [17] | Kinbara K, Sorimachi H, Ishiura S, et al. Skeletal musclespecific calpain, p94[J]. Biochem Pharmacol, 1998, 56(9):415-420. |
| [18] | Krahn M, Lopez de Munain A, Streichenberger N, et al. CAPN3 mutations in patients with idiopathic eosinophilic myositis[J]. Ann Neurol, 2006, 59(5):905-911. |
| [19] | 张增荣, 朱庆, 蒋小松, 等. 鸡CAPN3基因表达特异性研究[J]. 畜牧兽医科学, 2011, 24(5):622-624. |
| [20] | 刘博洋, 秦立红, 廉传江, 等. CAPN3基因在草原红牛不同组织中的表达差异[J]. 中国畜牧兽医, 2010, 37(10):105-107. |





