2.中国农业科学院蚕业研究所,镇江 212018
2. Sericultural Research Institute,Chinese Academy of Agricultural,Zhenjiang 212018
近年来,我国畜牧业正全面向规模化、自动化发展,生猪规模化养殖也越来越多,在统一管理、饲养带来优势的同时,生猪发生重大疫病所带来的危害也不断增大,其中病毒类疾病就是较为严重的一类,常常会在整个养猪场迅速传播而造成重大经济损失,因此研制可以广泛用于畜牧养殖业中的高效抗病毒类药物意义重大。干扰素(Interferon,IFN)是一类在细胞中广泛存在的应对病毒感染的蛋白家族,1957年,Isaacs在用鸡胚绒毛尿囊膜研究流感干扰现象时发现被感染细胞产生了一种影响其它细胞从而干扰病毒感染复制的因子,并将其命名为干扰素[1],干扰素具有广谱的抗病毒、肿瘤和免疫调节的作用[2],可以被开发用于畜牧养殖业的抗病毒药物。干扰素一般被分为3个类型:I型干扰素包括IFN-α、IFN-β、IFN-δ等[3],Ⅱ型干扰素只有IFN-γ一种[4],Ⅲ型干扰素包括IFN-λ1(IL-29)、IFN-λ2(IL-28A)、IFN-λ3(IL-28B)、IFN-λ4[5, 6]。猪γ干扰素(Porcine interferon γ,PoIFNγ)作为II型干扰素,其在猪体内的作用同I型干扰素不同,与α干扰素之间属于协同作用,对多种病毒性疾病具有治疗效果,如在抑制口蹄疫病毒、猪繁殖与呼吸综合征病毒和非洲猪瘟的实验中有较好的效果。猪γ干扰素基因在猪的基因组中只有一条(GenBank:GU433229.1),基因全长501 bp,共编码166个氨基酸,其中前23个氨基酸是信号肽序列,后143个氨基酸未成熟的蛋白活性序列,其天然活性状态为同源二聚体糖蛋白[7, 8]。目前PoIFNγ已经在许多表达体系中进行了表达。
BmBacmid家蚕杆状病毒表达系统是我们结合常用的Bac-to-Bac、BacPAK6和flashBAC杆状病毒表达系统的特点在BmNPV的基础上构建的一种新型重组病毒构建和外源基因表达系统[9]。该系统可以在大肠杆菌中进行基因操作和大量制备,在共转染过程中可以批量制备重组病毒,共转染获得的重组病毒纯合率几乎达到100%,适于快速构建重组病毒和表达外源蛋白。
基于关于猪干扰素抗病毒研究的现状,本研究根据公布的猪γ干扰素基因序列以及家蚕杆状病毒表达系统的应用,构建含有干扰素基因的重组家蚕杆状病毒并在家蚕生物反应器中进行表达,以期获得大量具有抗病毒生物活性的猪γ干扰素以及初步建立干扰素快速表达的方法。
1 材料与方法 1.1 材料 1.1.1 主要试剂和酶类限制性内切酶、T4 DNA连接酶购自Promega,PoIFNγ抗体(兔单抗)购自Millipore,HRP标记的山羊抗兔IgG购自MBL,TC100培养基购自Applichem,DMEM(高糖)培养基、FBS购自Gibco,脂质体购自Invitrogen。
1.1.2 质粒、细胞和病毒杆状病毒转移载体pVL1393购自Invitrogen,BmBacmid缺陷型杆粒、VSV-GFP病毒(表达绿色荧光蛋白的重组水泡性口炎病毒)由本实验室保存,大肠杆菌Top10、BmN细胞系、VERO细胞等为本实验室保存。
1.2 方法 1.2.1 猪γ干扰素基因的获得PoIFNγ的基因序列只有一条,为了更好地在我们选用的家蚕杆状病毒表达系统中进行表达,根据家蚕生物个体内的密码子编码偏好性对PoIFNγ的基因序列进行优化,保持氨基酸序列不变,同时优化基因序列中的GC含量并避开常用的酶切位点以保证克隆的方便进行,优化后在序列的5'端加上BamH I酶切位点序列和Kozak序列,3'端加上终止密码子和EcoR I酶切位点序列,设计完成交由南京金斯瑞公司进行合成(优化后的序列见专利,授权号:201210110533.6),合成的基因连接在pUC57-simple载体上,得到含有猪γ干扰素基因的质粒pUC-PoIFNγ。
1.2.2 猪γ干扰素基因插入到转移载体上将pUC-PoIFNγ载体用BamH I-EcoR I双酶切,琼脂糖凝胶电泳回收510 bp左右的目的片段,与进行同样酶切处理的pVL1393转移载体用T4 DNA连接酶连接,连接产物转化大肠杆菌Top10感受态细胞,在Amp抗生素的LB平板上培养转化的克隆,利用质粒快速粗提的方法筛选出阳性克隆,提取质粒进行酶切鉴定筛选出连接有相应大小目的片段的克隆,测序鉴定确认PoIFNγ基因连接到转移载体上获得了pVL1393-PG。
1.2.3 家蚕细胞的培养和准备根据Summers的操作手册[10],用含有FBS的TC100昆虫培养基培养家蚕BmN细胞系,达到合适的浓度后接种到六孔板中或者35 mm的细胞培养皿上(1×106 cells/mL)培养8-12 h,用于共转染构建重组病毒。
1.2.4 重组杆状病毒的构建根据失活拯救型BmBacmid构建重组病毒的方法[9],将适量的转移载体pVL1393-PG和纯化的BmBacmid病毒DNA混合后加入脂质体,室温孵育20 min,共转染BmN细胞系,27℃培养4-5 d后待细胞感染发病并剥落后收集共转染上清液,获得重组病毒reBm-PG。
1.2.5 斑筛选高表达重组病毒在35 mm培养皿中种上适量的BmN细胞并在27℃培养12 h,将含有重组病毒的共转染上清液稀释100倍,取10 μL稀释液感染BmN细胞,27℃孵育1 h后将无血清TC100培养基换成含10%血清、1%低熔点凝胶的TC100培养基,27℃培养5-6 d后挑取病毒斑获得单独的毒株,在24孔板中用液体TC100培养的BmN细胞系扩增筛选的病毒,用干扰素基因特异引物鉴定扩增的病毒,最终获得24个reBm-PG的重组病毒毒株。
1.2.6 猪γ干扰素在家蚕中的表达用共转染获得的重组病毒或者斑纯化获得的重组病毒注射感染5龄起家蚕(105 pfu/头),在湿度65%,温度25-27℃条件下培养108-120 h,观察家蚕发病情况并收集含有重组PoIFNγ表达产物的蚕血淋巴,-20℃保存备用。
1.2.7 WesternBlotting检测猪γ干扰素表达 将收集的蚕血淋巴用PBS稀释5倍后超声波破碎,离心去掉细胞碎片,用上清液进行SDS-PAGE后将蛋白转移到PVDF膜上,用3% BSA封闭后依次用抗猪γ干扰素的兔一抗(1∶800稀释)和HRP标记的山羊抗兔二抗(1∶5 000稀释)孵育,最后用ECL发光液显色成像。
1.2.8 猪γ干扰素抗病毒活性检测用微量细胞病变抑制法检测猪γ干扰素的活性[11]。用VSV-GFP病毒感染猪γ干扰素处理过的VERO细胞,通过绿色荧光反映的病毒感染发病情况来检测其抗病毒活性。操作方法如下:在96孔板中接种VERO细胞(2×105-3×105 cells/mL),37℃贴壁培养8-12 h;含有猪γ干扰素的蚕血淋巴超声破碎后离心去除细胞碎片,再用0.2 μm滤膜过滤除菌,用含有FBS的DMEM高糖培养基稀释至不同梯度,分别用100 μL稀释液在96孔板中孵育VERO细胞12 h左右;去除96孔板中每孔中孵育培养基,加入100 μL含有100 TCID50的VSV-GFP病毒的DMEM培养基,37℃侵染1 h;弃掉含有病毒的培养基,换成正常含有FBS的DMEM培养基,在37℃、50 mL/L CO2条件下培养24 h后在倒置荧光显微镜下观察细胞感染情况。
最初的抗病毒活性检测中估算样品稀释梯度,确定一定的范围后设计合适的稀释梯度来计算最准确的抗病毒活性,按照Reed-Muench法计算干扰素的效价。
2 结果 2.1 含有PoIFNγ的转移载体的获得对获得的pVL1393-PoIFNγ质粒进行BamH I-EcoR I双酶切,用1%琼脂糖凝胶电泳检测酶切产物(图 1),9 kb左右片段为pVL1393载体片段,500 bp左右片段为PoIFNγ片段,说明猪γ干扰素成功插入到pVL1393转移载体的MCS序列中,后续的测序进一步验证了该结果。

|
| M:DNA Marker;1:pVL1393-PG酶切(BamH I-EcoR I) 图 1 转移载体质粒pVL1393-PG酶切鉴定 |
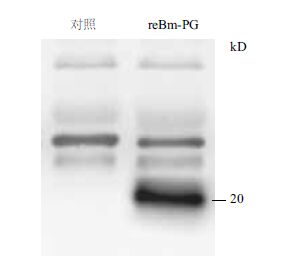
对蚕血淋巴表达样品超声破碎处理后进行Western blotting检测,结果(图 2)显示在20 kD左右特异性杂交条带,大小符合预期,说明利用该家蚕杆状病毒表达系统在家蚕中成功获得了猪γ干扰素的表达。
|
| 对照:WT BmNPV感染的蚕血淋巴;reBm-PG:注射重组病毒并表达有猪γ干扰素的蚕血淋巴 图 2 重组γ干扰素的Western blotting分析 |
在其抑制细胞病变的实验中,首先以干扰素表达产物稀释102-107倍数(10倍递增)确定活性精确测定稀释倍数区间,此区间为104-106之间,再以8×103为最低稀释倍数,2倍递增,精确测定不同稀释梯度的PoIFNγ表达产物处理的VERO细胞抗VSV-GFP病毒感染情况来计算干扰素的抗病毒活性。将VERO细胞用VSV-GFP侵染后的发病情况按照绿色荧光的比例分为4个等级:完全没有感染发病、少量细胞感染并表达绿色荧光蛋白和50%以上的细胞感染病表达绿色荧光蛋白(图 3)。

|
| -:细胞未发病,无绿色荧光;±:少数细胞感染VSV-GFP,并表达绿色荧光蛋白;﹢:超过50%细胞被VSV-GFP感染病表达绿色荧光蛋白 图 3 VERO细胞病变荧光表达情况 -:细胞未发病,无绿色荧光;±:少数细胞感染VSV-GFP,并表达绿色荧光蛋白;﹢:超过50%细胞被VSV-GFP感染病表达绿色荧光蛋白 |
根据在表 1中记录的细胞感染发病情况计算,在蚕血淋巴中表达的PoIFNγ抗病毒效价可以达到6×105 IU/mL。通多对斑纯化筛选得到的24个重组病毒株在家蚕中表达产物的抗病毒活性检测可以得到活性提高2-3倍的产物。
猪γ干扰素在天然状态下是同源二聚体的结构,在这个结构下才有活性。人们开始用大肠杆菌等原核表达系统表达这种干扰素时,产物基本无活性,通过对产物的变性再复性后才能检测到抗病毒效力[7]。后来人们陆续在毕赤酵母[12, 13]、哺乳动物细胞[14]和AcNPV杆状病毒表达系统[15]进行了猪γ干扰素的表达。毕赤酵母中表达产物纯化后抗病毒活性可达1.67×106 IU/mg,相当于产物原液表达量约为2×105 IU/mL,本研究获得的初步表达产物抗病毒活性可以达到5×105 IU/mL,有所提高。
杆状病毒表达系统作为真核表达系统,适于真核来源的外源蛋白的表达,能够形成正确的折叠和后期修饰,包括糖苷化、脂肪酸酰基化、乙酰化等,最大程度的保证表达的重组蛋白可以成为天然状态具有生物活性[16]。家蚕杆状病毒表达系统作为杆状病毒表达系统的一种也具有以上优点,另外在家蚕中还存在特有的N端糖基化过程,更加有利于外源基因的表达[17]。有研究报道称杆状病毒可以在哺乳动物细胞上诱导引发基础免疫[18],这一点使得利用该系统表达的重组PoIFNγ在抗病毒时受到协同促进作用,更加有利于抗病毒应用。在我国家蚕可以大规模饲养,并且生产周期短、生物安全性高、生产成本低。因此,使用重组杆状病毒在家蚕体内表达猪γ干扰素是一个很好的选择。
本研究中Western blotting结果验证了干扰素的表达,以野生BmNPV病毒感染家蚕的表达产物为对照,重组病毒感染表达产物中检测到了干扰素特异性的条带,大小与预期一致。而抗病毒活性检测中则进一步验证了表达出的干扰素是有高抗病毒活性的,同已报道的表达情况相比,目前该基因在我们系统中的表达可以达到较高的水平,较大肠杆菌和酵母表达系统高,可以达到甚至超过AcNPV-cells表达系统的表达量,并且成本更低。细胞病变抑制法中用GFP报告基因监测VSV病毒感染的情况使得抗病毒活性检测更加方便、灵敏、准确。
根据干扰素在生物体内的作用,可以开发为病毒类疾病的治疗制剂和疫苗注射时的免疫增强剂等,猪α干扰素在家蚕中的表达已经成功,并且具有抗病毒生物活性[19],如果将两种干扰素联合应用,应该会提高抗病毒活性。本研究利用病毒复制缺陷型杆粒快速构建了重组病毒并实现了干扰素在家蚕中的表达,为进一步开发生产相应的畜牧养殖业免疫和治疗药剂提供了条件。下一步实验将会针对表达产物的纯化和保存以及剂型等方面的内容进行相应的研究,并且需要将表达方法和毒种稳定的方法确定下来,以更利于之后的相关应用研究。
4 结论本研究成功利用BmBacmid系统构建了含有猪γ干扰素的重组家蚕杆状病毒reBm-PG,并在家蚕生物反应器中进行表达,根据免疫印迹和抗病毒检测结果,猪γ干扰素在家蚕中有表达并且表达产物具有较高的抗病毒活性。
| [1] | Isaacs A, Lindenmann J. Virus interference. I. The interferon[J]. Proceedings of the Royal Society of London. Series B:Biological Sciences, 1957, 147(927):258-267. |
| [2] | Gresser I. Interferon:an unfolding tale[J]. Journal of Interferon & Cytokine Research, 2007, 27(6):447-452. |
| [3] | Levy DE, Marie IJ, Durbin JE. Induction and function of type I and III interferon in response to viral infection[J]. Current Opinion in Virology, 2011, 1(6):476-486. |
| [4] | Pestka S, Krause CD, Walter MR. Interferons, interferon-like cytokines, and their receptors[J]. Immunological Reviews, 2004, 202:8-32. |
| [5] | Kotenko SV. IFN-lambdas[J]. Current Opinion in Immunology, 2011, 23(5):583-590. |
| [6] | Prokunina-Olsson L, Muchmore B, Tang W, et al. A variant upstream of IFNL3(IL28B)creating a new interferon gene IFNL4 is associated with impaired clearance of hepatitis C virus[J]. Nature Genetics, 2013, 45(2):164-171. |
| [7] | Farrar MA, Schreiber RD. The molecular cell biology of interferon-gamma and its receptor[J]. Annual Review of Immunology, 1993, 11:571-611. |
| [8] | Vandenbroeck K, Dijkmans R, van Aerschot A, et al. Engineering by PCR-based exon amplification of the genomic porcine interferon-gamma DNA for expression in Escherichia coli[J]. Biochem Biophys Res Communs, 1991, 180(3):1408-1415. |
| [9] | 张志芳, 李轶女, 易咏竹, 等. 表达多外源基因的昆虫生物反应器及其构建方法和应用. 中国:CN102286534A[P]. 2011. |
| [10] | Summers M, Smith GE. A manual of methods for baculovirus vectors and insect cell culture procedures[J]. Texas Agricultural Experiment Station College Station, TX, 1987. |
| [11] | Ge J, Wen Z, Wang X, et al. Generating vesicular stomatitis virus pseudotype bearing the severe acute respiratory syndrome coronavirus spike envelope glycoprotein for rapid and safe neutralization test or cell-entry assay[J]. Annals of the New York Academy of Sciences, 2006, 1081:246-248. |
| [12] | 万建青, 吴文学, 夏春. 毕赤酵母表达猪干扰素-γ基因及其抑制蓝耳病病毒效果[J]. 生物工程学报, 2002, 18(6):683-686. |
| [13] | 姚清侠, 黄勤锋, 曹毅, 等. 猪γ-干扰素在毕赤酵母中的分泌表达及其抗病毒作用[J]. 中国兽医学报, 2008(4):451-455. |
| [14] | 姚清侠, 刘新文, 钱平, 等. 携带猪γ干扰素基因逆转录病毒载体的构建及其在猪肾细胞(PK-15)中的表达[J]. 微生物学报, 2007(1):141-144. |
| [15] | 秦立廷, 王喜军, 胡森, 等. 猪γ-干扰素在重组杆状病毒中的表达及其抗病毒活性的测定[J]. 生物工程学报, 2007, 23(3):386-391. |
| [16] | Jarvis DL. Baculovirus-insect cell expression systems[J]. Methods in Enzymology, 2009, 463:191-222. |
| [17] | Dojima T, Nishina T, Kato T, et al. Comparison of the N-linked glycosylation of human beta1, 3-N-acetylglucosaminyltransferase 2 expressed in insect cells and silkworm larvae[J]. Journal of Biotechnology, 2009, 143(1):27-33. |
| [18] | Ono C, Ninomiya A, Yamamoto S, et al. Innate immune response induced by baculovirus attenuates transgene expression in mammalian cells[J]. J Virol, 2014, 88(4):2157-2167. |
| [19] | 钟鲁龙, 易咏竹, 丁农, 等. 猪α干扰素在家蚕中表达及其抗病毒活性测定[J]. 生物技术进展, 2013(4):252-256, 228. |





