2.西安交通大学生命科学与技术学院,西安 710000
2. College of Life Science and Technology,Xi’an Jiaotong University,Xi’an 710000
荒漠肉苁蓉(Cistanche deserticola Y.C.Ma)又称肉苁蓉,为列当科肉苁蓉属沙生植物,主要寄生在梭梭、红柳等荒漠植物根部,其主要成分包括多糖、苯乙醇苷类化合物、有机酸、生物碱等[1],其中多糖含量较高具有抗氧化、抗病毒等调节免疫系统多种功能;苯乙醇苷类化合物具有抗肿瘤、抗衰老等多种功能[2, 3],其含量被定为评定肉苁蓉药理学活性的重要指标[4]。由于肉苁蓉极高的药用价值[5],野生肉苁蓉过度开采濒临灭绝,鉴于此人工栽培肉苁蓉已经在新疆大面积成功种植[6]。虽然国内外学者对肉苁蓉的化学成分、有效成分的分离、纯化及药理作用的研究、抗衰老活性成分、食品保健等诸多方面做了大量研究,但对肉苁蓉提取物的免疫活性研究较少,尤其是比较野生与栽培荒漠肉苁蓉提取物免疫活性的研究还未见报道。
树突状细胞(Dendritic cells,DCs)是目前功能最强的专职性抗原提呈细胞,在诱导免疫应答过程中起着重要作用,其成熟状态决定机体免疫调节的方向,DCs由未成熟转向成熟,细胞表面共刺激分子高表达[7],同时迁移到淋巴结诱导抗原特异性T细胞增殖,激活免疫应答[8, 9],因此,对DCs的研究为天然产物调节免疫功能提供了新的视角。
本实验以新疆野生及栽培荒漠肉苁蓉为原材料,利用超声结合水提醇沉法[10],经Sevag试剂除蛋白[11]制备水提物和超声辅助制备醇提物,水提物中主要活性分成为多糖,蒽酮硫酸法[12]测定多糖含量;醇提物中主要的活性成分为苯乙醇苷类化合物,Al(NO3)3-NaNO2-NaOH显色体系[13]测定苯乙醇苷类化合物含量,并通过脚掌免疫BALB/c小鼠,流式细胞术检测提取物对BALB/c小鼠体内DCs成熟的影响,初步评价新疆野生及栽培荒漠肉苁蓉提取物的免疫活性,旨在为更好地开发利用新疆栽培荒漠肉苁蓉提供参考,也为利用新疆药用植物筛选新型疫苗佐剂奠定基础。
1 材料与方法 1.1 材料 1.1.1 材料5-6周雌性BALB/c小鼠购自新疆医科大学动物中心。新疆野生和栽培荒漠肉苁蓉(市售)。
1.1.2 试剂石油醚、三氯甲烷、正丁醇、蒽酮、葡萄糖、松果菊苷等均为分析纯,流式抗体:PE-CD11c、APC-CD86/FITC- MHCII购自美国BD公司,其它试剂均为进口或国产分析纯。
1.1.3 仪器721型全波长分光光度计:上海第三分析仪器厂;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;78-1磁力加热搅拌器:金坛市医疗仪器厂;A L204电子天平:梅特勒一托利多仪器有限公司,精度0.1 mg;流式细胞仪:美国BD公司。
1.2 方法 1.2.1 新疆野生及栽培荒漠肉苁蓉水提物的制备水提物的制备采用超声结合水提醇沉的方法。步骤如下:取新疆野生及栽培荒漠肉苁蓉粉末,加入10倍体积的石油醚超声辅助脱脂;加入10倍体积无水乙醇超声辅助脱色;加入10倍体积蒸馏水37℃超声两次,4 000 r/min离心10 min,合并上清,真空旋蒸浓缩;加入4倍体积的无水乙醇,4℃过夜醇沉;真空抽滤烘干,得粗提物粉末;加入100倍体积蒸馏水磁力搅拌器使其充分溶解,加入Sevag试剂(氯仿∶正丁醇=4∶1)除蛋白,4 000 r/min离心10 min,重复多次,直到无乳白色变性蛋白吸出为止,收集上清,真空旋蒸浓缩,以同样的方法醇沉,即得新疆野生及栽培疆荒漠肉苁蓉水提物。
1.2.2 新疆野生及栽培荒漠肉苁蓉醇提物的制备醇提物的制备选择超声醇提法制备。步骤如下:新疆野生及栽培荒漠肉苁蓉粉末,以相同条件用石油醚脱脂后烘干,加入80%乙醇(料液比为1∶10),真空旋蒸,65℃烘干得到醇提物,助溶剂(Tween-20∶0.9% NaCl=1∶9)(V/V)溶解醇提物。
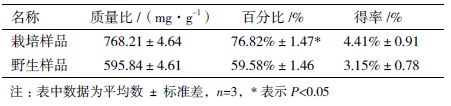
1.2.3 新疆野生及栽培荒漠肉苁蓉水提物多糖含量测定采用蒽酮-硫酸法检测水提物中多糖含量。步骤如下:以葡萄糖为标准品绘制标准曲线,精密称取葡糖糖用蒸馏水溶解,浓度调整为0.5 mg/mL,分别加入上述溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mL,再加入8 mL 0.2%蒽酮-硫酸溶液,沸水浴10 min,检测OD625 nm值,得回归方程:A=0.8022C+0.0632,r=0.9954。样品以相同方式处理,根据标准曲线方程计算多糖含量及得率:
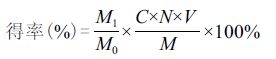
其中,M1代表样品经过脱脂、脱色、水提浓缩、醇沉后的质量(g),M0代表提取前样品的质量(g),C代表样品中多糖含量(mg/mL),N代表样品稀释倍数,V代表样品体积(mL),M代表含量测定时样品的质量(g)。
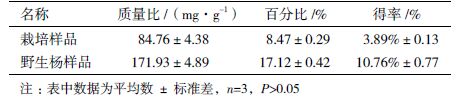
1.2.4 新疆野生及栽培荒漠肉苁蓉醇提物中苯乙醇苷类化合物含量测定采用Al(NO3)3-NaNO2-NaOH显示体系检测醇提物中苯乙醇苷类化合物含量。步骤如下:以松果菊苷为标准品绘制标准曲线,甲醇溶液溶解松果菊苷,将浓度调整为0.43 mg/mL,等比列稀释标准品,分别加入上述溶液0、20、40、60、80、100、120、140、160、180和200 μL,加入100 μL 5%硝酸钠溶液,室温静置6 min,加入10%硝酸铝静置6 min,加入10%氢氧化钠静置18 min,检测OD510 nm值,得回归方程:A=0.0759C+0.0436,r= 0.9968。以同样的方式处理样品,根据标准曲线方程计算苯乙醇苷类化合物含量及得率:
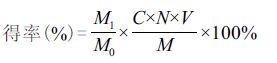
其中,M1代表经过脱脂、醇提浓缩后的质量(g),M0代表提取前样品的质量(g),C代表待测样中苯乙醇苷类化合物含量(mg/mL),N代表样品的稀释倍数,M代表含量测定样品的质量(g)。
1.2.5 动物分组及免疫野生荒漠肉苁蓉水提物(Aqueous extracts of wild C. deserticola,AEWCD)、栽培荒漠肉苁蓉水提物(Aqueous extracts of cultivated C. deserticola,AECCD)、野生醇提物(Ethanol extract of wild C. deserticola,EEWCD)、栽培醇提物(Ethanol extract of cultivated C.deserticola,EECCD)分别选用50 μg和200 μg两个剂量免疫小鼠。随机将BALB/c小鼠分成11组:阴性对照组(0.9% NaCl、Tween-20)、阳性对照组(LPS 100 ng)、AEWCD 50 μg、AEWCD 200 μg、AECCD 50 μg、AECCD 200 μg、EEWCD 50 μg、EEWCD 200 μg、EECCD 50 μg和EECCD 200 μg实验组,每组6只,脚掌免疫小鼠,每只50 μL。
1.2.6 流式细胞术检测新疆野生及栽培荒漠肉苁蓉水提物及醇提物对小鼠DCs的影响 脚掌免疫小鼠36 h后,取腿窝及腹股沟淋巴结制备单细胞悬液,将细胞数调整为1×106 cells,进行CD11c+DCs表面CD86/MHCII染色,室温避光20 min,用10 mL含0.5%胎牛血清的磷酸缓冲溶液(Phosphate Buffered Saline,PBS)1 200 r/min 7 min洗一次,加入300 μL PBS,过200目铜网,流式细胞术检测CD11c+DCs表面CD86/MHCII表达情况。 1.2.7 统计学分析采用FlowJo 7.6 软件处理流式细胞术检测结果,GraphPad Prism 5.0进行分析,计量数据均采用平均数±标准差,数据进行单因素方差分析和多组均数间比较,差异显著标准为P<0.05。
2 结果 2.1 新疆野生及栽培荒漠肉苁蓉水提物中多糖含量葡萄糖标准曲线回归方程为A=0.8022C+0.0632,r=0.995 4,表明葡萄糖含量在0.05-0.5 mg/mL范围内线性关系良好。根据回归方程计算野生及栽培荒漠肉苁蓉中多糖含量及得率。结果(表 1)显示,野生荒漠肉苁蓉水提物中多糖含量为59.58%,栽培荒漠肉苁蓉水提物中多糖含量为76.82%,两者间差异显著(P<0.05)。
松果菊苷标准曲线回归方程为A=0.0759C+0.0436,r=0.9968,说明松果菊苷在0.043-0.43 mg/mL范围内线性关系良好。根据回归方程计算得出野生及栽培荒漠肉苁蓉醇提物中苯乙醇苷类化合物含量及得率。结果(表 2)显示,野生荒漠肉苁蓉醇提物中的苯乙醇苷类化合物含量为17.12%,栽培荒漠肉苁蓉醇提物中的苯乙醇苷类化合物含量为8.47%,两者之间无显著差异(P>0.05)。
野生及栽培荒漠肉苁蓉水提物不同剂量,脚掌免疫小鼠36 h后取腿窝及腹股沟淋巴结,流式细胞术检测结果(图 1)表明,随着水提物浓度越高,促进CD11c+DCs表面MHCII及CD86的表达能力越强;低剂量和高剂量组与对照相比差异极显著(P<0.01),高剂量组优于阳性对照LPS组,且差异显著(P<0.05);野生及栽培水提物相同剂量之间没有显著差异(P>0.05);说明野生及栽培荒漠肉苁蓉水提物能显著促进DCs成熟。
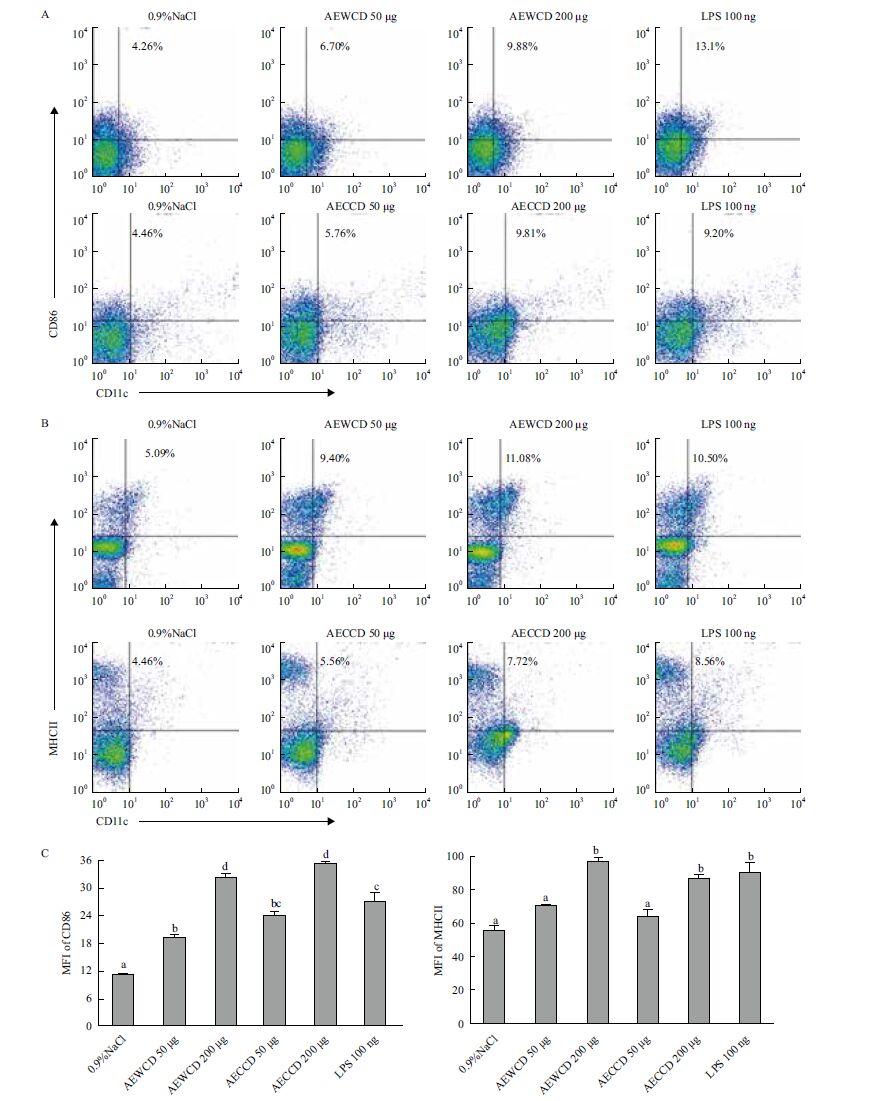
|
| AEWCD/AECCD脚掌免疫BALB/c小鼠36 h后,取腿窝和腹股沟淋巴结,流式细胞术检测CD11c+DCs表面分子CD86和MHCII表达情况(n=6);A:DCs表面CD86表达情况;B:DCs表面MHCII的表达情况;C:DCs表面CD86及MHCII平均荧光强度(Mean fluorescence intensity,MFI)检测结果(Mean±SEM)。不同字母表示各组间差异显著(P<0.05) 图 1 AEWCD/AECCD促进小鼠体内DCs成熟 |
野生及栽培荒漠肉苁蓉醇提物不同剂量,脚掌免疫小鼠36 h后取腿窝及腹股沟淋巴结,流式细胞术检测结果(图 2)表明,低剂量组与对照相比无显著差异(P>0.05),高剂量组可显著促进CD11c+DCs表面MHCII的表达(P<0.01),与阳性对照LPS组效果相当(P>0.05),且野生和栽培醇提物之间无显著差异(P>0.05);低剂量和高剂量组与对照相比都显著促进CD86分子的表达(P<0.01),野生及栽培醇提物高剂量组间差异显著(P<0.05)。说明野生及栽培荒漠肉苁蓉醇提物显著促进DCs成熟。
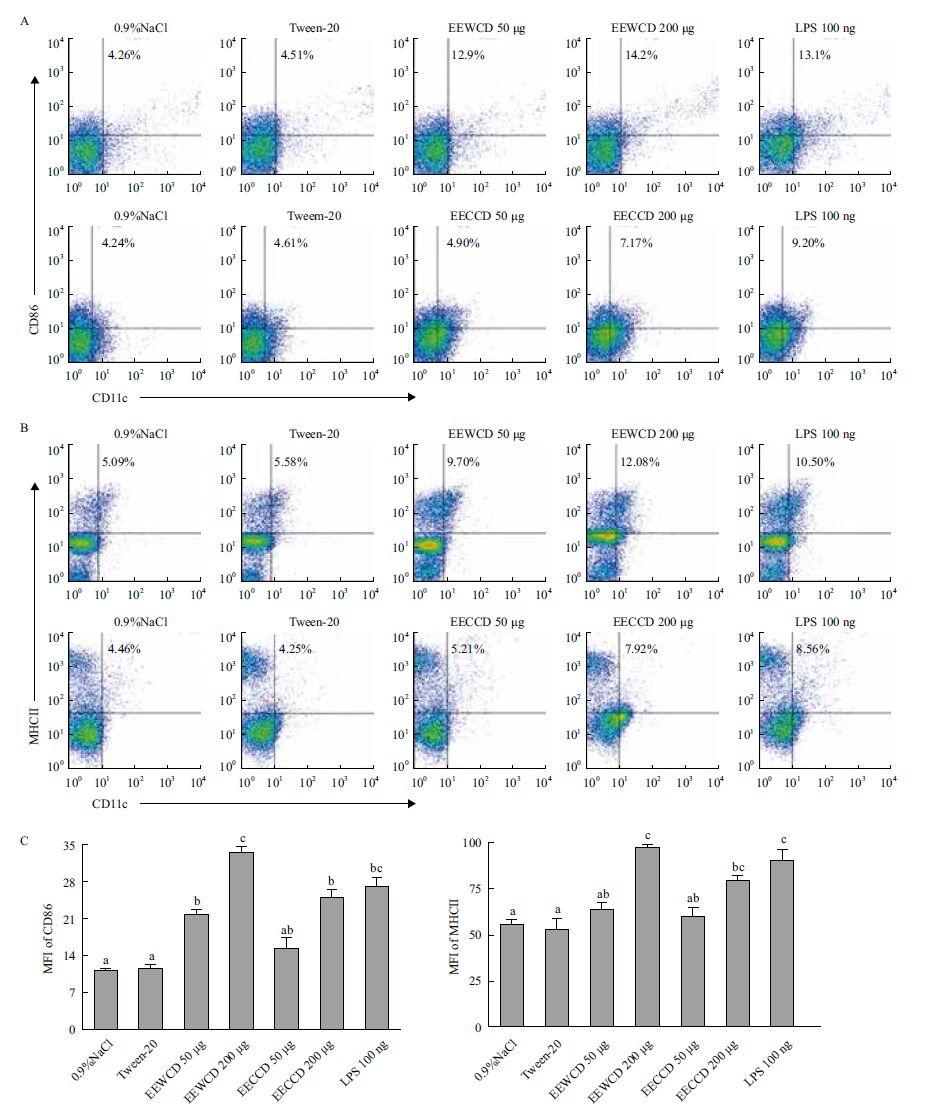
|
| EEWCD/EECCD脚掌免疫BALB/c小鼠36 h后,取腿窝和腹股沟淋巴结,流式细胞术检测体内DCs表面CD86及MHCII的MFI(n=6),A:DCs表面CD86表达情况;B:DCs表面MHCII表达情况;C:DCs表面CD86及MHCII的MFI检测结果(Mean±SEM)。不同字母表示各组间差异显著(P<0.05) 图 2 EEWCD/EECCD促进体内DCs成熟 EEWCD/EECCD脚掌免疫BALB/c小鼠36 h后,取腿窝和腹股沟淋巴结,流式细胞术检测体内DCs表面CD86及MHCII的MFI(n=6),A:DCs表面CD86表达情况;B:DCs表面MHCII表达情况;C:DCs表面CD86及MHCII的MFI检测结果(Mean±SEM)。不同字母表示各组间差异显著(P<0.05) |
中草药有效成分对机体存在着普遍的免疫调节作用,如人参、肉苁蓉、枸杞、黄芪等都可以综合性地提高机体免疫力,研究者发现中药中的多糖、黄酮、皂苷、凝集素等成分对机体具有一定的免疫增强作用,而对正常细胞没有毒副作用,因此,从中草药中寻找有免疫活性成分成为研究的热点。大量研究表明:中草药提取物能促进DCs成熟[14, 15]、增强巨噬细胞的吞噬作用[16, 17]、促进淋巴细胞增殖[18]、细胞因子的分泌[19]、具有抗肿瘤[20, 21]、抗病毒[22]、抗炎[23]等功能,从而起到调节免疫系统的作用。肉苁蓉是我国名贵中草药,其多糖和苯乙醇苷类化合物具有调节免疫、抗病毒、抗衰老等作用而引起关注。
由于DCs在诱导免疫应答过程中的重要作用,本研究利用DCs作为肉苁蓉提取物免疫活性的检测平台,比较新疆野生及栽培荒漠肉苁蓉的免疫活性,检测水提物及醇提物对BALB/c小鼠淋巴系DCs的影响。结果表明,水提物及醇提物均可显著促进DCs成熟。这与之前Li[24]和Kim[25]的关于植物多糖能显著促进DCs成熟的报道基本一致;李暖等[26]关于苯乙醇苷类化合物中的松果菊苷能显著增强DCs成熟的结论一致;相同剂量野生与栽培荒漠肉苁蓉提取物促进DCs成熟差异不大,虽然野生与栽培肉苁蓉提取物中多糖含量与苯乙醇苷类化合物含量存在一定的差异:即200 μg野生与栽培水提物中多糖约为119 μg(200×59.58%)和153 μg(200×76.82%),栽培肉苁蓉中多糖含量较高,但不影响其对DCs的作用,153 μg栽培多糖与119 μg野生多糖效果作用DCs效果相当;200 μg野生及栽培醇提物中苯乙醇苷类化合物约为34.24 μg(200×17.12%)和16.94 μg(200×8.47%),野生肉苁蓉中苯乙醇苷类化合物含量较高,但对DCs作用只有CD86的表达存在一定差异,MHCII的表达无显著差异,说明野生与栽培醇提物相比激活T细胞的能力较强,递呈抗原的能力相当。综上所述野生与栽培肉苁蓉对DCs作用相当,在后续研究中可用栽培替代野生荒漠肉苁蓉,进一步验证新疆栽培荒漠肉苁蓉在免疫学方面的运用前景,为从新疆药用植物资源中筛选新的免疫活性物质奠定基础。
4 结论通过超声结合水提醇沉法制备水提物,野生及栽培新疆荒漠肉苁蓉多糖含量分别为59.58%和76.82%;利用超声醇提得新疆野生及栽培荒漠肉苁蓉苯乙醇苷类化合物含量分别为17.12%和8.47%。结果表明,新疆野生和栽培荒漠肉苁蓉主要成分之间存在一定差异。免疫小鼠后,流式细胞术检测结果表明,野生和栽培荒漠肉苁蓉提取物可显著增强小鼠体内CD11c+DCs表面CD86和MHCII上调表达,且效果与阳性对照组LPS相当,相同剂量的水提物之间差异不显著。同一剂量野生及栽培荒漠肉苁蓉醇提物上调CD11c+DCs表面MHCII之间差异不显著,但CD86的表达存在一定差异。说明新疆野生荒漠肉苁蓉提取物在适宜剂量范围与栽培提取物的一定剂量范围对BALB/c小鼠体内DCs作用效果相当。
| [1] | 李媛, 宋媛媛, 张洪泉. 肉苁蓉的化学成分及药理作用研究进展[J]. 中国野生植物资源, 2010, 1(29):7-11. |
| [2] | Encalada MA, Rehecho S, Ansorena D, et al. Antiproliferative effect of phenylethanoid glycosides from Verbena officinalis L. on Colon Cancer Cell Lines[J]. LWT-Food Science and Technology, 2015, 2(63):1016-1022. |
| [3] | Li L, Wang X, Wang X. Antilipid peroxidation and antiradiative action of glycosides in herba Cistanches[J]. China journal of Chinese Materia Medica, 1997, 22(6):364-367. |
| [4] | 张思巨, 刘丽. 肉苁蓉药材质量标准的研究[J]. 中国中药杂志, 2000, 25(6):359-361. |
| [5] | 中国药典[M]. 第9版. 中国医药科技出版社, 2010. |
| [6] | 陈庆亮, 武志博, 郭玉海, 等. 荒漠肉苁蓉及其寄主梭梭栽培技术[J]. 中国现代中药, 2015, 17(4):359-368. |
| [7] | Hardardottir I, Olafsdottir ES, Freysdottir J. Dendritic cells matured in the presence of the lycopodium alkaloid annotine direct T cell responses toward a Th2/Treg phenotype[J]. Phytomedicine, 2015, 22(2):277-282. |
| [8] | Koski GK, Cohen PA, Roses RE, et al. Reengineering dendritic cell-based anti-cancer vaccines[J]. Immunological Reviews, 2008, 222(1):256-276. |
| [9] | Garg R, Shrivastava P, van Drunen Littel-van den Hurk S. The role of dendritic cells in innate and adaptive immunity to respiratory syncytial virus, and implications for vaccine development[J]. Vaccines, 2012, 12(11):1441-1457. |
| [10] | 赵超, 曾峰, 黄一帆, 等. Box-Behnken响应面设计法优化黑木耳菌质多糖提取工艺[J]. 生物技术通报, 2013(6):188-193. |
| [11] | 刘玉佳, 孔繁东, 刘兆芳, 等. 桔梗多糖Sevag法除蛋白工艺的研究[J]. 中国调味品, 2014, 39(4):5-7. |
| [12] | 孙晓燕, 蔡昌利, 徐丽莉, 等. 多糖含量测定方法的比较[J]. 现代中药研究与实践, 2015, 29(3):58-62. |
| [13] | 任璐, 顾小红, 汤坚. 栽培管花肉苁蓉中苯乙醇苷的提取与纯化研究[D]. 无锡:江南大学, 2006. |
| [14] | Zhang P, Ding R, Jiang S, et al. The adjuvanticity of Ganoderma lucidum polysaccharide for Newcastle disease vaccine[J]. Int J Biol Macromol, 2014, 1(65):431-435. |
| [15] | Lemmo HR, Sham J, Madrenas J, et al. High molecular weight polysaccharides are key immunomodulators in North American ginseng extracts:Character-ization of the ginseng genetic signature in primary human immune cells[J]. Journal of Ethnopharmacology, 2012, 1(142):1-13. |
| [16] | 张涛, 许文胜, 贾彦斌, 等. 肉苁蓉多糖对THP-1细胞吞噬作用的影响及其机理研究[J]. 生命科学研究, 2013, 17(2):148-150. |
| [17] | 王晓莉, 廖成水, 程相朝, 等. 甘草甜素甘草多糖和光甘草定对小鼠巨噬细胞的毒性与免疫功能的调节[J]. 中国兽医科学, 2014, 439(3):103-108. |
| [18] | Fan Y, Hu Y, Wang D, et al. Epimedium polysaccharide and propolis flavone can synergistically stimulate lymphocyte proliferation in vitro and enhance the immune responses to ND vaccine in chickens[J]. International Journal of Biological Macromolecules, 2010, 47(2):87-92. |
| [19] | Yang M, Lin HB, Gong S, et al. Effect of Astragalus polysaccharides on expression of TNF-α, IL-1β and NFATc4 in a rat model of experimental colitis[J]. Cytokine, 2014, 70(2):81-86. |
| [20] | Carreno BM, Becker-Hapak M, Huang A, et al. IL-12p70-producing patient DC vaccine elicits Tc1-polarized immunity[J]. The Journal of Clinical Investigation, 2013, 123(8):3383-3394. |
| [21] | 方丽, 胡巍. 全肿瘤细胞抗原研究进展[J]. 生物技术通报, 2013, 4(8):23-27. |
| [22] | 邢世华, 李晓波. 清热解毒类中药抗病毒活性及作用机制研究进展[J]. 中国药理学通报, 2014, 30(4):464-468. |
| [23] | Borges RM, Valença SS, Lopes AA, et al. Saponins from the roots of Chiococca alba and their in vitro anti-inflammatory activity[J]. Phytochemistry Letters, 2013, 6(1):96-100. |
| [24] | Li J, Wang X, Wang W, et al. Pleurotus ferulae water extract enhances the maturation and function of murine bone marrow-derived dendritic cells through TLR4 signaling pathway[J]. Vaccine, 2015, 33(16):1923-1933. |
| [25] | Kim HS, Shin BR, Lee HK, et al. Dendritic cell activation by polysaccharide isolated from Angelica dahurica[J]. Food and Chemical Toxicology, 2013, 7(55):241-247. |
| [26] | 李媛, 宋媛媛, 张洪泉. 松果菊苷对衰老小鼠免疫功能和线粒体DNA相对含量的影响[J]. 中国药理学通报, 2010, 26(6):810-813. |