2.青海省农林科学院 教育部青藏高原生物技术重点实验室 青海省高原作物种质资源与利用重点实验室,西宁 810016
2. Qinghai Academy of Agricultural and Forestry Sciences,The Key Lab of Qinghai-Tibetan Plateau Biotechnology of Ministry of Education,Key Laboratory of Germplasm Innovation and Utilization of Plateau Crop in Qinghai Province,Xining 810016
赤霉素(Gibberellin,简称GA)是一个较大的萜类化合物家族,在植物的整个生长发育周期中起调节作用。作为一种重要的植物激素,赤霉素参与控制多种多样的植物发育过程,包括种子萌发、茎的伸长、根的生长、叶片伸展、表皮毛发育、花粉管生长、花和果实的发育等[1, 2]。赤霉素生物合成途径可分为3个阶段,参与其合成的关键酶主要包括古巴焦磷酸合成酶(Copalyl pyrophosphate synthase,CPS)、内-贝壳杉烯合成酶(Ent-kaurene synthase,KS)、内-贝壳杉烯氧化酶(Ent-kaurene oxidase,KO)、GA-20氧化酶(GA-20 oxidase)、GA-3氧化酶(GA-3 oxidase)以及GA-2氧化酶(GA-2 oxidase)等[3]。
CPS是调节GA生物合成途径一个重要的酶,决定了GGPP向GA方向合成,同KS一样位于前质体,且具有引导序列。CPS能够催化生物合成途径中从牻牛儿焦磷酸(Geranylpyrophosphate,GGPP)形成古巴焦磷酸(Copalyl pyrophosphate,CPP),为催化环化双萜形成的第一步。KS则催化CPP形成内-贝壳杉烯,即为赤霉素的前身。KO是一种位于内质网,与膜结合的依赖细胞色素P450和NADPH的单加氧化酶,经三步反应将内-贝壳杉烯氧化为内-贝壳杉烯酸。GA-20氧化酶和GA-2氧化酶是重要的GA生物合成和调控酶,为可溶性的双加氧酶,由小的多基因家族编码,目前大约有20-30种的GA-20氧化酶基因被克隆[4]。GA-20氧化酶是严格调控的酶,既受反馈调节,又受光周期调控。GA-20氧化酶底物专一性不强,其对底物的亲和力与C-13位的羟基化有关,形成GA代谢的2个或多个平行形成途径,这与植物中具有生物活性的GAs类型相一致[5]。GA-2氧化酶主要作用于有生物活性的GA1和GA4,使两者在C-2位羟基化转变成无活性的GA8和GA34,并且维持着植物体内具有生物活性的GAs和C19-GAs中间体之间的平衡。赤霉素受体GID1(Gibberellin insensitive dwarf1)是一种可溶性蛋白,与赤霉素结合形成二聚体,将赤霉素的信号传递给下游元件,在植物体上产生赤霉素效应[6]。自20世纪60年代起,由于水稻sd1基因和小麦Rht1基因在育种中的应用,极大地提高了世界主要粮食作物的产量,即“绿色革命”[7, 8]。最近的研究表明主要农作物的“绿色革命”都与赤霉素密切相关[9, 10]。目前,在分子水平上研究赤霉素的表达调控已成为植物激素研究领域中的前沿和热点[11, 12, 13]。
实时荧光定量PCR为目前常用检测基因表达量的方法,具有比Northern blot成本低,操作简便,省时省力,高精确度和高灵敏度等特点,能够检测表达丰度较低的mRNA,已经成为基因表达分析的首选方法[14, 15]。
本研究以马铃薯株高突变株系为材料,通过细胞学观察及实时荧光定量PCR方法,分析突变系体细胞特征并检测赤霉素代谢途径中关键酶基因的表达情况,旨在为进一步了解马铃薯中赤霉素作用的分子机理提供参考资料。
1 材料与方法 1.1 材料 1.1.1 马铃薯材料高原4号来源于青海省农林科学院生物技术中心,4P2-9为本实验室利用RNA干涉沉默马铃薯卷叶病毒筛选出的株高变异突变系。
1.1.2 仪器和试剂iQ5 实时荧光PCR仪(Bio-Ra-d),高速冷冻离心机,PCR仪,水平凝胶电泳仪,凝胶成像系统,电子显微镜,微量移液枪(Eppendorf)。
2×SYBR Green I Mix 购自上海生物工程公司,0.2 mL平盖八联管购自Bio-Rad公司,RNAprep Pure植物总RNA提取试剂盒、Fast Quant cDNA第一链合成试剂盒、RNase-Free DNase I、10×buffer、dNTP、Taq聚合酶均购自天根生物公司。
1.2 方法 1.2.1 材料的准备从基因库中分别取高原4号和突变株系4P2-9的组培苗,切取带芽茎段于基本培养基MS中,在本实验室的培养间培养30 d(培养温度为白天25℃、夜间21℃,光照为14 h/d,采用日光灯补光)。
1.2.2 马铃薯形态指标测量与细胞学观察分别挑取高原4号和4P2-9组培苗各10株测量每株组培苗植株高度,并统计节间数。用镊子小心撕取组培苗中部茎段表皮,用稀碘染色后制作细胞观察玻片,并用电子显微镜观察细胞结构。
1.2.3 马铃薯总RNA提取与质量检测称取马铃薯材料叶片0.1 g在液氮中迅速研磨成粉末,用植物总RNA提取试剂盒提取马铃薯材料的总RNA,具体步骤按试剂盒说明书操作进行。提取的RNA用核酸测定仪测定浓度和纯度,并用1.2%的琼脂糖凝胶电泳检测RNA的完整性,-80℃保存备用。
1.2.4 RT-PCR合成cDNA链逆转录反应体系为20 μL,在0.2 mL RNase free的离心管中加入5×gDNA Buffer 2 μL、Total RNA 5 μL、RNase-Free ddH2O 3 μL,混匀并简短离心,置于42℃孵育3 min,然后置于冰上放置2 min。在上述体系中加入10×Fast RT Buffer 2 μL、RT Enzyme Mix 1 μL、FQ-RT Primer Mix 2 μL、RNase-Free ddH2O 5 μL,充分混匀,42℃孵育15 min,95℃孵育3 min,-20℃保存备用。
1.2.5 引物的设计赤霉素代谢途径中的关键酶主要有CPS1、KS、KO、GA2ox1、GA20ox1及赤霉素受体基因GID1,参考水稻、葡萄、番茄等植物赤霉素代谢关键酶基因序列[16, 17, 18],用DNA STAR软件分析其同源性,在保守序列内用Primer Premier 5设计特异性引物,以马铃薯内源持家基因Actin作为内参基因[19],所有引物(表 1)由上海生物工程公司合成。
以高原4号和4P2-9材料的cDNA为模板,用各基因的特异性引物进行PCR扩增,并以PCR产物为模板进行10倍(100、10-1、10-2、10-3和10-4)梯度稀释,用于建立各目的基因和内参基因的标准曲线。反应中,各目的基因分别与内参Actin基因两两一组,构建标准曲线的同时扩增高原4号和4P2-9材料中相应目的基因和内参Actin基因。反应体系为20 μL,包含10 μL 2×SYBR Green I,引物各1 μL,cDNA 1 μL,ddH2O 7 μL。PCR反应程序为:95℃ 3 min;95℃ 10 s,退火 20 s,72℃ 30 s,40个循环,内参基因、外源基因的熔解曲线的测定均是从65℃到95℃,每0.2℃/5 s测定吸光值1次。每个样品设3个重复,结果取平均值,参照Pfaffl法[20],通过目的基因与内参基因的扩增效率(E)和CT值来计算目的基因的相对表达量(C),C=EΔCT(目的基因)/EΔCT(内参基因),ΔCT=CT目的基因-CT内参基因,E扩增效率=10-1/r,r为标准曲线斜率。以此计算目的基因的相对表达量,并与株高性状进行相关性分析。
2 结果 2.1 马铃薯株高统计及细胞学观察分别统计马铃薯材料4P2-9及对照材料高原4号的株高和节间数,随机挑选10株测量,做3次重复,所得数据经DPS统计软件统计分析,结果(表 2)显示,对照组高原4号材料的平均株高为16.00 cm,4P2-9材料的平均株高为12.45 cm,较对照偏低,且两者之间的差异达到了显著水平(P<0.05)。4P2-9材料的平均节间数为7.9,较对照组的13.00显著偏小,且该差异也达到了显著水平(P<0.05)。4P2-9材料的平均节长与对照组相比,达到显著差异水平(P<0.05)。
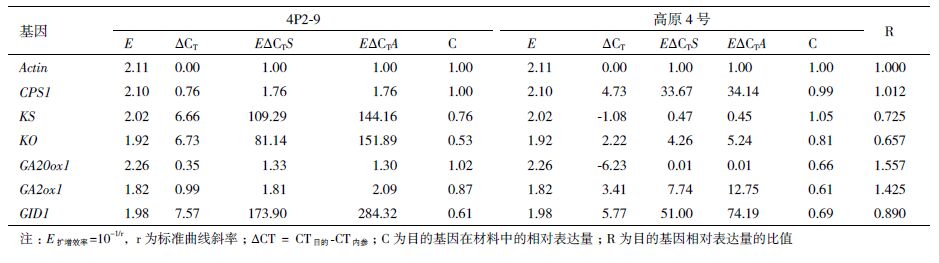
通过对4P2-9材料和高原4号材料的细胞学观察(图 1)发现,两者茎段细胞狭长,均呈不规则状,细胞排列紧密且大小不一,两者在细胞排列及个体伸长方面均无明显差别。说明4P2-9材料的株高突变性状主要表现为茎段节间数的减少,其次为节间的增长,但这种增长并非是由节间细胞拉伸造成的。
|
| A:4号材料株高;B:4P2-9材料株高;C:4号材料茎段细胞排列;D:4P2-9材料茎段细胞排列 图 1 马铃薯材料组培苗株高及节间细胞观察 |
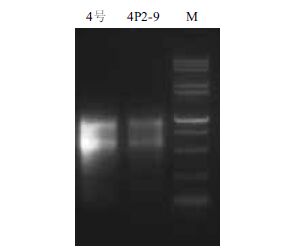
检测提取的RNA经电泳完整性(图 2),并进行反转录合成第一链,分别以合成的cDNA为模板,以特异性引物进行PCR扩增,产物经琼脂糖凝胶电泳检测后分别进行10倍梯度稀释(100、10-1、10-2、10-3和10-4),以梯度稀释的Actin基因PCR产物作为内参基因标准品,以梯度稀释的各目的基因的PCR产物为外源基因标准品,以CT值为Y轴,以模板起始浓度的对数为X轴,建立各目的基因及内参基因的标准曲线,由图 3可知,模板起始浓度与CT值存在线性关系,内参基因Actin的扩增效率为110.90%,R2=0.995,各目的基因的扩增效率为82.2%-125.6%,R2为0.995-0.999,所有标准曲线的相关系数接近于1,熔解曲线为单峰,扩增产物特异性好,扩增曲线中的荧光值能够准确反应目的产物的扩增。
|
| 图 2 RNA检测电泳图 |
|
| 图 3 目的基因与内参基因双标准曲线的建立 |
根据Pfaffl法分别计算了荧光定量PCR中马铃薯材料高原4号和4P2-9的CPS1、KS、KO、GA2ox1、GA20ox1和GID1基因的扩增效率(E)和表达量,结果(表 3)显示,以内参基因Actin为标准,CPS1、KS、KO、GA2ox1、GA20ox1和GID1基因在4P2-9中的相对表达量分别为1.00、0.76、0.53、1.02、0.87和0.61;在高原4号中的相对表达量分别为0.99、1.05、0.81、0.66、0.61和0.69。在材料4P2-9中,CPS1和GA20ox1基因的表达量与内参基因基本一致,KS、KO、GA2ox1和GID1基因的表达量较内参偏低;在材料高原4号中,除KS外,其它基因的表达量较内参基因均偏低。
马铃薯CPS1、KS、KO、GA2ox1、GA20ox1和GID1基因在材料4P2-9和高原4号中的差异表达结果(图 4)显示,与对照相比,各关键酶基因的相对表达量均有不同程度的变化,其中,4P2-9材料中的CPS1基因表达量变化不大,为正常水平的1.012倍左右,KS、KO和GID1基因表达量有不同程度的下调,下调幅度为对照材料的0.725倍、0.657倍和0.890倍左右;GA20ox1和GA2ox1基因的表达量表现为上调,上调幅度为对照材料的1.557倍和1.425倍左右。
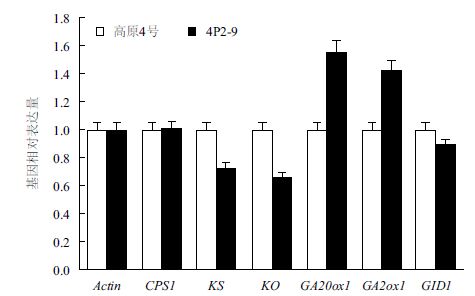
|
| 图 4 赤霉素代谢关键酶基因在4P2-9和高原4号中的相对表达结果 |
赤霉素涉及植物生长发育的诸多方面,这必然要求植物对体内的赤霉素水平进行精确的调控。这种调控主要通过控制GA合成和代谢相关的酶基因的表达来实现。研究表明,赤霉素在株高生长发育过程中起着重要的调控作用[9]。Curtis等[21, 22]的研究表明,当过量表达西葫芦GA20-氧化酶会产生GA缺失突变体表型,如植株矮化、叶色加深等,转基因植株内源GA含量降低。Lee等[23]克隆了菠菜的GA2-氧化酶基因,编码含337个氨基酸残基组成的蛋白,能够在大肠杆菌异源表达,催化GA9和GA20转变为GA51和GA29的反应,GA2-氧化酶维持着植物体内具有生物活性的GAs和C19-GAs中间体之间的平衡,过量表达GA2-氧化酶常会导致植株矮化,GA含量降低。
通过田间及组培苗株高统计发现,株高突变系4P2-9材料的株高显著低于对照材料,主要表现为节间数的减少,但节间长度却有所增长。经细胞学观察,并未发现节间细胞的拉伸,说明造成4P2-9材料节间生长的原因并非为节间细胞的简单拉伸。相对定量检测结果表明,马铃薯赤霉素代谢的关键酶基因CPS1、KS、KO、GA2ox1、GA20ox1和GID1在4P2-9材料和高原4号中发生变化,其中KS基因和KO基因的表达量显著下调,导致了在赤霉素代谢后期代谢阶段GA20ox1基因和GA2ox1基因表达量的显著上调,GA20ox1基因和GA2ox1基因的过量表达最终导致GA含量的降低,表现为赤霉素受体基因GID1的下降[24],最终促使4P2-9材料的株高变化,GA20-氧化酶是严格调控的酶,既受活性GA反馈调节,又受光周期调控,过量表达GA20-氧化酶,植物通常会表现为节间伸长,叶色变淡等特征[25, 26],表明赤霉素代谢过程中关键酶基因表达量的改变是造成马铃薯材料株高突变的原因之一,其中GA20ox1和GA2ox1基因的表达量的上调是促使4P2-9材料株高降低的主要因素。另外,GA20ox1的过量表达还导致了突变材料节间长度的增长,而非简单的细胞拉伸。
当外源T-DNA 整合进入植物基因组,会对宿主细胞的基因组造成改变,这种变化无论是对外源的T-DNA的表达还是植物基因的表达都会产生影响[27]。RNA干涉载体在马铃薯基因组中的随机整合致使基因组发生了重排,这种重排包括植物基因组整合位点的删除和重复,T-DNA 序列的删除和重复,以及染色体上的易位和倒位[28]。特定位点基因序列的改变导致了基因表达量的变化,包括赤霉素代谢途径中的关键酶基因,表现为本研究材料的株高突变。
4 结论通过细胞学方法观察马铃薯材料4P2-9的株高突变性状主要表现为茎段节间数的减少,其次为节间的增长,且这种增长并非是由节间细胞拉伸造成的。利用Real-time PCR方法对赤霉素代谢途径中关键酶基因的相对表达量分析表明,马铃薯材料4P2-9的KS和KO基因表达量显著降低,GA20ox1和GA2ox1基因表达量显著升高,为促使4P2-9材料株高降低的主要因素。
| [1] | Carrera E, Bou J, Garcfa-Martinez JL, Prat S. Changes in GA20-oxidase gene expression strongly affect stem length, tuber induction and tuber yield of potato plants[J]. Plant Journal, 2000, 22(3): 247-256. |
| [2] | Sakamoto T, Miura K, Itoh H, et al. An overview of gibberellin metabolism enzyme genes and their related mutants in rice[J]. Plant Physiol, 2004, 134(4): 1642-1653. |
| [3] | 虞慧芳, 曹家树, 王永勤. 植物矮化突变体的激素调控[J]. 生命科学, 2002, 14(2): 85-88. |
| [4] | 刘洁, 李润植. 作物矮化基因与GA信号转导途径[J]. 中国农学通报, 2005, 21(1): 37-40. |
| [5] | Toyomasu T, Kawaide H, Sekimoto H, et al. Cloning and characterization of a cDNA encoding gibberellin 20-oxidase from rice(Oryza sativa)seedlings[J]. Physiologia Plantarum, 1997, 99(1): 111-118. |
| [6] | 岳川, 曾建明, 曹红利, 等. 茶树赤霉素受体基因CsGID1a的克隆与表达分析[J]. 作物学报, 2013, 39(4): 599-608. |
| [7] | Peng JR, Richards DE, Hartley NM, et al. “Green revolution” genes encode mutant gibberellin response modulators[J]. Nature, 1999, 400(6741): 256-261. |
| [8] | Monna LN, Kitazawa R, Yoshino J, et al. Positional cloning of rice semi-dwarfing gene, sd-1: Rice “green revolution gene” encodes a mutant enzyme involved in gibberellin synthesis[J]. DNA Res, 2002, 9(1): 11-17. |
| [9] | 王秀莉, 姚颖垠, 彭惠茹, 等. 赤霉素代谢及其调控相关基因的差异表达与小麦株高杂种优势的关系研究[J]. 科学通报, 2009, 54(16): 2320-2324. |
| [10] | 杨进, 杨远柱, 林建中, 等. 水稻赤霉素代谢关键酶基因表达的检测分析[J]. 生物技术通报, 2009(6): 81-84. |
| [11] | 李强, 吴建民, 梁和, 等. 高等植物赤霉素生物合成及其信号转导途径[J]. 生物技术通报, 2014(10): 16-22. |
| [12] | Grennan AK. Gibberellin metabolism enzymes in rice[J]. Plant Physiology, 2006, 141(2): 524-526. |
| [13] | 谈心, 马欣荣. 赤霉素生物合成途径及其相关研究进展[J]. 应用与环境生物学报, 2008, 14(4): 571-577. |
| [14] | 张驰宇, 徐顺高, 黄新祥. 一种新颖简便的荧光实时RT-PCR相对定量方法的建立[J]. 生物化学与生物物理进展, 2005, 32(9): 883-888. |
| [15] | 倪中福, 孙其信, 吴利民, 等. 小麦种间与品种间杂交种及其亲本之间基因差异表达比较研究[J]. 农业生物技术学报, 2001, 9(4): 366-370. |
| [16] | 王西成, 任国慧, 房经贵, 等. 葡萄赤霉素合成相关基因克隆、亚细胞定位和表达分析[J]. 中国农业科学, 2012, 45(11): 2224-2231. |
| [17] | 王西成, 吴伟民, 房经贵, 等. 葡萄赤霉素受体基因VvGID1A的分离、亚细胞定位及表达分析[J]. 园艺学报, 2013, 40(5): 839-848. |
| [18] | 钟希琼, 王惠珍. 高等植物赤霉素生物合成及其调节研究进展[J]. 植物学通报, 2001, 18(3): 303-307. |
| [19] | 李飞, 徐建飞, 刘杰, 等. 冷驯化前后野生马铃薯Solanum acaule内参基因的筛选[J]. 西南农业学报, 2012, 25(5): 1592-1595. |
| [20] | PfaffI MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): e45. |
| [21] | Curtis IS, Ward DA, Thomas SG, et al. Induction of dwarfism in transgenic Solanum dulcamara by over-expression of a gibberellin 20-oxidase cDNA from pumpkin[J]. Plant J, 2000, 23(3): 329-338. |
| [22] | Niki T, Nishijima T, Nakayama M, et al. Production of dwarf lettuce by overexpressing a Pumpkin Gibberelling 20-oxidasegene[J]. Plant Physiol, 2001, 126(3): 965-972. |
| [23] | Lee DJ, Zeevaart JAD. Differential regulation of RNA levels of gibberellin dioxygenases by photoperiod in spinach[J]. Plant Physiol, 2002, 130(4): 2085-2094. |
| [24] | Zhang Y, Ni ZF, Yao Y, et al. Gibberellins and heterosis of plant height in wheat(Triticum aestivum L.)[J]. BMC Genetics, 2007, 8(1): 40-50. |
| [25] | Huang SS, Raman AS, Ream JE, et al. Overexpression of GA20-oxidase confers a gibberellin-overproduction phenotype in Arabidopsis[J]. Plant Physiol, 1998, 118(3): 773-781. |
| [26] | 吴建明, 李杨瑞, 王爱勤, 等. 赤霉素诱导甘蔗GA20-Oxidase基因实时荧光定量PCR分析[J]. 分子植物育种, 2009, 7(5): 922-927. |
| [27] | 杨琳, 付凤玲, 李晚忱. 农杆菌介导转基因植物T-DNA的整合方式[J]. 遗传, 2011, 33(12): 1327-1334. |
| [28] | 杨继芳, 刘明, 安利佳. T-DNA 整合的研究进展[J]. 遗传, 2004, 26(6): 991-996. |