现代甘蔗栽培种是甘蔗属热带种,割手密和印度种等物种的种间杂交种,在长期的高贵化育种过程中,减数分裂的异常使得现代甘蔗栽培种形成大量的异源多倍非整倍体[1],同时由于甘蔗对光周期反应敏感,许多重要亲本在亚热带和温带地区很难开花,即使开花也存在花粉数量不足,与近缘植物的花期不遇等问题,给甘蔗常规杂交育种带来许多困难[2]。而转基因技术是将人工分离和修饰过的基因通过物理、化学及微生物介导的方式导入到生物体基因组中,不受生物体间亲缘关系的限制,操作时间短,改良目的性状明确。而且甘蔗组培技术成熟,转基因技术相对较容易[3],已成为甘蔗品种遗传改良的重要途径。
然而转基因育种中单独的转化一个或两个基因,很难真正对作物起到较大程度的改良。多基因转化策略已成为基因工程在基础理论与实际应用研究中的主流方向[4]。一次多基因转化可以缩短时间,减少成本,减少筛选标记的积累。国内在大豆、水稻等作物一次多基因多性状遗传改良方面的研究已有报道[5, 6],而对甘蔗这方面开展的研究则很少,国内所见的报道仅限于两个基因融合表达,未见有3个或3个以上同时多基因多性状的遗传改良。国内研究单位对甘蔗遗传改良方面已经做了很多研究,部分转基因甘蔗品系已进入环境释放阶段,但最后取得成功的单位非常有限[7]。在甘蔗上开展一次多基因遗传改良具有重要意义。
本实验构建一个多基因植物表达载体,对甘蔗进行遗传转化,并通过多重PCR法对转化株系进行PCR检测,旨在探索甘蔗一次多基因遗传转化的可行性。
1 材料与方法 1.1 材料 1.1.1 品种、质粒和菌株本研究所用的受体材料为甘蔗主栽品种新台糖22号,含bar筛选标记基因及另外3个不同目的基因的植物表达载体为本实验构建保存,载体总大小为26 kb,左臂和右臂之间的插入序列达20 kb,转化所用农杆菌菌株为EHA105。
1.1.2 引物合成分别合成筛选标记基因bar和另外3个不同目的基因的特异引物P-F/R、TG1-F/R、TG2-F/R和TG3-F/R共4对,4对引物退火温度相近,扩增产物彼此之间相差100 bp以上,以便于用于转基因植株的多重PCR检测。各基因以及各引物扩增产物大小分别为:筛选标记基因bar(513 bp)、Gene 1(643 bp)、Gene 2(359 bp)、Gene 3(743 bp)。
1.1.3 培养基配方胚性愈伤组织诱导培养基:MS+2,4-D 1 mg/L+蔗糖30 g/L+卡拉胶 8 g/L,pH5.8。
分化培养基:MS+6-BA 1 mg/L+KT 0.5 mg/L+蔗糖30 g/L+卡拉胶 8 g/L,pH5.8。
生根诱导培养基:MS(大量元素减半,其它成分不变)+NAA 2 mg/L+蔗糖20 g/L+椰水100 mL/L+卡拉胶8 g/L+活性炭0.2 g/L,pH5.8。
YEP培养基(1 L):蛋白胨10 g,酵母提取物10 g,NaCl 5 g。
MR(1 L):1/5MS大量元素+MS其他成分+2,4-D 1 mg/L+10 mmol/L果糖+10 mmol/L葡萄糖+30 g/L蔗糖,pH5.3。
1.2 方法 1.2.1 甘蔗胚性愈伤组织的诱导以田间生长良好的甘蔗顶端生长点处的幼叶组织为外植体,经酒精及升汞消毒、无菌水冲洗后,于无菌滤纸上吸干其表面的水分后,切成1 mm左右厚度的薄片接种于诱导培养基上,于避光条件下进行培养至诱导出愈伤组织。
1.2.2 农杆菌侵染菌液的制备通过冻融法将多基因植物表达载体导入到农杆菌菌株EHA105中。将经酶切及多重PCR鉴定为阳性的农杆菌在含抗生素的YEP平板上划线,挑取单菌落接种到5 mL YEP的液体培养基中,振荡培养至对数生长期,于150 mL三角瓶中扩大培养,培养至OD为0.6左右,将菌液转移到离心管中,5 000 r/min离心5 min,弃上清,吸干残液,用MR液体培养基重悬菌体,最后置于28℃,200 r/min激活2 h,诱导细菌Vir基因的表达,作为转化材料的浸染液。
1.2.3 愈伤组织的转化挑取生长旺盛的愈伤组织于滤纸上吹干使其处于干缩状态,于工程菌液中浸泡30 min后,滤去菌液,用滤纸吸干残液,吹干,转移到MR固体培养基上。共培养3-4 d后,转移到含有Basta的继代培养基上继代筛选培养20 d后,转移到含有Basta的分化培养基上分化筛选培养15 d。待愈伤长出1 cm左右的小苗后,转移至含有Basta的生根培养基上生根筛选培养30 d。
1.2.4 抗性小苗PCR分子检测当在抗性生根培养基上生长旺盛,浓绿的小苗生长至4-7 cm后,按编号剪取小苗叶片组织约10-20 mg左右,剪碎置于eppendorf管中,用CTAB法提取DNA。用1.1.2合成的筛选标记基因bar和另外3个不同目的基因的特异引物P-F/R、TG1-F/R、TG2-F/R和TG3-F/R,进行单个基因PCR检测和4个基因四重PCR检测,扩增时设置非转基因甘蔗叶片为负对照,质粒载体为正对照。最后统计筛选标记基因bar和另外3个目的基因的PCR检测阳性率。同时分析4个基因四重PCR检测转基因植株的可行性。
2 结果 2.1 多基因植物表达载体转化农杆菌的鉴定多基因植物表达载体构含有bar筛选标记基因以及3个不同的目的基因(图 1)。在冻融法转化农杆菌之前,首先对载体进行酶切鉴定,结果(图 2)显示,在不同限制性内切酶的作用下,bar基因及3个目的基因均能切出与预期片段大小一致的条带,证明质粒准确。通过冻融法转农杆菌菌株后,平板上挑起单克隆,进行菌液四重PCR鉴定,图 3表明,菌液四重PCR能扩增出与正对照质粒载体相同的4个条带,证明质粒载体已经准确导入到农杆菌中。四重PCR所用4对引物为bar基因及3个目的基因的特异性扩增引物P-F/R、TG1-F/R、TG2-F/R和TG3-F/R,PCR扩增引物与质粒DNA的结合位置如图 1所示,设计引物时,4对引物退火温度相近,且4对引物彼此之间距离均超过3 000 bp,在较短的PCR延伸时间内(30 s)不会发生不同对引物之间的交叉扩增(如TG1-F与TG2-R之间)。
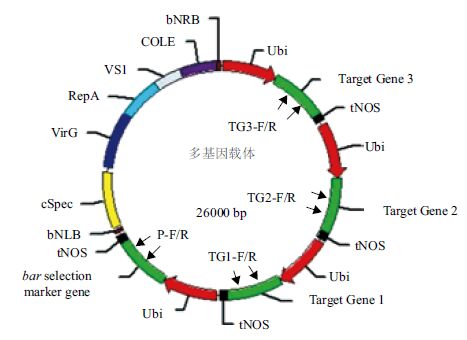
|
| 图 1 多基因植物表达载体 |
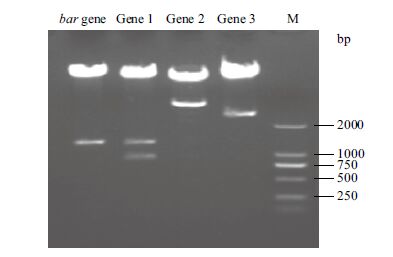
|
| 图 2 质粒酶切鉴定 |

|
| 图 3 农杆菌菌株多重PCR鉴定 |
通过农杆菌介导法,用多基因植物表达载体对甘蔗进行遗传转化,用除草剂进行筛选。侵染过后的愈伤组织经继代筛选培养后,部分愈伤组织能产生乳白色健康的抗性愈伤组织(图 4-A)。抗性愈伤组织继续进行分化筛选培养后,生长出抗性的密集纵生芽(图 4-B)。抗性纵生芽继续进行生根筛选培养后生长成健康浓绿的抗性植株。待抗性植株长到5 cm以后即可进行后续的PCR等分子检测(图 4-C)。

|
| A:继代筛选后的抗性愈伤组织;B:分化筛选培养后的抗性小芽群;C:生根筛选培养后的抗性植株 图 4 甘蔗遗传转化 |
单基因PCR检测结果(图 5)显示,进行PCR检测的23株抗性植株中,bar基因PCR呈阴性的仅有编号11,Gene 1 为PCR呈阴性的也仅有编号11,Gene 2 呈PCR阴性的有编号4、11、16三株,而Gene 3呈阴性的有2、3、4、7、11、13、16和19共8株。

|
| 1-23:生根筛选培养后的抗性植株;CK-:非转基因植株;CK+:质粒DNA 图 5 单基因PCR检测 |
以所提23株抗性小苗的DNA为模板,进行四基因的四重PCR检测。结果(图 6)显示,bar基因PCR显阴性的仅有编号11,Gene 1 为PCR显阴性的也仅有编号11,Gene 2 为PCR阴性的有编号4、11、16三株,而Gene 3为阴性的有2、3、4、6、7、11、13、16、19共9株。多重PCR检测结果与单基因PCR结果大致相同,仅有编号6的植株单基因PCR显阳性,而多重PCR检测显示阴性。说明多重转基因植株多重PCR检测,基本可以准确反映转基因植株的外源基因的整合情况 。
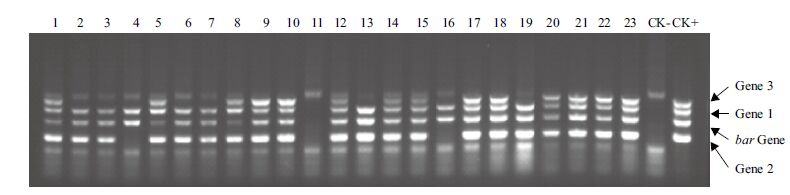
|
| 1-23:生根筛选培养后的抗性植株;CK-:非转基因植株;CK+:质粒DNA1-23:生根筛选培养后的抗性植株;CK-:非转基因植株;CK+:质粒DNA 图 6 转化植株多重PCR检测 |
根据单基因PCR检测结果,可以看出多基因大片段的遗传转化会出现部分片段的断裂与缺失现象。而图 7则清晰地显示了筛选标记基因与3个目的基因的插入与缺失的情况。除编号11为整个插入片段均缺失以外(怀疑为培养基上的假抗性植株),另外22个株系均成功的整合了bar Gene和Gene 1。而随着Gene 2 和Gene 3 离bar Gene越来越远,缺失的现象也随着加重。而且基因缺失遵循着前一个基因缺失,后面的基因必缺失;后面的基因不缺失,前面的基因也不缺失的现象。

|
| 1-23:生根筛选培养后的抗性植株 图 7 DNA片段插入与缺失 |
随着后基因组时代的到来,人类将克隆到越来越多、生物学意义明确的有用基因,并通过基因工程手段对生物体进行遗传改良。以往的植物基因工程,大多数是通过转单个或两个外源基因而获得某个新的性状或改善某个性状。但是生物体的绝大多数性状和生理功能都是依靠多基因的协调表达而实现的。因此单独的转化一个或两个基因,效果往往不大理想,很难真正对作物起到较大程度的改良。例如甘蔗蔗糖的合成,受到了很多关键酶基因的影响,如果单一对某一个基因进行改良,是无法真正起到增糖的效果的。好比一条公路有多个限速环节,只打通其中一个限速点,而忽略了其他的限速点,对公路的提速效果肯定不理想。一次多基因遗传转化可以有效地解决这一问题,是很有应用前景的作物转基因改良技术手段。一次多基因遗传转化可以同时将多个基因插入植物基因组,同时对多个性状进行遗传改良,减少了不同单基因多次遗传转化的多个筛选标记基因的累赘,减少了工作量与成本。但是一次多基因遗传转化,表达载体上左臂和右臂之间的片段就比单基因的大。而在遗传转化的过程中会出现DNA片段断裂缺失的现象,而且随着插入片段越大,DNA片段断裂与缺失的现象就越严重[8, 9]。本研究的实验结果充分印证了这一现象的存在。在遗传转化筛选的过程中,培养基筛选是针对筛选标记基因进行的,因此只要筛选剂添加的浓度合适,在筛选培养基上获得的抗性植株基本为筛选标记PCR阳性。本研究室所建立的甘蔗转基因bar/Basta筛选系统与pmi/Mannose筛选系统最后在得到的抗性植株,筛选标记基因的PCR阳性率基本接近于100%[10, 11]。但是连接在筛选标记基因之后的目的基因就会或多或少的出现一些缺失的现象。其缺失的规律为插入片段越大,缺失概率越大;离筛选标记基因越远,缺失概率越大;前一个基因缺失,后面的基因必缺失;后面的基因不缺失,前面的基因也不缺失。
4 结论本研究用一个多基因植物表达载体,通过农杆菌介导法,对甘蔗进行遗传转化,获得多个抗性株系。挑取其中的23株进行单基因多次PCR,与多重PCR进行检测。结果证明同其他作物一样,甘蔗一次多基因遗传转化也是可行的。然而一次多基因遗传转化会出现基因遗失现象,插入区域基因越多,片段越长,缺失现象就越严重。因此必须在遗传转化与筛选的过程中获得较大数量的抗性植株,才能从中筛选到所有目的基因未缺失,表达稳定,有应用价值的转基因株系。
| [1] | 黄东益, 庄南生, 王英, 等. 甘蔗一些种质的遗传背景研究[J]. 中国科技成果, 2008, 10: 35-44. |
| [2] | 李奇伟, 邓海华, 周耀辉. 近年来海南甘蔗育种场甘蔗开花诱导与新种质杂交利用研究[J]. 甘蔗糖业, 2000, 1: 1-7. |
| [3] | 汤亚飞, 周国辉. 甘蔗转基因技术及其在甘蔗改良中的应用[J]. 甘蔗糖业, 2005, 4: 1-5. |
| [4] | 李宝健, 朱华晨. 论应用多基因转化策略综合改良生物体遗传性研究方向的前景[J]. 中山大学学报, 2005, 44(4): 79-83. |
| [5] | 王慧中, 黄大年, 鲁瑞芳. 转mt1D/gutD双价基因水稻的耐盐性[J]. 科学通报, 2000, 45(7): 724-728. |
| [6] | 马炳田, 王玲霞, 李平, 朱祯. 抗虫基因在转基因植株中聚合的初步研究[J]. 四川大学学报: 自然科学版, 2002, 39: 50-54. |
| [7] | 陈平华. 我国甘蔗转基因改良方法的回顾与展望及法定转基因检测机构扮演的角色[C]. 中国作物协会甘蔗专业委员会第十三次学术讨论会论文集(福建分册), 2012: 176-180. |
| [8] | 朱丽, 傅亚萍, 刘文真, 等. 利用共转化和华药培养技术快速获得无选择标记的三价转基因水稻[J]. 中国水稻科学, 2007, 21(5): 475-481. |
| [9] | Cao MX, Huang JQ, Wei ZM, et al. Agrobacterium-mediated multiple gene transformation in rice using a single vector[J]. J Integr Plant Biol, 2005, 47(2): 233-242. |
| [10] | 王文治, 蔡文伟, 冯翠莲, 等. 高效快速甘蔗转基因方法探索[J]. 热带作物学报, 2012, 33(9): 1619-1624. |
| [11] | 王文治, 杨本鹏, 蔡文伟, 等. 甘蔗转基因甘露糖筛选系统的建立[J]. 生物技术通报, 2015, 31(1): 92-97. |




