2. 浙江商业职业技术学院,杭州 310083 ;
3. 内蒙古农业大学生命科学学院,呼和浩特 010018
2. Zhejiang Business College,Hangzhou 310083 ;
3. College of Life Sciences,Inner Mongolia Agricultural University,Hohhot 010018
甜菊糖,或称甜菊糖苷(Steviol glycoside),原产于南美洲,是甜叶菊(Stevia rebaudiana)的提取物。甜菊糖(Stevia sugar)作为新一代的天然高倍甜味剂已在近几年得以迅速发展。现在,甜菊糖已成为第一代糖源(蔗糖)和第二代糖源(阿斯巴甜)的替代品,被称为世界“第三代天然零热量(零卡)健康糖源”甜叶菊长期以来被当地居民用于泡茶喝。在巴西和巴拉圭,甜菊糖作为天然食糖已经有几百年的历史。这类糖苷的化学成分由双萜苷元和糖基组成。其甜度为蔗糖的200-300 倍,且在人体内基本不会被吸收和代谢,因而是一种天然的无能量甜味剂。甜叶菊的甜菊糖主要在叶片合成,自甜叶菊叶片提取的甜菊苷是一种白色晶状粉末,外观与蔗糖、葡萄糖类似,但带轻微的苦味。
目前中国是甜叶菊种植的第一大国,而美国、日本是甜菊糖的主要消费国[1, 2]。随着对低能量高甜度的甜味剂的需求量不断增加,甜菊糖这一天然甜味剂的市场潜力将持续增长。但目前甜菊糖种植加工仍属新兴产业,在原料的生产、提取纯化及销售利用等方面都有发展潜力。对于甜菊糖合成途径有关基因的分离和现代基因工程的发展又为甜菊糖的生产提供了新的手段。本文就甜菊糖利用现状以及甜菊糖在植物体内的代谢途径进行了总结并进一步分析了基因工程及遗传和代谢工程在甜菊糖生产上的应用现状和进展。
1 甜菊糖的生物合成途径及在体内代谢甜叶菊中的甜菊糖是从甜叶醇(Steviol)这一萜类化合物所合成的多种甜菊糖苷(Steviol glycoside)的混合物。甜菊糖苷的基本分子结构,见图 1 和表 1。

|
| 图 1 甜叶醇及甜菊糖苷的结构 |
 |
甜菊糖苷是由甜叶醇加糖基(主要是葡萄糖)后形成。非糖体部分的甜叶醇为双萜类(Diterpenoid)衍生物,与植物体内其他萜类化合物(Terpenoid)一样,是通过异戊二烯生物合成途径所产生(图 2)[3]。
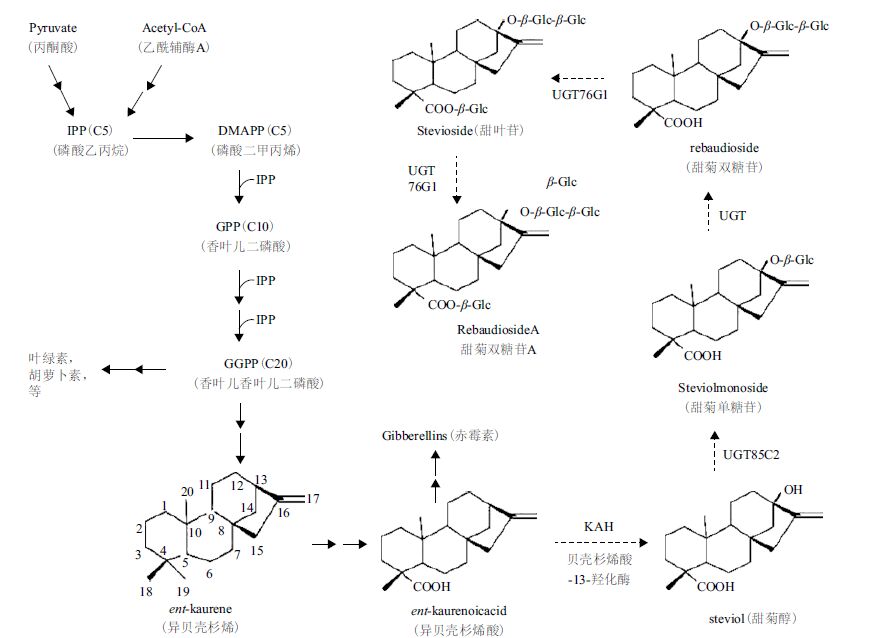
|
| 由异戊二烯生物途径合成的香叶儿香叶儿二磷酸为多种双萜类衍生物的前体。虚线箭头:甜菊糖苷特有的合成途径。从香叶儿香叶儿二磷酸合成的异贝壳杉烯酸可在贝壳杉烯酸氧化酶等酶的催化下合成赤霉素。甜叶菊具有的贝壳杉烯酸-13- 羟化酶(KAH)催化甜叶醇的合成。多个葡糖基转化酶(UGT)再用甜叶醇合成各种甜菊糖苷 图 2 甜菊糖苷的生物合成途径 |
这一合成途径也参与植物体内其他多种重要代谢产物的合成,包括胡萝卜素、叶绿素、赤霉素和油菜素。甜叶醇是由异贝壳杉烯酸(ent-kaurenoicacid,ent-KA) 合成,而异贝壳杉烯酸也是赤霉素合成的前体( 图 2)。甜叶菊这类植物含有其所特有的贝壳杉烯酸-13- 羟化酶(ent-kaurenate13-hydroxylase,KAH),它将异贝壳杉烯酸羟化成甜叶醇。随后几个葡糖基转化酶(UGT)再用UDP-葡糖基为底物将糖基转移到甜叶醇的C-13 和C-19 的羟基上以合成不同的甜菊糖苷。贝壳杉烯酸-13- 羟化酶催化甜菊糖苷合成的第一步,是这一合成途径最关键的酶。
甜菊糖占叶片干重的10% 左右,其浓度及不同糖苷比例根据不同的甜叶菊品种、生长条件和生长时期而变化。其中甜菊双糖苷A(Rebaudioside A)(表 1)约占20%-50%。从甜叶菊提取的甜菊糖混合物略带苦涩味及薄荷醇味,但甜菊双糖苷A 的甜味特性较好,其甜度较其他甜菊糖苷大而苦味弱[4],因而甜菊双糖苷A 纯提取物作为甜味剂的用途更广,而增加甜菊双糖苷A 的产量也是甜叶菊育种的重要目标之一。降低甜菊糖的苦涩味也可以在提取后通过化学修饰的方法来达到,如用α-淀粉酶处理[5]。甜叶菊还含有低量的甜菊双糖苷M(Rebaudioside M),它的甜度不亚于甜菊双糖苷A,并且苦味比甜菊双糖苷A 弱[6],因而有望在将来有更广的利用。
作为糖苷,甜菊糖含有葡萄糖和来自甜叶醇的非糖体部分。甜菊糖苷的甜味是由人体舌头味觉细胞上的糖受体对甜菊糖苷中的葡萄糖起反应而感觉到。一般糖基多的甜菊糖苷(如甜菊双糖苷A、甜菊双糖苷M)比糖基少的甜菊糖苷(如甜叶苷、甜叶醇单糖苷等)味道更甜。甜菊糖所带苦味是因其非糖体部分被舌头味觉细胞上的苦味受体所识别而致。进入人体的消化道后,甜菊双糖苷A 被转化为甜叶苷,甜叶苷再被降解为葡萄糖和甜叶醇。此时释放的葡萄糖不会被吸收到血液中,而是被结肠里的大肠杆菌所利用。甜菊醇不能被人体降解而被排泄出去[7]。
2 参与甜菊糖合成的重要酶及基因参与甜菊糖苷合成的基因大多已被克隆。作为甜叶醇前体的异贝壳杉烯酸也参与赤霉素的合成,而赤霉素是调控植物正常生长发育必需的激素,因而植物都能合成异贝壳杉烯酸。但一般植物缺乏将异贝壳杉烯酸转化为甜叶醇这一催化甜菊糖合成途径关键步骤的贝壳杉烯酸-13- 羟化酶(Kaurenoicacid_13hydroxylase,KAH)。已从甜叶菊中克隆编码KAH 的基因,该基因属于细胞色素P450(Cytochrome p450) 家属的一员[8, 9]。甜叶醇的C-13 和C-19 上羟基都有可能被糖基化而产生甜菊糖苷。这一系列的糖基化是由葡糖基转化酶(UDP-glucosyltransferase,UGT)所催化。UGT 也是一个大的基因家族,植物有上百个不同的UGT。有些UGT 有底物特异性,而有的则显多功能性。甜叶醇的糖基化是由C-13 开始,然后C-19 羧基才能被糖基化。Richman 等[10]从12 个甜叶菊的UGT 中找到了3 个参与甜菊糖苷合成的UGT。其中UGT85C2催化C-13 的糖基化,UGT74G1 将葡萄糖加到C-19上,而UGT76G1 则将另一葡萄糖加到C-13 葡萄糖的C3 位上产生甜菊双糖苷A(图 3)。Yang 等[11]发现一个UGT76G1 基因的功能缺失的甜叶菊突变体,其甜菊双糖苷A 的含量极低。此发现进一步证明UGT76G1 对甜叶菊体内合成甜菊双糖苷A 起主要作用。利用RNA-seq(转录组测序)技术,Chen 等[12]近来对3 个甜菊糖含量或糖苷成分有差异的甜叶菊材料的转录组作了测序发现143 个UGT。这些材料与甜菊糖合成有关的某些UGT 基因的序列或表达的差异,可能与它们之间甜菊糖苷成分的差异有关联。
甜菊糖苷的合成应在细胞质中进行,因上面所述3 个甜菊糖苷合成的UGT 蛋白都定位于细胞质[8]。而甜菊糖苷合成后则主要积累于细胞中的液泡里。它们从细胞质到液泡的转运可通过ABC 转运蛋白(ABC transporter)、多药和有毒化合物挤出蛋白(Multidrug and toxic compound extrusion,MATE)来实现。
拟南芥一般并不具备甜菊糖苷合成途径。不过Kamiya 和Yamaguchi 等[13]发现拟南芥的其中一个细胞色素p450 蛋白CYP714A2 可使贝壳杉烯酸转化成为甜叶醇。CYP714A2 的过量表达可使拟南芥积累甜叶醇。尚不清楚其他正常不累积甜菊糖的植物是否也有类似功能的基因。
Guleria 等[14] 近来用在甜叶菊叶片中注射(Infiltrate) 农杆菌的办法通过RNA 干扰(RNAinterference,RNAi) 来抑制甜菊糖合成途径中的几个UGT 基因的表达。对编码KAH、UGT74G1 和UGT76G1 等几个基因分别用RNAi 进行不完全的沉默后,叶片中甜菊糖苷的含量降低了22%-63%。不过此研究未能将甜菊糖苷的不同成分作分别检测,因而难以说明这些基因在甜菊糖苷生物合成的这几个步骤中的具体功能。因为用注射农杆菌的办法,RNAi 构建物不能进入叶片的所有细胞,并且RNAi基因只能瞬时表达,所以一般只能对有关基因表达作部分沉默,使这一方法的效果受到限制。建立有效的甜叶菊稳定转化体系对甜叶菊进行分子生物学研究和分子改良将是重要的关键技术问题。最近已有关于将甜叶菊转化成功的报道[15]。
3 甜叶菊和甜菊糖的食用安全性虽然甜叶菊在饮食上的利用已有几十年(如日本)至几百年(如南美)的历史,但1985 年的一项报道指出甜菊醇会引起小鼠致癌[16]。这一报道及其他原因使得美国和欧洲一些国家在20 世纪90 年代对甜菊糖实施禁用或者限制使用。但这一研究结果已被认为有误[17]。随后的多项研究表明甜菊醇或甜菊糖苷对人体均无害处[8, 18]。2006 年世界卫生组织(WHO)对多个有关甜叶菊和甜菊糖的毒性研究报告作评定后认定甜菊糖对人体安全[19]。WHO 的食品添加剂专家委员会将甜菊糖苷可接受的每日摄取量定为每公斤体重0-4 mg[20]。美国联邦药检局(FDA)于2008 年批准甜菊糖可作为甜味剂在饮料、食品和医药中的甜味剂使用。并于2009 年将甜菊双糖苷A定为“公认安全的成分(Generally recognized as safe,GRAS)”[21]。甜菊双糖苷M 也在近期被FDA 认定为“公认安全的成分”[6]。甜叶菊的粗提物尚未被FDA 批准作为食品添加剂使用。欧盟于2011 年批准甜菊糖可用作甜味剂用于食品和饮料[22]。除了作为甜味剂外,也有不少报道称甜菊糖或广西甜茶可治疗或预防多种疾病或有其他保健功效,如抗癌、抗高血压、抗高血糖、消炎等[23, 24, 25, 26]。这类报道中有些未经严密的科学论证,所以结论有待进一步证实。但是作为甜味剂,国际上对甜菊糖的需求在近几年还将逐年增长。
4 基因工程和植物代谢工程在甜菊糖生产中 的应用参与甜菊糖合成途径的基因的克隆为通过遗传和代谢工程改良甜菊糖的生产奠定了基础。其中一个可尝试的途径是通过转基因的方法将与甜菊糖合成有关的KAH 基因以及UGT 基因在甜叶菊里过量表达以促使将更多异贝壳杉烯酸转化为甜菊糖苷。增加异贝壳杉烯酸的合成也有望增加甜菊糖苷的合成。另一个值得考虑的途径是筛选甜叶菊赤霉素合成缺失突变体,如异贝壳杉烯酸氧化酶的突变体。异贝壳杉烯酸氧化酶通过催化异贝壳杉烯酸的氧化参与赤霉素的合成。这类突变体因不能从异贝壳杉烯酸合成赤霉素,植物体内积累较高的异贝壳杉烯酸[26],因而有更多的异贝壳杉烯酸可用于甜菊糖的合成。但植物的赤霉素含量低或降低其合成对增加甜菊糖合成的效果或许不大。且赤霉素缺失突变会影响植物的正常生长,降低生物量。这一不利之处或许可以通过田间施用合成的赤霉素克服。不过在拟南芥中将甜叶菊的UGT85C2 基因过量表达不仅降低了赤霉素含量,还降低了叶绿素的合成,使植物生长受阻[27]。因为甜菊糖合成和累积可能主要发生在叶片的腺毛细胞中[28],利用腺毛细胞特异的启动子来进行这类基因工程操作可能会有更好的效果。
4.1 基因工程在甜菊糖生产中的应用
通过植物基因工程手段来改变甜菊糖合成途径某个特定基因的表达量有望改变甜菊糖的成分组成。如增强UGT76G1 基因的表达,有望增加植物体内甜菊双糖苷A 的累积。
近年来基因组编辑(Genome editing)技术的发展已使改变植物的内在基因变得越来越容易。其中CRISPR[29]被认为是目前改变植物基因最有效的体内基因编辑方法[30],已在拟南芥、水稻、小麦和玉米等植物中成功应用。理论上来说,对于任何能进行成功转化的植物,都可利用这项技术改变特定基因的序列。利用这一方法除了将基因定点敲除外,也可通过改变基因序列来改变其编码的蛋白的功能。此外,用该方法来改变基因启动子区域的序列可达到影响基因表达的目的。
同许多农作物相比,甜叶菊生长缓慢。如能将KAH 和有关的UGT 基因转入生长快的植物中,如烟草、玉米等,使后者也能合成甜菊糖,则有可能有效地提高甜菊糖的产量。除了利用转基因方法通过其他植物生产甜菊糖外,这些基因工程植物也可能作为新的品种直接食用,如培育出能合成甜菊糖的超甜玉米、甜番茄等。
4.2 代谢工程在甜菊糖生产中的应用目前甜菊糖的生产主要通过从甜叶菊中提取甜菊糖苷。通过对甜叶菊叶片沸水的过滤液用树脂吸附、脱盐、浓缩干燥后得到甜菊糖苷初提物。初提物为各种甜菊糖苷的混合物及少量其他成分。这种初提物的味感并不好,对不同甜菊糖苷进一步提纯则需用较复杂的分离程序,使成本增加。利用甜叶菊悬浮细胞或愈伤组织,也可生产甜菊糖。通过一些胁迫培养基,可使悬浮细胞中甜菊糖的含量达到5% 以上[32]。不过与微生物相比,植物细胞培养的成本高、次生产物的产量低,目前利用植物细胞培养大规模生产天然次生产物的成功例子还不多。
利用基因和代谢工程方法使微生物合成甜菊糖有望成为未来甜菊糖生产的重要途径[33]。酵母、大肠杆菌和很多藻类具有生长快、培养成本低、容易进行基因和代谢工程操作、产量高和产物提取容易等优越性。这些微生物具有萜类化合物的合成途径。如酵母能合成单萜和双萜。还有一些微生物具有合成赤霉素的所有基因。赤霉素最初就是从感染水稻的赤霉菌(Gibberella fujikuroi)中分离所得。因此只需在这类微生物中引入KAH 和UTG 等少数几个基因即可使它们合成甜菊糖苷。利用微生物合成的另一个优点是比较容易采用基因定点突变进行操作来提高和鉴定其所编码的酶蛋白的功能。如能将合成的甜菊糖分泌到体外,则更能降低提取的成本。
基因工程的采用为甜菊糖的生产和提取提供了更多的选择。甜菊糖产量的提高和价格的降低将进一步开拓甜菊糖作为甜味剂的市场。
5 展望甜菊糖作为高倍甜味剂在近几年得以日益发展。一些大的公司如可口可乐、百事可乐等已利用甜菊双糖苷A 作为甜味剂生产零能量饮料。目前,我国已有多家生物技术公司投入资金到甜菊糖生产的项目。甜菊糖的市场可望在未来继续扩大,对以下领域的研发将促进甜菊糖的生产和利用。
一是通过传统方法降低甜菊糖原料的生产成本:(1)选择、培育高产的甜叶菊品种来提高产量以降低成本;(2)通过育种提高甜叶菊叶片中甜菊糖的含量。开发一些化学药剂来改变甜叶菊植物体内的相关代谢途径,使其大量合成的甜菊糖,特别是提高甜菊双糖苷A 的含量。
二是利用CRISPR 等基因组编辑方法对甜叶菊中甜菊糖合成途径有关的内在基因进行编辑,以提高甜菊糖的含量或改变不同甜菊糖苷的成分组成。从长远来说,可通过分子生物技术手段,将合成甜菊糖的途径转入目前不能合成甜菊糖,但生长快速的植物中,以培育新的生产甜菊糖的作物。
三是基因和代谢工程为提高甜菊糖产量和降低成本提供了极大的发展空间。可将甜菊糖合成途径有关的基因转入微生物中,通过微生物发酵生产甜菊糖。
四是开发国内甜菊糖的消费市场。中国居民的高倍甜味剂的消费水平明显低于世界平均消费水平。但随着人们对饮食健康要求的提高,甜菊糖在低能量食品和饮料中的利用可望扩大。开发以甜菊糖为高倍甜味剂的饮料和食品在中国有相当大的市场潜力。
| [1] | Madan S, Sayeed A, Singh GN, et al. Stevia rebaudiana(Bertoni): a review[J]. Indian Journal of Natural Products and Resources,2010, 1(3): 267-286. |
| [2] | 徐铮奎. 甜菊糖将迎来黄金时代[N]. 医学经济报, 2012-4- 25. |
| [3] | Brandle JE, Telmer PG. Steviol glycoside biosynthesis[J]. Phytochemistry, 2007, 68(14): 1855-1863. |
| [4] | DuBois GE, Stephenson RA. Diterpenoid sweeteners. Synthesis and sensory evaluation of stevioside analogues with improved organoleptic properties[J]. Journal of Medicinal Chemistry, 1985, 28(1): 93-98. |
| [5] | Ye F, Yang RJ, Hua X, et al. Modification of steviol glycosides using α-amylase[J]. LWT-Food Science and Technology, 2014, 57(1): 400-405. |
| [6] | Prakash I, Markosyan A, Bunders C. Development of next generation stevia sweetener : rebaudioside M[J]. Foods, 2014, 3(1): 162- 175. |
| [7] | Matsui M, Matsui K, Kawasaki Y, et al. Evaluation of the genotoxicity of stevioside and steviol using six in vitro and one in vivo mutagenicity assays[J]. Mutagenesis, 1996, 11(6): 573-579. |
| [8] | Geuns JM. Stevioside[J]. Phytochemistry, 2003, 64(5): 913- 921. |
| [9] | Sander JD, Joung JK. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nature Biotechnology, 2014, 32(4): 347-355. |
| [10] | Richman A, Swanson A, Humphrey T, et al. Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides of Stevia rebaudiana[J]. Plant J, 2005, 41(1): 56-67. |
| [11] | Yang YH, Huang SZ, Han YL, et al. Base substitution mutations in uridinediphosphate-dependent glycosyltransferase 76G1 gene of Stevia rebaudiana causes the low levels of rebaudioside A : mutations in UGT76G1, a key gene of steviol glycosides synthesis[J]. Plant Physiol Biochem, 2014, 80 : 220-225. |
| [12] | Chen J, Hou K, Qin P, et al. RNA-Seq for gene identification and transcript profiling of three Stevia rebaudiana genotypes[J]. BMC Genomics, 2014, 15 : 571. |
| [13] | Kamiya Y, Magome H, Nomura T, Yamaguchi S. Method for producing steviol synthetase gene and steviol : US, 20080271205[P]. 2008. |
| [14] | Guleria P, Yadav SK. Agrobacterium mediated transient gene silencing(AMTS)in Stevia rebaudiana : insights into steviol glycoside biosynthesis pathway[J]. PLoS One, 2013, 8(9): e74731. |
| [15] | Khan SA, Ur Rahman L, Shanker K, Singh M. Agrobacterium tumefaciens-mediated transgenic plant and somaclone production through direct and indirect regeneration from leaves in Stevia rebaudiana with their glycoside profile[J]. Protoplasma, 2014, 251(3): 661-670. |
| [16] | Pezzuto JM, Compadre CM, Swanson SM, et al. Metabolically activated steviol, the aglycone of stevioside, is mutagenic[J]. Proceedings of the National Academy of Sciences of the United States of America, 1985, 82(8): 2478-2482. |
| [17] | Procinska E, Bridges BA, Hanson JR. Interpretation of results with the 8-azaguanine resistance system in Salmonella typhimurium : no evidence for direct acting mutagenesis by 15-oxosteviol, a possible metabolite of steviol[J]. Mutagenesis, 1991, 6(2): 165-167. |
| [18] | Goyal SK, Samsher, Goyal RK. Stevia(Stevia rebaudiana)a biosweetener : a review[J]. International Journal of Food Sciences and nNutrition, 2010, 61(1): 1-10. |
| [19] | WHO. Safety evaluation of certain contaminants in food. Prepared by the Sixty-fourth meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA)[J]. FAO Food and Nutrition Paper, 2006, 82 : 1-778. |
| [20] | WHO. Joint FAO/WHO Expert Committee on food additives[C]. Sixty-ninth Meeting, 2008. |
| [21] | USFDA. Agency Response Letter GRAS Notice No. GRN 000388[DB]. US Food and Drug Admininstration. 2012. |
| [22] | EUFSA. EFSA evaluates the safety of steviol glycosides[R]. European Food Safety Authority, 2010. |
| [23] | Hsieh MH, Chan P, Sue YM, et al. Efficacy and tolerability of oral stevioside in patients with mild essential hypertension : a two-year, randomized, placebo-controlled study[J]. Clinical Therapeutics, 2003, 25(11): 2797-2808. |
| [24] | Chatsudthipong V, Muanprasat C. Stevioside and related compounds : therapeutic benefits beyond sweetness[J]. Pharmacology & Therapeutics, 2009, 121(1): 41-54. |
| [25] | Anton SD, Martin CK, Han H, et al. Effects of stevia, aspartame, and sucrose on food intake, satiety, and postprandial glucose and insulin levels[J]. Appetite, 2010, 55(1): 37-43. |
| [26] | Helliwell CA, Chandler PM, Poole A, et al. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(4): 2065-2070. |
| [27] | Guleria P, Masand S, Yadav SK. Overexpression of SrUGT85C2 from Stevia reduced growth and yield of transgenic Arabidopsis by influencing plastidial MEP pathway[J]. Gene, 2014, 539(2): 250-257. |
| [28] | Jain P, Kachhwaha S, Kothari S. Biotechnology and metabolic engineering of Stevia rebaudiana(BERT. )Bertoni : Perspective and possibilities[J]. International Journal of Life Sciences Biotechnology and Phama Research, 2014, 3(3): 15-37. |
| [29] | Sander JD, Joung JK. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nature Biotechnology, 2014, 32(4): 347-355. |
| [30] | Lozano-Juste J, Cutler SR. Plant genome engineering in full bloom[J]. Trends in Plant Science, 2014, 19(5): 284-287. |
| [31] | Gupta P, Sharma S, Saxena S. Effect of salts(NaCl and Na2CO3) on callus and suspension culture of Stevia rebaudiana for steviol glycoside production[J]. Applied Biochemistry and Biotechnology, 2014, 172(6): 2894-2906. |
| [32] | Philippe RN, De Mey M, Anderson J, Ajikumar PK. Biotechnological production of natural zero-calorie sweeteners[J]. Curr Opin Biotechnol, 2014, 26 : 155-161. |




