口蹄疫是一种无国界传播的全球性传染病,可引起巨大的经济损失和严重的公共卫生问题,故常被称为“政治经济病”。其一旦暴发,能迅速演变为生物灾害。大批的动物被扑杀销毁,引发更为严重的公共卫生问题,容易造成社会的恐慌。对易感动物进行针对性的疫苗接种是控制口蹄疫传播最有效的措施[1]。
近年来,随着动物细胞培养技术逐渐应用于兽用疫苗的生产,动物细胞悬浮培养成为灭活口蹄疫(Foot and mouth disease,FMD)疫苗生产的发展方向[2, 3]。凭借对病毒的高敏感性,BHK 细胞自1962年建株以来已成为制备FMD 疫苗所需病毒抗原的理想细胞系,被广泛应用于FMD 疫苗生产[4, 5]。传统BHK 细胞大多采用转瓶低血清贴壁的培养方式[6]。传统的有血清培养基尽管能向细胞提供生长繁殖所必需的激素、生长因子及其他营养物质,但每个批次的血清之间存在批间差异,且血清价格昂贵,容易被病毒和支原体感染[7, 8]。此外,血清中大量存在的成分复杂的蛋白质给疫苗成品后期的分离纯化带来很大的困难。无血清培养基一般是在传统基础培养基的基础上添加生长因子、铁转运剂、维生素、微量元素以及植物蛋白水解物等来替代血清成分[9]。开发无血清悬浮培养基能够简化纯化和下游加工,降低生产成本,简化分离纯化步骤,避免病毒污染造成的危害,提高了细胞培养的可重复性和稳定性,避免了血清批次之间差异的影响。
Mixture 和响应面都是基于合理的实验设计方法并通过实验得到一定数据进而解决多变量问题的一种统计学方法,被广泛应用于动物细胞培养技术[10, 11, 12, 13]。本实验在现有6 种培养基的基础上先采用Mixture 方法开发适用于BHK 细胞高密度悬浮培养的无血清培养基,并针对几种关键成分应用响应面实验优化其浓度,旨为基于BHK 细胞无血清悬浮培养生产口蹄疫疫苗提供基础数据。
1 材料与方法 1.1 材料 1.1.1 细胞本实验所用的细胞株为叙利亚仓鼠肾细胞系BHK-21(Baby Hamster Kidney cell-21)细胞,由合作企业提供。
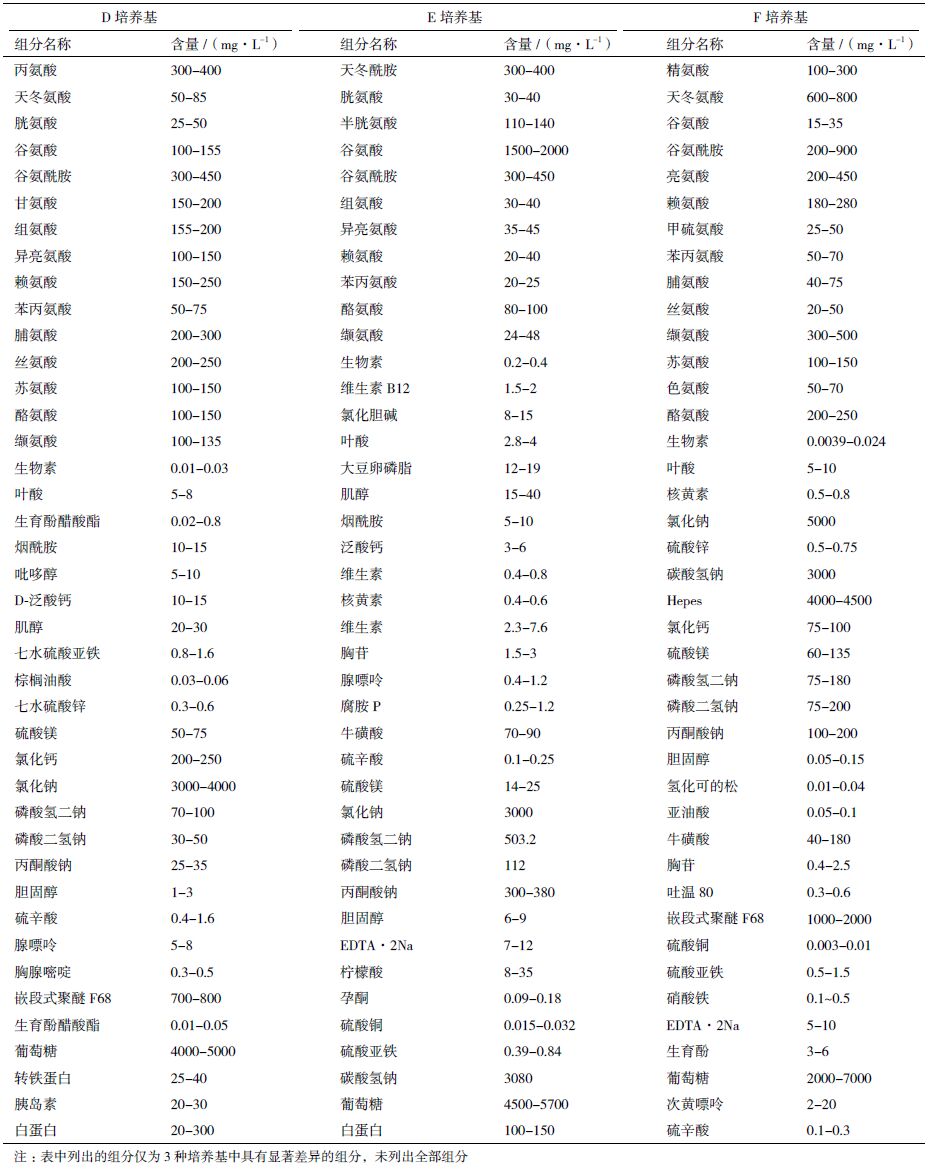
1.1.2 培养基商业培养基:由合作企业提供;6 种基础培养基:从实验室已知配方的无血清培养基配方库中挑选出6 种培养基,配制结束后经Millipore公司0.22 μm 微孔滤膜过滤,并分别命名为A、B、C、D、E 和F。其中A、B、C 为实验室自主研发的无血清培养基,专利号分别为CN201010022834.4、CN201410513086.8 和CN200810039305.8。D、E 和F 为参考国内外与培养基相关的专利文献结合BHK细胞的生长状况计算获得的无血清培养基,具体培养基配方,见表 1。
培养基配制所用的试剂中葡萄糖、氨基酸和维生素均购自美国生命技术公司;各微量金属盐类物质购自美国Sigma-Aldrich 公司;葡萄糖和氨含量测定试剂盒购自上海科欣生物技术研究所;乳酸浓度测定试剂盒购自南京建成生物工程研究所。
1.2 方法 1.2.1 BHK 细胞在实验培养基中的培养将处于对数生长期,活性大于95% 的BHK-21 细胞移入50mL 离心管中,180×g 离心5 min。弃上清,用实验培养基重悬后加入摇瓶(125 mL,Corning)中,工作体积30 mL,置于130 r/min 的摇床,在37℃,5%CO2 条件下培养。每24 h 取样,计数后1 000×g 离心5 min。上清置于-20℃冰箱保存,用于代谢副产物分析。
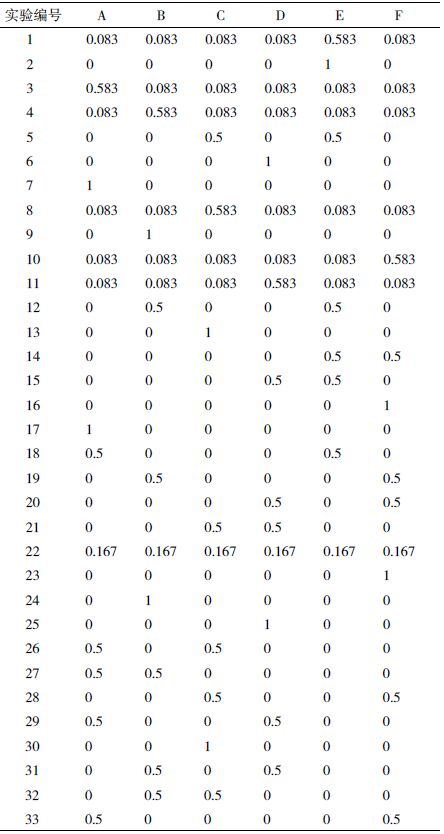
1.2.2 基础培养基Mixture 实验设计将处于对数生长期,活性在95% 以上的BHK-21 细胞接种于125mL 摇瓶,接种方式见1.2.1,工作体积为30 mL。摇床转速为130 r/min,CO2 浓度5%,温度37℃,湿度85%。A-F 分别为考察的6 种培养基,每个实验组中各培养基对应的数字为这种培养基在工作体积中所占的体积百分数。实验共设置35 个实验组,其中2 个为对照组。其中除对照组以外的实验组所用培养基由6 种培养基混合获得。对照组的编号为33、34,所用培养基为商业培养基。接种后每24 h取样计数,以最大活细胞密度和IVCC 作为实验的响应值,考察响应值的大小。实验设计方案,见表 2。
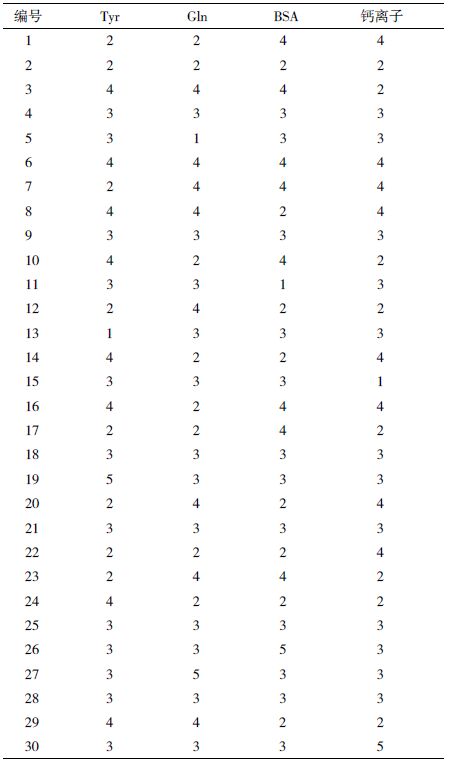
Mixture 实验发现前期谷氨酰胺(Gln)在48 h基本用尽,同时悬浮细胞存在结团现象。通过查阅文献,研究发现Gln 不仅是培养基中重要的碳源,还是细胞合成核酸和蛋白质必需的氨基酸[14, 15, 16]。同时钙离子浓度能够显著影响细胞的结团现象,因此需要考察培养基中Gln 和钙离子的最优浓度。此外,牛血清白蛋白(BSA)是血清的重要替代物,酪氨酸(Tyr)也是培养基中对细胞生长状况有显著影响的组分[17, 18, 19, 20]。为了进一步优化培养基,选取Tyr、Gln、BSA 和钙离子,通过在高水平和低水平之间设置5 个浓度梯度,确定4 种组分的最佳配比及浓度。利用Design-Expert 软件对数据进行模型分析,通过做响应曲面图的方式进行考察。设计表见表 3,其中各水平值1-5 分别代表所配制的培养基中各组分对于相应浓度的倍率。
用优化后关键组分浓度配制的无血清悬浮培养基在工作体积为30 mL 的摇瓶中培养BHK-21 细胞,考察并对比细胞在商业培养基和优化后的无血清培养基中的生长及代谢情况。
1.2.5 细胞计数由于细胞存在一定结团的现象,因此计数前需先用少量胰酶消化5 min。以台盼蓝染色消化好的细胞,用血球计数板计活细胞数,并计算活细胞密度和比生长速率。
1.2.6 葡萄糖、氨和乳酸浓度的测定采用葡萄糖氧化酶法测定葡萄糖含量,脲酶- 波氏比色法测定氨含量,氧化酶法测定乳酸浓度,均按试剂盒说明书操作。
1.2.7 数据处理(1)比生长速率:

(2)活细胞密度对时间积分:

34 种培养基培养的细胞最大活细胞密度和IVCC 两组响应值,见表 4。根据响应值的大小分析6 种培养基的不同配比对响应值的影响,结果表明培养基C 对细胞的最大活细胞密度和IVCC 的影响显著强于其他几种培养基。利用Design-Expert 软件筛选得出BHK-21 细胞无血清培养基的最优组合为A∶B∶C∶D∶E∶F=0∶0∶11∶0∶9∶0。
分析各组分对2 个响应值的影响后拟合出的线性方程为:最大活细胞密度= 23.67A +11.79B+38.30C+34.33D+23.04E+43.63F+14.61AB+132.47AC-27.36AD+5.14AE+48.41AF+91.41BC+20.77BD+42.67BE+24.74BF+79.23CD+166.93CE+46.40CF+4.09DE+59.57DF+82.07EF ;IVCC=114.33A+52.96B+154.99C+130.42D+95.06E+149.33F+66.86AB+238.42AC-61.05AD-4.23AE+110.29AF+243.46BC+164.16BD+152.41BE+121.59BF+347.55CD+624.29CE+77.22CF+32.65DE+100.95DF +170.36EF。
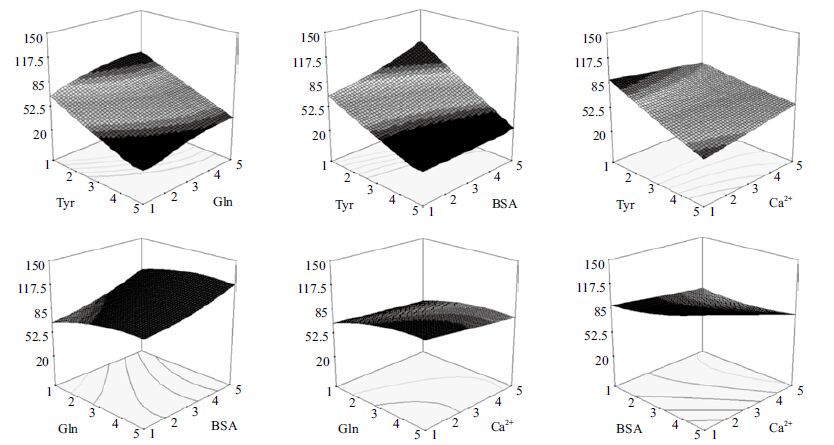
2.2 响应面实验结果利用响应面分析方法对Tyr、Gln、BSA 和钙离子进行定量优化的结果,见表 5,响应面图见图 1和图 2。以72 h 内细胞生长获得的最大活细胞密度和IVCC 作为考察对象,对培养基中Gln、Tyr、BSA和钙离子进行最优化分析得出,其最优浓度分别为基础培养基中相应浓度的1 倍、4 倍、1 倍、和1 倍,浓度分别为3 mmol/L、2.5 g/L、0 g/L 和0 mmol/L。拟合得到多元回归模型:最大活细胞密度=17.66Tyr+54.95Gln+20.60BSA +3.33Ca2+-1.93TyrGln-3.11Tyr-BSA+2.35TyrCa2+-2.74GlnBSA-2.29GlnCa2+-2.85BSACa2+-3.78Tyr2-4.63Gln2+1.11BSA2+0.49(Ca2+)2-62.01 ;IVCC=64.72-15.30Tyr+17.06Gln+5.95BSA-2.60Ca2+-0.07TyrGln-1.86TyrBSA+2.22TyrCa2+-0.68GlnBSA-0.44GlnCa2+-1.70BSACa2++0.30Tyr2-1.66Gln2+1.30BSA2+0.0083(Ca2+)2。

|
| 图 1 四种关键组分对BHK 细胞最大活细胞密度影响的响应面图 |
|
| 图 2 四种关键组分对BHK 细胞IVCC 影响的响应面图 |
将优化后的培养基用于培养BHK 悬浮细胞,并和商业培养基中细胞的生长和代谢情况进行对比,结果如图 3 所示。其中图 3-A、图 3-B 两图为商业培养基中细胞的生长和代谢情况,图 3-C、图 3-D两图为优化后培养基中细胞的生长和代谢情况。
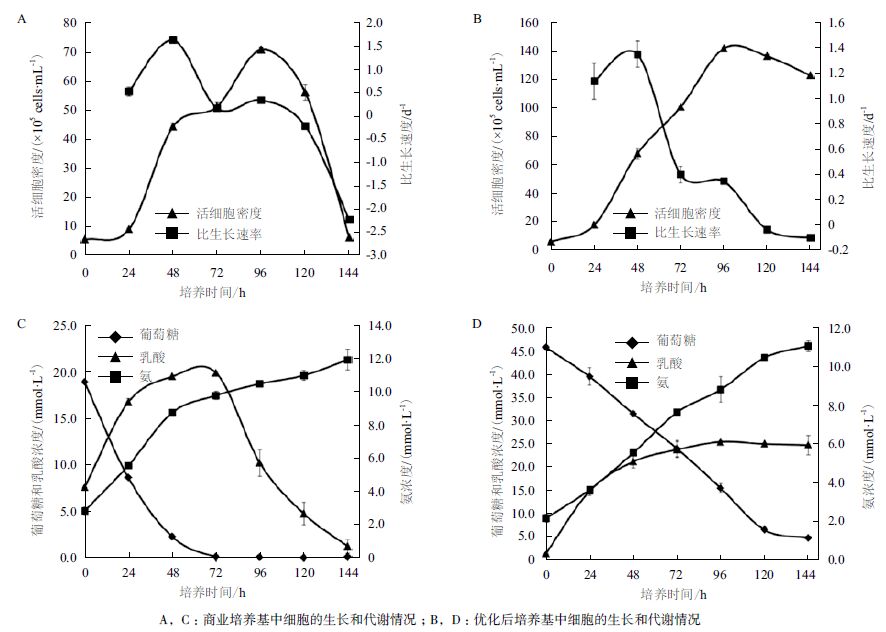
|
| 图 3 BHK 细胞在商业培养基和优化后培养基中的生长和代谢情况 |
生长方面,接种后商业培养基中细胞几乎没有经过延滞期即进入对数生长期,此时比生长速率最大,约为0.75 d-1。随后比生长速率迅速下降,至108 h 细胞比生长速率下降至0 d-1,即进入生长稳定期。稳定期维持时间很短,之后比生长速率持续下降,即进入细胞衰亡期。
培养至96 h 细胞密度达到最大值,为71.92×105 cells/mL,之后细胞密度下降。以最优化的Tyr、Gln、BSA 和钙离子浓度配制的无血清悬浮培养基培养BHK 悬浮细胞同样在96 h 获得最大活细胞密度140.21×105 cells/mL,约为商业培养基的1.95 倍,较商业培养基提高了94.95%。此外,优化后培养基中细胞的稳定期大概能够维持72 h 左右,较商业培养基延长了48 h。因此,优化后的培养基能够改善后期细胞的维持状况,提高细胞可获得的最大活细胞密度。
代谢方面,商业培养基中BHK 细胞生长过程累积消耗18.88 mmol/L 葡萄糖,累积产生乳酸19.47mmol/L,乳酸对葡萄糖的得率约为1.03 mmol/mmol,整个培养过程共产生氨11.91 mmol/L。而优化后培养基中细胞生长过程累积消耗葡萄糖41.16 mmol/L,累积产生乳酸25.27 mmol/L,乳酸对葡萄糖的得率约为0.61 mmol/mmol,整个培养过程共产生氨11.09mmol/L。对比可见,优化后的培养基增加了培养基中的葡萄糖含量,且乳酸对葡萄糖的得率降为商业培养基的59.22%,这说明更多的葡萄糖用于细胞的生长。
3 讨论本研究采用了Mixture 实验和响应面分析相结合的方法开发适于BHK 细胞悬浮培养的无血清培养基。结果显示,该组合方法能快速地利用现有的培养基开发出适合细胞生长的培养基,并能够针对关键组分进行浓度优化进而获得理想的培养基配方,是一种简便高效的培养基开发方法。
通过Mixture 实验以最大活细胞密度和IVCC为考察指标初步筛选出能够维持BHK 细胞生长的基础培养基,并确定6 种培养基的混合比例分别为A∶B∶C∶D∶E∶F=0∶0∶11∶0∶9∶0。针对Tyr、Gln、BSA 和钙离子进行响应面实验设计和分析确定4 种物质的最佳添加比例和浓度,并最终确定一种适合BHK 细胞悬浮培养的无血清培养基。将优化后的培养基和商业培养基比较发现,优化后的无血清培养基培养的BHK 悬浮细胞最大活细胞密度较商业培养基提高了94.95%,且乳酸对葡萄糖的得率降为商业培养基的59.22%。表明该培养基优化过程已成功使BHK 细胞生长摆脱了对血清的依赖,为采用BHK 细胞大规模生产口蹄疫疫苗奠定了数据基础。
4 结论本研究通过Mixture 实验法确定各种培养基的最优混合方式,并利用响应面法确定关键组分的最优浓度,最终开发出适于BHK 细胞悬浮培养的无血清培养基。优化后的培养基能改善细胞的生长状况,符合大规模生产的需要。
| [1] | 谢庆阁. 口蹄疫[M]. 北京: 中国农业出版社, 2004 : 175-176. |
| [2] | 刘旭平, 范里, 朱明龙, 等. MOI 对 HEK293 细胞感染病毒后的生长代谢和腺病毒扩增效率的影响[J]. 高校化学工程学报, 2010, 24(4): 638-644. |
| [3] | 李晓璐, 范里, 赵亮, 等. 基于单纯型设计和部件搜索方法的CHO 细胞无血清培养基的高通量优化[J]. 高校化学工程学报, 2014, 28(4): 777-783. |
| [4] | Bolwell C, Brown AL, Barnett PV, et al. Host cell selection ofantigenic variants of foot-and-mouth disease virus[J]. J Gen Virol, 1989, 70(Pt 1): 45-57. |
| [5] | Amadori M, Volpe G, Defilippi P, et al. Phenotypic features ofBHK-21 cells used for production of foot-and-mouth diseasevaccine[J]. Biologicals, 1997, 25(1): 65-73. |
| [6] | Duygu AT, Ayse N, Murat E, et al. Cultivation and comparison ofBHK-21 anchorage semi-dependent cell line in different productionsystems[J]. Turkish Journal of Biochemistry-Turk J Biochem,2012, 37(3): 280-286. |
| [7] | Cruz HJ, Freitas CM, Alves PM, et al. Effects of ammonia andlactate on growth, metabolism, and productivity of BHK cells[J].Enzyme and Microbial Technology, 2000, 27(1-2): 43-52. |
| [8] | Rourou S, van der Ark A, van der Velden T, et al. Developmentof an animal-component free medium for vero cells culture[J].Biotechnol Prog, 2009, 25(6): 1752-1761. |
| [9] | Lee YY, Yap MG, Hu WS, et al. Low-glutamine fed-batchcultures of 293-HEK serum-free suspension cells for adenovirusproduction[J]. Biotechnol Prog, 2003, 19(2): 501-509. |
| [10] | Vohra A, Satyanarayana T. Statistical optimization of the mediumcomponents by response surface methodology to enhance phytaseproduction by Pichia anomala[J]. Process Biochem, 2002, 37(9): 999-1004. |
| [11] | 俞锦锋, 陈慧萍, 缑向楠, 等. CHO DG44 细胞无血清培养基关键组分的优化与替代[J]. 南昌大学学报: 工科版, 2013,35(2): 125-130. |
| [12] | Lars E, Mats B, Anders L. Optimization of a chondrogenicmedium through the use of factorial design of experiments[J].BioResearch Open Access, 2012, 1(6): 306-313. |
| [13] | Sung HK, Gyun ML. Development of serum-free mediumsupplemented with hydrolysates for the production of therapeuticantibodies in CHO cell cultures using design of experiments[J].Appl Microbiol Biotechnol, 2009, 83(4): 639-648. |
| [14] | Yasuhiko I, Yoshinobu K, Ikuya N, et al. Effects of L-glutaminedeprivation on growth of HVJ(Sendai Virus)in BHK Cells[J].Journal of Virology, 1974, 13(3): 557-566. |
| [15] | 张淑香, 李东晓, 朱明龙, 等. 谷氨酰胺限制对杂交瘤细胞生长, 代谢和单抗生产的影响[J]. 高校化学工程学报, 2008,22(1): 77-82. |
| [16] | Lea PJ, Robinson SA, Stewart GR. The enzymology and metabolismof glutamine, glutamate, and asparagine[J]. The Biochemistry ofPlants, 1990, 16(10): 121-159. |
| [17] | Peshwa MV, Kyung YS, McClure DB, et al. Cultivation ofmammalian cells as aggregates in bioreactors : effect of calciumconcentration on spatial distribution of viability[J]. BiotechnolBioeng, 1993, 41(2): 179-187. |
| [18] | 赵亮, 朱明龙, 张旭, 等. 钙离子对293 细胞结团和生长的影响[J]. 生物工程学报, 2008, 21(3): 482-485. |
| [19] | Nesbitt WS, Giuliano S, Kulkarni S, et al. Intercellular calciumcommunication regulates platelet aggregation and thrombusgrowth[J]. J Cell Biol, 2003, 160(7): 1151-1161. |
| [20] | Haiming Z, Srinivasan D. Effects of calcium and magnesium Ionson aggregation of whey protein isolate and its effect on foamingproperties[J]. J Agric Food Chem, 1994, 42(4): 856-862. |