2. 福建师范大学工业微生物教育部工程研究中心,福州 350117
2. Engineering Research Center of Industrial Microbiology of Ministry of Education,Fujian Normal University,Fuzhou 350117
当前我国海产养殖逐渐向规模化、集约化方向发展,高密度的养殖模式被普遍采用。养殖水体作为人工生态系统,由于养殖生物密度加大,人为的物质和能量输入增多造成系统不稳定。在系统中,养殖对象作为生态系统中的主体生物,要求系统中的各环境因子适合养殖生物的需要。然而,养殖过程中产生的残饵、养殖动物的代谢排泄物、各类生物的尸体等大量有机物的矿化分解常造成水体富营养化,影响到养殖生物的生长、生存和养殖效益。生物饵料既有良好的营养功能,又不污染水质,可以提高养殖动物成活率,可弥补一般配合饵料悬浮性差、易分散、保形时间短、易污染水质和引起病害等缺点,优于配合饲料或其他饵料代用品。动物性生物饵料主要是一些轮虫、卤虫、桡足类、枝角类等;植物性饵料主要是一些单胞藻如螺旋藻、金藻、褐指藻、扁藻、微绿球藻等[1]。生物饵料中微藻悬浮性好,绿色环保可净化水体,既是贝类、鱼类等海洋养殖对象育苗和生产的优质天然饵料,也是其他动物性饵料的饵料,处于基础和核心地位。由于微藻在海产养殖中的广泛使用,被称为“Greenwater culture”模式。在“green water”中,种群通过海产动物本身进行生物管理,不同食性动物共同“管理”浮游生物组成,以及调节和改善养殖水质,以利于其自身的生长。在“Green water culture”这种养殖模式中,鱼、虾、贝类和藻类等浮游生物的相互作用显著提高,有力地促进了海产养殖生产技术的提升[2]。虽然目前微藻的养殖成本较高,但随着微藻资源的开发和综合利用水平的提高,以及规模化养殖工艺更加成熟,养殖成本将逐步降低,经济效益也会稳步提升。如Chauton 等[3]对微藻产DHA和EPA 的经济预测表明,微藻有望成为经济上可行的DHA 和EPA 的新来源。未来5-10 年微藻和鱼油极有可能具有一样的市场竞争力,可应用于饲料行业。还有文献报道将污水处理和微藻生产耦合的工艺,进一步大大降低微藻养殖成本,特别适于结合处理富营养化氮磷污染[4]。为此,本文对饵料微藻在海产养殖开发利用现状进行综述。
1 饵料微藻的功能微藻种类繁多,生长速度快、适应性强,营养丰富,是一种光能自养型的单细胞生物。它们在海产养殖中具有多种生物学功能,如营养、清洁水体和益生等,优于配合饲料。
1.1 饵料营养价值研究表明,海洋微藻含蛋白质6%-52%、脂肪酸7%-23% 、藻多糖5%-23%、氨基酸、维生素及微量元素等[5]。其丰富的营养物质是贝类、鱼虾等经济海产养殖动物最好的天然饵料[6]。在海产育苗过程中,饵料的不合适或者营养成分的缺失会影响幼鱼的存活和变态[7]。尤其是海产养殖动物合成长链多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)须从食物中获取。微藻被认为是PUFA,包括ω-3 脂肪酸的可靠和终极来源[8]。摄入ω-3 脂肪酸不仅是养殖动物生长发育所需,而且还减少有关慢性疾病的风险[9]。故无论通过直接或间接摄入的方式,微藻在传递此类营养素的过程中都起到非常关键的作用。养殖动物既可主动滤食微藻为直接营养作用,也可以通过微藻强化培养活饵料(如轮虫和卤虫等),将PUFA 等营养物质传递富集给养殖动物,此为间接营养作用[10]。微藻的种类丰富,生产条件可控,脂肪酸配比具有多样性,可以根据不同养殖对象需求的PUFA 种类选择不同的藻种[11]。
1.2 净化水体微藻是以水为电子供体的光能自养型生物,它们以光能为能源,利用简单的CO2 等无机物合成有机物,既吸收去除水体中N、P,同时又固定温室气体CO2,生长过程中无需添加外部碳源,伴随着释放氧气可提高养殖水体中的溶解氧含量,新增加的藻细胞为营养丰富的生物饵料,可供养殖动物自由吞食。其生长过程中有效吸收水中的N、P、Fe、Si等无机物,可改善和稳定水体生态系统,减少养殖生物的发病率。钟非等[12]通过4 种饵料微藻对海水养殖水体N、P 的去除发现,在优化生长条件下,4 种饵料微藻对海水养殖水体NH4+-N 和PO43--P 均具有较好去除效果,但对NO3--N 去除率稍弱。经过7 d 处理后,对NH4+-N 和PO43--P 去除率均高于99%。沈南南等[13]研究了小球藻和芽孢杆菌在凡尔纳对虾养殖水体中的调控作用,结果表明,菌藻联合处理能够很好地降低水体中的N、P 含量。通过微藻生态调控,可为鱼、贝、虾类和海参等经济动物提供优良的生存环境,降低疾病的滋生。
1.3 益生作用在传统海产养殖中,抗生素的滥用出现许多环境问题及其他副作用,并会破坏海产养殖动物肠道内的菌群结构,也抑制有益微生物,使动物体内微生态失调,从而引起一系列并发性疾病。当前,需要寻找高效环保的替代品,益生菌在水产养殖中的开发和利用正应于此,微藻同样具有益生作用。微藻与益生菌的某些作用机制相同,都是通过调节水体的微生态平衡来发挥益生作用。微藻不仅可以直接调节水体的菌群平衡和饲养对象肠道的微生态群落,同时也可以调节轮虫和卤虫等生物饵料的肠道微生态群落[14]。微藻中的活性物质如脂肪酸、多糖、有机酸、维生素和色素等是其发挥抗菌或益生作用的根本所在。如雨生红球藻中分离得到的虾青素可以促进抗体的产生、增强动物的免疫功能[15];从紫球藻(Porphyridium cruentum)中分离的硫酸酯多糖具有抗病毒活性等功能[16]。微藻在生长中还能合成分泌多种抑制细菌生长的类抗生素物质,通过微生态调控作用,提高养殖对象的抗病力,是水产生态调控防病的重要组成部分[17]。
2 饵料微藻高密度养殖海洋微藻繁殖快、营养价值高、易于培养。因此是医药、化妆品、保健品、海产养殖生物饵料、养殖动物饲料添加剂等的重要来源,具有广阔的应用前景。微藻的大规模经济化培养技术一直是国外专家研究的重要课题,相关报道微藻的养殖模式大体分为开放式和封闭式养殖。传统饵料微藻的培养系统主要是室外开放式(如圆池、方池或跑道式等),不同的是在混充气、采光方式等方面略有改变,具有产率低、易污染、种类单一、质量没有保证等缺陷。封闭式养殖系统的条件可控、不易受污染、体系稳定,易实现高密度养殖,但成本较高[18]。
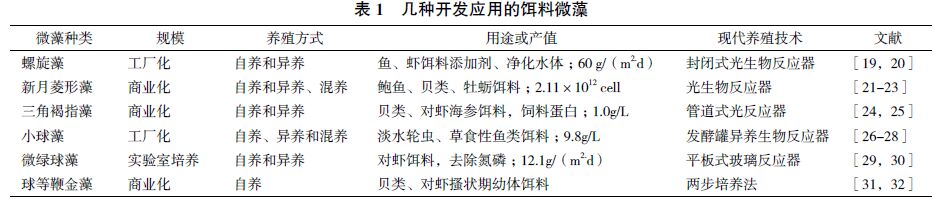
2.1 光生物反应器培养随着我国海产养殖业的快速发展,市场对饵料单胞藻的需求愈来愈大,国内外开展了相关封闭式光生物反应器培养微藻研究(表 1)。然而当前与之相对应的海产动物育苗和养殖所需的饵料微藻的培养主要是在各养殖场简陋的大池中粗放式进行,其产量和质量均难以保证,致使饵料微藻的生产成为海产动物育苗和养殖的瓶颈。因此,研究开发饵料藻的高密度培养技术,从而建立高效、稳定的饵料单胞藻培养系统是解决经济海产动物育苗过程幼体的饵料不足等问题的技术关键,具有重要的市场价值。因此,如何实现微藻的高密度培养,从而提高表 1 几种开发应用的饵料微藻微藻种类规模养殖方式用途或产值现代养殖技术文献螺旋藻工厂化自养和异养鱼、虾饵料添加剂、净化水体;60 g/(m2.d) 封闭式光生物反应器[19, 20]新月菱形藻商业化自养和异养、混养鲍鱼、贝类、牡蛎饵料;2.11×1012 cell 光生物反应器[21, 22, 23]三角褐指藻商业化自养和异养贝类、对虾海参饵料,饲料蛋白;1.0g/L 管道式光反应器[24, 25]小球藻工厂化自养、异养和混养淡水轮虫、草食性鱼类饵料;9.8g/L 发酵罐异养生物反应器[26, 27, 28]微绿球藻实验室培养自养和异养对虾饵料,去除氮磷;12.1g/(m2.d) 平板式玻璃反应器[29, 30]球等鞭金藻商业化 自养贝类、对虾搔状期幼体饵料两步培养法[31, 32]效率、降低生产成本、保证质量,是藻类资源开发利用和海产养殖的关键问题。
近年来光生物反应器在微藻养殖上广泛使用,许多微藻实现高密度养殖。光生物反应器可追溯至1950 年初,最初采用垂直半透明的平坦盘子,两侧光照和搅拌曝气[33]。后进一步完善逐渐成为微藻养殖的良好设备。由于该类型的反应器具有结构简洁,可任意调节放置角度以使其获得最佳的捕光效果,容易加工制造,可以根据需要设计不同的光径和光质,以及操作条件容易控制等优点,使其成为具有良好使用价值的光生物反应器[34]。在海洋微藻培养过程中,单个微藻细胞接受光照的时间和其在培养介质中的运动速度是影响细胞生长的主要限制性因素[35]。实现微藻高密度培养的关键技术是尽可能地提高微藻细胞对光能的吸收和利用效率。当营养、温度及其他培养条件不受限制时,微藻的生长速度和细胞生物量的输出率达到最大,并可以稳定地保持该种状态时的密度为最适培养密度。由于细胞生长的唯一限制条件是对光能的吸收和利用效率,故如何改善在高密度培养条件下光限制作用的同时,又能避免因高光照强度产生的光损害作用将是解决高密度培养的关键[36]。在封闭式光反应器的各种类型中,管式反应器和平板式反应器是效率最高、最常用、规模最大的两种类型,并已实现多种饵料微藻的高密度养殖。平板式光反应器可使微藻的生物量达到50-80 g.m-2.d-1[37]。板式光生物反应器是一种重要的封闭式光生物反应器,其突出的优点不仅光照均匀、通气速率好,产量高,比面值大(表面积与体积的比),是光合效率最高的光生物反应器(Photobioreactor,PBR),而且操作简单,价格低廉适用于微藻饵料的生产[38, 39]。新颖的平板式光生物反应器(PBRS)在特殊混合器(A 型、B 型和C 型)的基础上沿着光梯度增加混合度设计。与没有混合器的控制反应器相比,该新型反应器可以沿着光梯度有效地增加流体速度,光/ 暗(L / D)周期的频率,藻类生长速率。利用此板式反应器培养的蛋白核小球藻最大的生物量浓度与没有混合器的控制反应器相比,A 型、B 型和C 型的反应器分别增加了42.9%、31.9% 和20.9%,可达到1.3 g/L、1.2 g/L 和1.1 g/L[40]。
2.2 异养化培养微藻的传统养殖方式是利用其光合作用,在养殖池中进行自养。利用高盐、高pH 等极端条件来防止杂菌和其他有害微生物的生长,以降低养殖成本。所有的微藻都能进行光合作用,尤其某些微藻是高效的太阳能转换器。在自养培养系统中,微藻利用天然或人工光照以二氧化碳等为碳源,但系统难以突破光衰减瓶颈达到更高密度的培养。一些微藻利用有机物作为碳源和能源可不依赖光照继续生长增殖,实现混养或完全异养[41]。国内外文献报道蓝藻门、隐藻门、金藻门、硅藻门和绿藻门等门中60 多属的近百种微藻可以异养生长[42]。与光能自养培养相比,异养培养增长快,可有效缩短生长周期,且生物量、活性物质产量、脂质含量和氮含量都显著提高,还可避免野生型藻种的污染[43]。异养化微藻可利用现代微生物发酵设备和技术大规模培养,在小球藻的异养培养中已成功应用多年。
2.3 兼养培养兼养也称为混养,是在微藻培养基中添加有机化合物,同时给予光照。使得微藻不仅可以进行光合自养,而且可以利用有机化合物进行异养。光合自养的微藻,若得不到充足的光源就无法维持其最佳的生长速率[44]。已有大量报道,微藻在兼养培养下的细胞浓度、脂质含量以及色素含量等明显优于异养和自养[45]。小球藻在以有机碳为底物的兼养培养条件下,大大提高了生物量和脂质的的产量,增加了有效的C/N 比例。促进了油脂的积累,降低了输出从有机碳转化为脂肪的二氧化碳[46]。
2.4 连续和半连续培养连续培养和半连续培养在微藻的养殖中应用广泛,很多微藻通过这两种养殖模式已实现了高密度的养殖。营养液以一定的速度地加入到反应器中,同时产物或细胞以相同速度排出,反应液体积不变,使藻细胞可长期处于指数生长期以实现高密度养殖。连续培养可缩短培养周期,提高设备的利用率,便于实现自动化管理。连续培养也是研究微藻生长动力学的重要技术手段[47]。
半连续培养即在一次培养的基础上,在藻细胞达到一定浓度后,按一定的时间放出培养液,再加入等量的新鲜培养基。更新速率和更新周期是影响半连续培养生物量的重要因素。对绿色巴夫藻的半连续培养表明:低更新率时随着培养的进行,细胞密度逐渐增加;当更新率高于最适更新率时,细胞密度低于更新起始细胞密度[48]。半连续培养已实现多种微藻的高密度养殖和蛋白质、脂质的富集与高产。如通过半连续培养的模式,在控制氮含量和pH 的条件下,小球藻的脂质含量可高达115 mg.L-1.d-1[49]。孙利芹等通过光生物反应器半连续培养新月菱形藻最大采收量可达2.11×1012 个细胞数[23]。
2.5 种质保存技术藻种退化也是限制微藻高密度养殖的重要制约条件。目前微藻的保种技术主要有超低温保藏、继代培养法和固定化保存。其中超低温保藏技术相对成熟,大多微藻在超低温保存下活力恢复高、保存时间也较长。马志珍等[50]对15 种饵料微藻进行超低温保存发现,三角褐指藻、中骨肋条藻、绿光等鞭金藻等13 种饵料微藻能在较长的时间内保持生命活力。一定时间内复活后均能正常繁殖,只是生长速率稍有差别。但超低温保藏技术投资昂贵。而影响微藻低温保存效果的原因很多,如冷冻剂的选择、温度和降温方式等[51];胡蓓娟等[52]研究8 种微藻固定化和低温弱光保存发现三角褐指藻、小球藻及扁藻均适合固定化法和低温弱光法。而等鞭金藻8701、紫球藻、牟氏角毛藻及茧型藻更适合低温弱光保存。蓝隐藻则适合固定化保存,在固定化保存下其再生能力较强。
目前国内外开发应用的生物饵料品种较少,甚至停留在各养殖场自养自用或依靠捕捞天然浮游生物投喂的低水平阶段,导致种质退化严重,品质和产量均无法保证海产育苗和养殖稳定增长需求的局面;规模生产大多采用室外开放池式培养,培养条件难以控制、细胞生长缓慢、周期长且受季节限制等缺点,导致培养效果较差,细胞密度较低[53];光生物反应器造价高,生产耗能和成本大,规模化扩大较难,需要在高效率低成本上进一步研发。因此,获取优良的藻种和降低光生物反应器的成本,提高微藻的养殖效率是将来实现饵料微藻规模化高密度养殖以取得较高经济效益的关键。
3 展望饵料微藻以其独特的优势在生物饵料中占据基础性地位,且比鱼粉、骨肉粉等动物性饵料优越。它可弥补配方饲料成本高,易污染水域,易引发赤潮等不足,不仅可提高海产养殖育苗成活率和经济效益,且其天然环保,对养殖海产品的食品安全和可持续发展有巨大推动作用。我国丰富的海洋资源为开发饵料资源奠定了得天独厚的基础。随着更多高效光生物反应器的开发,高密度养殖工艺和高品质藻种保存技术的提高,饵料微藻品质和生产成本的更加优化,将促进海产育苗和养殖业更进一步。
| [1] | 孙晓庆, 董树刚. 生物饵料在水产养殖中的综合应用现状[J].齐鲁渔业, 2006, 23(10):31-33. |
| [2] | Neori A.“ Green water” microalgae :the leading sector in worldaquaculture[J]. J Appl Phycol, 2011, 23(1):143-149. |
| [3] | Chauton MS, Reitan KI, Norsker NH, et al. A techno-economicanalysis of industrial production of marine microalgae as a source ofEPA and DHA-rich raw material for aquafeed :Research challengesand possibilities[J]. Aquaculture, 2015, 436 :95-103. |
| [4] | Guo Z, Liu Y, Guo H, et al. Microalgae cultivation using anaquaculture wastewater as growth medium for biomass and biofuelproduction[J]. J Environm Sci, 2013, 25 :S85-S88. |
| [5] | Brown MR, Jeffrey SW, Volkman JK, et al. Nutritional properties ofmicroalgae for mariculture[J]. Aquaculture, 1997, 151(1-4):315-331. |
| [6] | 陈自强, 鹿寿, 廖一波. 微藻饵料对双壳贝类幼体生长影响的研究进展[J]. 科技通报, 2013, 29(7):46-67. |
| [7] | 史会来, 楼宝, 毛国民, 等. 不同饵料对舟山牙鲆仔稚鱼生长发育及存活的影响[J]. 上海水产大学学报, 2008, 17 :680-683. |
| [8] | 卢庆萍. 微藻可作为ω-3 脂肪酸的新来源[J]. 国外畜牧科技,1997, 24(2):25-30. |
| [9] | Sheard NF. Fish consumption and risk of sudden cardiac death[J].Nutr Rev, 1998, 56(6):177-179. |
| [10] | 于道德, 郑永允, 官曙光, 等. 微藻在海水鱼类苗种培育过程中的作用[J]. 海洋通报, 2010, 29(2):235-240. |
| [11] | Glencross BD. Exploring the nutritional demand for essential fattyacids by aquaculture species[J]. Rev Aquacult, 2009, 1(2):71-124. |
| [12] | 钟菲, 黎慧, 仲霞铭, 等. 四种饵料微藻对海水养殖水体N_P的去除研究[J]. 环境科学与技术, 2009, 34(11):113-117. |
| [13] | 沈南南, 李纯厚, 贾晓平, 等. 小球藻与芽孢杆菌对对虾养殖水质调控作用的研究[J]. 海洋水产研究, 2008, 29 :48-52. |
| [14] | Muller-Feuga A. The role of microalgae in aquaculture :situationand trends[J]. J Appl Phycol, 2000, 12(3-5):527-534. |
| [15] | 高桂玲, 成家杨. 雨生红球藻和虾青素的研究[J]. 水产学报,2014, 38(2):297-304. |
| [16] | Raposo MF, de Morais AM, de Morais RM. Influence of sulphateon the composition and antibacterial and antiviral properties of theexopolysaccharide from Porphyridium cruentum[J]. Life Sci,2014, 101(1-2):56-63. |
| [17] | Sommer TR, Potts WT, Morrissy NM. Recent progress in the use ofprocessed microalgae in aquaculture[J]. Hydrobiologia, 1990,204/205 :435-443. |
| [18] | Carvalho AP, Meireles LA, Malcata FX. Microalgal reactors :a review of enclosed system designs and performances[J].Biotechnology Progress, 2006, 22(6):1490-1506. |
| [19] | Zhang L, Chen L, Wang J, et al. Attached cultivation for improvingthe biomass productivity of Spirulina platensis[J]. BioresourceTechnology, 2015, 181 :136-142. |
| [20] | 沈子伟, 陈小江, 郭建林. 螺旋藻在水产养殖中的应用[J].饲料博览, 2007, 2(3):43-45. |
| [21] | Wyckmans M, Chepurnov VA, Vanreusel A, et al. Effects of fooddiversity on diatom selection by harpacticoid copepods[J]. J ExpMar Biol Ecol, 2007, 345(2):119-128. |
| [22] | 黄鸿洲, 康燕玉, 梁君荣, 等. 五种底栖硅藻(鲍鱼饵料)的脂肪酸组成分析[J]. 植物生理学通讯, 2007, 43 :349-354. |
| [23] | 孙利芹, 任莉红, 王长海. 新月菱形藻的光生物反应器半连续培养[J]. 水产科学, 2009, 28(5):246-250. |
| [24] | Silva Benavides AM, Torzillo G, Kopecky J, et al. Productivityand biochemical composition of Phaeodactylum tricornutum(Bacillariophyceae)cultures grown outdoors in tubularphotobioreactors and open ponds[J]. Biomass and Bioenergy,2013, 54 :115-122. |
| [25] | Molina E, Fernandez J, Acien FG, et al. Tubular photobioreactordesign for algal cultures[J]. J Biotechnol, 2001, 92 :113-131.2015,31(9) 陈艳梅等 :海产养殖饵料微藻开发利用进展 65 |
| [26] | Johns G. Microalgal feeds for aquaculture[J]. AppliedPhycology, 1994, 6 :131-141. |
| [27] | Mitra D, van Leeuwen J, Lamsal B. Heterotrophic/mixotrophiccultivation of oleaginous Chlorella vulgaris on industrial coproducts[J]. Algal Research, 2012, 1(1):40-48. |
| [28] | 李金穗, 汪苹, 董黎明. 小球藻高密度培养及油脂提取条件的优化[J]. 微生物学通报, 2012, 39(4):486-494. |
| [29] | Richmond A, Cheng-Wu Z. Optimization of a flat plate glassreactor for mass production of Nannochloropsis sp outdoors[J]. JBiotechnol, 2001, 85(3):259-269. |
| [30] | 郑莲, 黄翔鹄, 刘楚吾, 等. 微绿球藻固定化培养及其对对虾养殖水质调控[J]. 海洋科学, 2005, 29(6):4-8. |
| [31] | 吴电云, 邹宁, 常林, 等. 球等鞭金藻(Isochrysis galbanaParke)的培养研究进展及应用前景[J]. 科技信息, 2010,33 :28-29. |
| [32] | Ra CH, Kang CH, Kim NK, et al. Cultivation of four microalgae forbiomass and oil production using a two-stage culture strategy withsalt stress[J]. Renew Energ, 2015, 80 :117-122. |
| [33] | Chaumont D. Biotechnology of algal biomass production :a reviewof systems for outdoor mass culture[J]. Applied Phycology,1993, 5 :593-604. |
| [34] | Sierra E, Acien FG, Fernandez JM, et al. Characterization of a flatplate photobioreactor for the production of microalgae[J]. ChemEng J, 2008, 138(1-3):136-147. |
| [35] | 孙利芹, 史磊, 王长海. 平板式光生物反应器在饵料微藻培养中的应用[J]. 烟台大学学报, 2007, 20(2):112-115. |
| [36] | Morita M, Watanabe Y, Saiki H. Investigation of photobioreactordesign for enhancing the photosynthetic productivity of microalgae[J]. Biotechnol Bioengineer, 2000, 69(6):693-698. |
| [37] | Liu T, Wang J, Hu Q, et al. Attached cultivation technology ofmicroalgae for efficient biomass feedstock production[J].Bioresource Technology, 2013, 127 :216-222. |
| [38] | Tamburic B, Zemichael FW, Crudge P, et al. Design of a novelflat-plate photobioreactor system for green algal hydrogenproduction[J]. Int J Hydrogen Energ, 2011, 36 :6578-6591. |
| [39] | 许波, 王长海. 微藻的平板式光生物反应器高密度培养[J].食品与发酵工业, 2002, 29(1):36-40. |
| [40] | Huang J, Li Y, Wan M, et al. Novel flat-plate photobioreactors formicroalgae cultivation with special mixers to promote mixing alongthe light gradient[J]. Bioresource Technology, 2014, 159 :8-16. |
| [41] | Kim S, Park JE, Cho YB, et al. Growth rate, organic carbon andnutrient removal rates of Chlorella sorokiniana in autotrophic,heterotrophic and mixotrophic conditions[J]. BioresourceTechnology, 2013, 144 :8-13. |
| [42] | 张帆, 李岿然, 韩笑天, 等. 微藻的异养培养及应用研究[J].海洋科学, 2012, 36(1):117-124. |
| [43] | Perez-Garcia O, Escalante FME, de-Bashan LE, et al. Heterotrophiccultures of microalgae :Metabolism and potential products[J].Water Research, 2011, 45(1):11-36. |
| [44] | 李永富, 李祥蕾, 马冬冬. 光照对光生物反应器中微藻高密度光自养培养的影响[J]. 中国生物工程杂志, 2013, 33(2):103-110. |
| [45] | Cheirsilp B, Torpee S. Enhanced growth and lipid production ofmicroalgae under mixotrophic culture condition :effect of lightintensity, glucose concentration and fed-batch cultivation[J].Bioresource Technology, 2012, 110 :510-516. |
| [46] | Wang Y, Rischer H, Eriksen NT, et al. Mixotrophic continuous flowcultivation of Chlorella protothecoides for lipids[J]. BioresourceTechnology, 2013, 144 :608-614. |
| [47] | Ethier S, Woisard K, Vaughan D, et al. Continuous culture of themicroalgae Schizochytrium limacinum on biodiesel-derived crudeglycerol for producing docosahexaenoic acid[J]. BioresourceTechnology, 2011, 102(1):88-93. |
| [48] | 徐志标, 裴鲁青, 骆其君, 等. 绿色巴夫藻的光生物反应器半连续培养研究[J]. 海洋水产研究, 2005, 26(4):64-69. |
| [49] | Han F, Huang J, Li Y, et al. Enhanced lipid productivity ofChlorella pyrenoidosa through the culture strategy of semicontinuouscultivation with nitrogen limitation and pH control byCO2[J]. Bioresource Technology, 2013, 136 :418-424. |
| [50] | 马志珍, 张继红. 海产饵料微藻超低温保种技术的研究[J].中国水产科学, 1997, 4(4):13-17. |
| [51] | Taylor R, Fletcher RL. Cryopreservation of eukaryotic algae-areview of methodologies[J]. J Appl Phycol, 1999, 10 :481-501. |
| [52] | 胡蓓娟, 王雪青, 吴晶晶, 等. 8 种微藻的保存方法研究[J].海洋湖沼通报, 2008, 1 :58-65. |
| [53] | Roselet F, Maicá P, Martins T, et al. Comparison of open-air andsemi-enclosed cultivation system for massive microalgae productionin sub-tropical and temperate latitudes[J]. Biomass andBioenergy, 2013, 59 :418-424. |