1972 年,Gery 等从人白细胞的培养上清中提取得到一种可溶性物质,起初被命名为淋巴细胞激活因子或内源性热原质、破骨细胞刺激因子、黑素瘤细胞生长抑制因子等,在1979 年被统一命名为白细胞介素-1(IL-1)[1]。IL-1 按其结构不同分为IL-1α和IL-1β。IL-1α 基因定位于2 号染色体,含7 个外显子,IL-1α 的前体是由IL-1α 基因合成的、无信号肽的31 kD 分子。IL-1α 前体被Ca2+ 依赖的钙蛋白激酶降解为17 kD 的成熟体,等电点为5.3,IL-1β是由153 个氨基酸以β- 折叠的形式组成位于2 号染色体,分子量约为17.5 kD,等电点为7.2。IL-1α和β 在同一种属中两者的同源性只有20%-30%,但在不同种属间具有较高同源性,分别为60%-70%和75%-78%[2, 3]。IL-1α 具有很重要的研究意义和应用价值,文献报道IL-1α 在白血病、肝癌、黑色素瘤、胃癌等在内的多种肿瘤中均有表达[4, 5, 6],而其表达机制尚不清楚。临床试验表明,50 ng/kgIL-1α 可治疗骨髓或干细胞移植期间早期血小板的减少[7, 8]。头颈部临床试验III 期发现,IL-1α 具有重要的免疫治疗作用(Cel-Sci Corp)。
目前,IL-1α 主要通过原核表达系统[9]制备,而真核表达系统尚未见报道。由于原核表达体系存在产量低,操作复杂,后期复性困难等问题。为得到表达量高、活性高的IL-1α,更好地研究IL-1α 的特性和功能,本研究利用巴斯德毕赤酵母表达hIL-1α,在1 L 摇瓶规模下对其进行表达条件优化和分离纯化方法探索,同时,对hIL-1α 的活性进行了初步研究。
1 材料与方法 1.1 材料E.coli DH5α 购自武汉晶赛生物工程技术有限公司,毕赤酵母X-33 菌株和pPICZαA 分泌型酵母表达载体购自Invitrogen 公司,重组人白细胞介素-1α基因委托上海生工生物工程有限公司合成,兔多抗人IL-1α 抗体和辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自Invitrogen 公司,人肝癌细胞(Bel-7402)购自中科院上海细胞库,RPIM1640 培养基购自Invitrogen 公司,胎牛血清购自杭州天杭生物科技有限公司,MTT、DMSO 购自Geneview 公司,限制性内切酶SacI、BamHI和EcoRI等购自MBI 公司,Protein Ladder 购自北京康为世纪生物科技有限公司,考马斯亮蓝G-250(分析纯)购自中国医药公司,牛血清白蛋白(生化试剂)购自西安沃尔森生物技术有限公司,其他试剂为国产分析纯。
1.2 方法 1.2.1 人白介素-1α基因(hIL-1α)的设计及载体的构建在GenBank 上搜索得到IL-1α 基因的全序列(NM_000575),通过查阅文献确定IL-1α 蛋白的成熟序列,利用在线序列优化工具对IL-1α 核苷酸序列进行人工优化(http ://www.evolvingcode.net),在不改变氨基酸序列的情况下,密码子替换为高频使用或次高频使用的密码子[10]。人工合成优化(终止序列调整、密码子优化并提高GC 含量)后的IL-1α基因序列连接至T 载体,进行测序,用EcoRⅠ/Not Ⅰ双酶切IL-1α/pUC-T 及质粒pPICZαA,回收目的基因片段和载体片段进行连接,连接产物转化至DH5α 感受态,经蓝白斑筛选阳性克隆、提取质粒进行PCR 和双酶切鉴定,结果正确后进行测序。以上操作由上海生工生物有限公司完成。
1.2.2 酵母分泌型表达载体的转化重组表达质粒pPICZαA/hIL-1α 以SacI 线性化,按毕赤酵母表达手册中电转化方法,将重组表达质粒转至毕赤酵母X-33 感受态细胞,将转化的X-33 涂于含100 μg/mL博来霉素(Zeocin)的YPD 平板上,28℃培养3 d至长出菌落,在YPD 平板上随机挑取8 个克隆,扩大培养后提取酵母基因组DNA,以之为模板,PCR鉴定目的基因是否整合到酵母染色体。
1.2.3 rhIL-1α 摇瓶规模表达随机挑取1 个鉴定正确的菌种接种到10 mL YPG 培养基/50 mL 三角瓶中,于28℃、250 r/min 摇床培养18-24 h,当OD 值达到10 时,取1 mL 菌液,接种到100 mL BMGY 培养基/1 L 三角瓶中,于28℃、280 r/min 继续培养24 h 后,加入终浓度为1%(V/V)的甲醇进行诱导表达,培养条件调整为28℃、200 r/min。每12 h 补加一次甲醇,补加量为发酵液体积的1%(V/V)。分别取诱导24、48、72、96、120、144、168h 的发酵液于12 000 r/min离心15 min,取1 mL 上清进行三氯乙酸(TCA)后,进行15%SDS-PAGE 电泳检测目的蛋白表达。
1.2.4 rhIL-1α 摇瓶发酵规模条件优化 1.2.4.1 最佳体积和转速试验毕赤酵母是好氧微生物,溶解氧浓度对菌体的生长和产物的表达有很大的影响,溶氧过低会抑制菌体生长,过高则会促246 生物技术通报 Biotechnology Bulletin 2015,Vol.31,No.9进菌体的新陈代谢加快,加速菌体死亡,造成蛋白过早降解,不利于目的蛋白积累。转速调节是改变发酵过程中溶解氧的重要方式,较高的转速会提高氧的体积系数,增加发酵液中氧的供给,但同时会加剧细胞的死亡速率,降低产物的表达量[11]。因此,我们设计了以下正交实验研究在1 L 摇瓶条件下rhIL-1α 诱导表达的最佳装液量和转速,参数设置如下:体积设置:100 mL、200 mL、300 mL ;转速设置:100 r/min、200 r/min、300 r/min。以上实验每组设定3 次重复,在诱导最佳时间进行取样,SDSPAGE电泳检测蛋白表达情况,确定诱导表达的最佳体积和转速。
1.2.4.2 最佳pH试验酵母菌生长最适pH 范围为3.0-7.0,pH 过低会影响膜表面电荷的性质及膜的通透性,过高则会抑制菌体中某些酶的活性[12],通过调节初始pH 值来考察pH 对rhIL-1α 表达的影响。本研究设定pH 梯度为:4.5、5.0、5.5、6.0、6.5。每组设定3 次重复。
1.2.4.3 最佳温度试验一般而言,毕赤酵母的最佳生长温度为28-30℃,当温度升高到32℃时毕赤酵母菌株不能正常生长,温度对毕赤酵母发酵产物的活性、发酵液的物理性质及合成方向等有重要的影响。研究表明,在发酵过程中,诱导表达时的温度低于菌体生长时的温度更加有利于蛋白的表达[13]。为此本实验对rhIL-1α 温度优化为20℃、23℃、26℃、29℃。
1.2.4.4 最佳甲醇浓度试验在毕赤酵母诱导表达过程中,甲醇作为诱导剂和碳源双重身份影响目的蛋白的表达,过低或者过高均影响目的蛋白的表达,因此合适的甲醇浓度是提高外源蛋白表达量的又一个关键因素。文献报道[14, 15],甲醇添加量一般为0.5%-1%。为了研究在1 L 摇瓶条件下诱导表达的最佳甲醇浓度,本实验设置了0.25%、0.5%、0.75%、1% 四个梯度。
1.2.5 rhIL-1α 的分离纯化取诱导4 d 的发酵液于4℃,4 000 ×g 离心30 min,收集上清进行10 kD超滤浓缩。取蛋白浓缩液进行DEAE 弱阴离子交换层析柱进行纯化。用buffer A(10 mmol/L Na2HPO4pH8.0)平衡柱子,样品以1 mL/min 的流速流穿离子交换树脂,然后用buffer B(buffer A 中含有0-500mmol/L NaCl pH8.0)进行梯度洗脱,紫外检测仪监控,收集各洗脱峰,SDS-PAGE 进行检测。
1.2.6 rhIL-1α 蛋白免疫印迹检测蛋白免疫印迹按Towbin 等方法[16]进行。rhIL-1α 进行SDS-PAGE 后,将rhIL-1α 转移到PVDF 膜上,用IL-1α 兔多抗一抗室温孵育1 h,TBST 洗涤3 次,再与辣根过氧化物酶(HRP)标记的山羊抗兔二抗室温孵育1 h,TBST洗涤3 次,超敏ECL 底物发光显色,用Typhoon7500 扫描仪和图像定量软件进行定量分析。
1.2.7 考马斯亮蓝法(Bradford)测定蛋白浓度以纯的牛血清白蛋白作为标准品,取0、0.1、0.2、0.4、0.6、0.8 mL 标准品于10 mL 试管中,加水至1 mL,然后加入4 mL 的G-250 溶液,混匀,静止10 min,在595 nm 处测其吸光值制定标准曲线[17]。取样品溶液0.2 mL,做3 个重复,以水作空白对照,测其吸光值,并计算蛋白浓度。
1.2.8 rhIL-1α 的生物学活性检测人肝癌细胞7402(Bel-7402)于含10% 胎牛血清的RPMI-1640 培养基,37℃、5%CO2、饱和湿度条件下培养,取对数生长期的细胞,于3 000 个/ 孔接种至96 孔板中培养12 h,待细胞贴壁后弃培养基,更换含有不同浓度rhIL-1α(0、5、10、15、20 ng/mL)的培养基,每组设3 个平行孔。继续培养72 h 后,每孔加入5 mg/mL MTT溶液10 μL,于培养箱中培养4 h,弃掉培养基,每孔加入DMSO 150 μL,摇动培养板5 min,使细胞内结晶全部溶解,用Biotek reader 酶标仪在490 nm 处测其吸收值,检测rhIL-1α 对Bel-7402 细胞增殖的影响。
2 结果 2.1 重组质粒pPICZαA/hIL-1α的构建和鉴定用碱裂解法提取hIL-1α 质粒,并分别进行单双酶切和PCR 扩增,1% 的琼脂糖凝胶电泳鉴定结果(图 1)显示,重组质粒经SacⅠ单酶切后出现一条5 kb左右条带。BamH I 和EcoRⅠ双酶切后出现4 kb 和500 bp 左右的2 条带。用载体通用引物进行PCR 扩增出现一条1 kb 左右的特异性扩增条带,与预期片段大小一致,经上海生工生物公司测序证明其序列正确。

|
| M :10000 Marker ;1 :IL-1α/pPICZαA 的PCR ;2 :IL-1α/pPICZαA 的双酶切; 3 :IL-1α/pPICZαA 的单酶切;4 :IL-1α/pPICZαA 的质粒 图 1 rhIL-1α 三种不同表达载体质粒鉴定结果 |
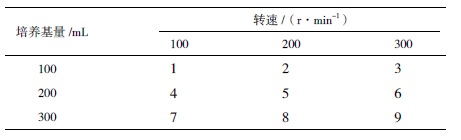
重组表达质粒pPICZαA/hIL-1α 转化毕赤酵母菌X-33 后,在YPD 平板上随机挑取8 个克隆扩大培养,提取基因组后进行PCR 扩增,产物经琼脂糖凝胶电泳分析(图 2-A),8 个转化子在1 000 bp 位置均出现预期条带,证明hIL-1α 基因已经整合到酵母基因组中。对鉴定正确的重组菌株进行1L 规模摇瓶筛选,取不同时间表达上清进行SDS-PAGE 检测和Westernblot 鉴定,结果(图 2-B)显示,在相对分子质量约17 kD 处出现考马斯染色条带,与hIL-1α 的分子量一致,且在甲醇诱导第4 天表达量最高。经Westernblot 鉴定(图 2-C),目的条带均有阳性反应,说明rhIL-1α 正确表达。
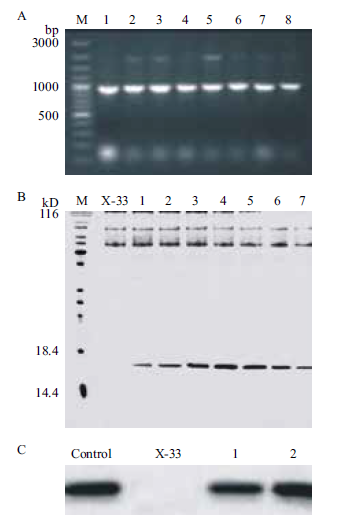
2.3 rhIL-1α摇瓶条件的优化 2.3.1 培养基体积和转速对rhIL-1α 的影响取X-33/pPICZαA/hIL-1α 菌株进行活化培养,当OD600值达到10 时,将菌种分别接种于不同体积BMGY(100、200、300 mL)培养基中,于28℃,280 r/min摇床振荡培养至OD600=2-6,分别取3 瓶含100、200、300 mL 培养基的三角瓶放于100 r/min 的摇床培养;剩余6 瓶分别放于200 r/min 和300 r/min摇床培养(表 1),每隔12 h 添加甲醇至终浓度为1%,诱导4 d,取1 mL 上清进行TCA 处理后,SDSPAGE电泳检测(图 3)发现,随着体积的增大,蛋白表达量降低,当转速为200 r/min 时,蛋白表达量优于100 r/min 和300 r/min。rhIL-1α 发酵培养最佳体积和转速为100 mL/L,200 r/min。
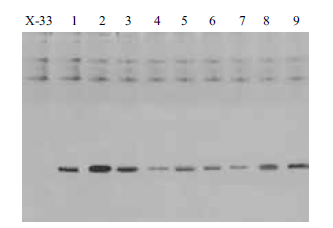
2.3.2 pH 对rhIL-1α表达的影响分别取1 mL 菌液,接种到pH 为4.5、5.0、5.5、6.0、6.5 的BMGY 培养基进行培养,SDS-PAGE 检测(图 4)表明,当pH <5.5 时,随着pH 的降低,蛋白的表达量逐渐下降,当pH > 5.5 时,随着pH 的增大,蛋白的表达量显著降低,在pH5.5 时,rhIL-1α 的表达量最高。
|
| (A)PCR 鉴定,M :3000marker,1-8 :随机挑取8 个克隆;(B)SDS-PAGE,M :蛋白marker,X-33 :空载,1-7 :24、48、72、96、120、144、168 hrhIL-1α 表达量;(C)Western blot 鉴定,Control :阳性对照(大鼠肝组织),X-33 :空载,1,2 :rhIL-1α 图 2 rhIL-1α 鉴定结果 |
|
| X-33 :对照;1 :培养基100 mL,100 r/min ;2 :100 mL,200 r/min ;3 :100mL,300 r/min ;4 :200 mL,100 r/min ;5 :200 mL,200 r/min,6 :200 mL,300 r/min,7:300 mL,100 r/min,8:300 mL,200 r/min,9:300 mL,300 r/min 图 3 培养基体积和转速对rhIL-1α 表达的影响 |
|
| 图 4 不同pH 对rhIL-1α 的影响 |
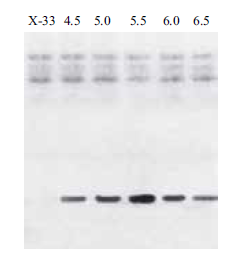
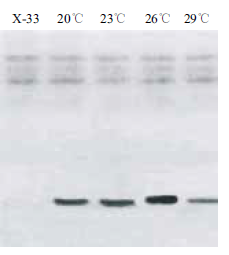
rhIL-1α 培养进入诱导阶段时,培养温度分别更改为20、23、26、29℃,诱导96 h 后,取发酵液进行SDS-PAGE 检测,结果(图 5)表明,当温度为29℃时,重组蛋白的表达量最低,当温度为26℃时,rhIL-1α 表达量最高。
|
| 图 5 不同温度对rhIL-1α 的表达影响 |
rhIL-1α 进入诱导期后,在26℃,200 r/min 下培养,甲醇浓度分别设为0.25%、0.5%、0.75%、1.0%,结果如图 6所示,随着甲醇浓度的增加,重组蛋白的表达量随着提高,当添加甲醇浓度为1% 时,rhIL-1α 的产量达到最高。
2.4 rhIL-1α的分离纯化取诱导4 d 发酵液,经过离心→ 10 kD 膜包浓缩→ DEAE 弱阴离子交换层析方法。收集各洗脱峰,SDS-PAGE 检测发现,在100 mm NaCl 处可以洗脱下单一的目的蛋白(图 7)。蛋白纯度为95%,经Bradford 法测定,蛋白收率为40% 左右。

|
| 图 6 不同甲醇浓度对rhIL-1α的影响 |

|
| 图 7 rhIL-1α 各步分离纯化SDS-PAGE 分析 |
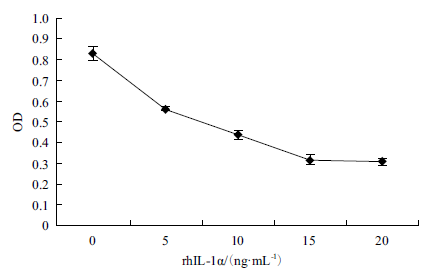
不同浓度的rhIL-1α 处理Bel-7402 细胞后,MTT法检测细胞的活力,结果如图 8 所示,10 ng/mLrhIL-1α 处理细胞72 h 后,与对照比有显著的差异(P<0.05),当rhIL-1α 的浓度为15、20 ng/mL 时,与对照比有极显著差异(P<0.01)(图 8),表明rhIL-1α 对人肝癌细胞7402 具有一定的杀伤力,能抑制癌细胞的增殖生长。
|
| 图 8 不同浓度rhIL-1α 对Bel-7402 细胞的影响 |
IL-1α 作为重要的促炎性细胞因子参与多种生理活动,如修复、增殖、凋亡、细胞迁移、分化、细胞坏死等,在角膜受损研究中发现,IL-1α 参与到NF-κB 信号通路调控受损角膜的修复[18]。在非小细胞肺癌的胸腔积液中IL-1α 处于一个高表达水平,它可作为潜在诊断非小细胞肺癌的生物标志物[19, 20]。研究表明,当人永生化角质形成细胞(HaCaT)受中波紫外线(UVB)照射时,细胞分泌大量的IL-1α,IL-1α 下调HaCaT 细胞水通道蛋白3(AQP3)的表达,这一作用可能和皮肤光老化的发生有关[21]。李树等[22]的研究发现,在小鼠皮肤受损修复过程中,IL-1α 在受损早期有一次表达高峰,IL-1α 可作为损伤早期时间推断的一个指标。因此,IL-1α 在组织受损、肿瘤、自身免疫性疾病等方面具有重要的潜在临床研究价值。
本实验选用毕赤酵母野生型X-33 菌株,它具有生命力强、无回复突变、分泌能力强、能在YPD和最小规模培养基中生长等优点[23]。根据酵母在密码子上使用偏爱性,在不改变氨基酸序列的情况下,通过调整终止序列、提高GC 含量对hIL-1α 序列进行优化,把hIL-1α 的成熟肽连在α- 交配因子信号肽的C 端,AOX1 启动子诱导hIL-1α 在毕赤酵母中分泌表达。蛋白产量与发酵条件密切相关,为此,本实验分别从装液量、转速、温度、pH、甲醇浓度5 个方面对rhIL-1α 的发酵条件进行优化。研究表明,装液量和转速直接影响培养基中溶解氧的浓度,在发酵过程中,溶解氧浓度对外源蛋白的表达具有十分重要的影响,过高或过低都不利于蛋白的表达[24, 25]。实验结果显示,在装液量为100 mL/1 L,转速200 r/min 时,蛋白表达量最高,过多的装液量和过高的转速均不利于蛋白的表达。也有研究表明,适当的升高温度,有利于细胞的生长代谢和蛋白的表达,但温度过高会使菌体提早衰老,降低蛋白的表达量[26]。本实验从20-29℃对rhIL-1α 的表达进行研究发现,随着温度的升高,蛋白产量增加,当温度> 26℃时,蛋白产量随着下降。因此,在诱导阶段适当的降低温度可以减少菌体的死亡,同时也可保护蛋白不被降解[27]。pH 是影响蛋白表达的又一关键参数,适宜的pH 不仅有利于蛋白的表达,同时也可防止蛋白酶降解,易于后续的纯化工作。结果表明,pH 为5.5 时,最有利于rhIL-1α 的表达。在发酵过程中,定时定量地补加甲醇对蛋白的表达具有至关重要的影响[14, 25]。过低不够蛋白的表达,过高则会导致菌体死亡,降低蛋白产量。本研究发现,随着甲醇浓度的升高,蛋白产量随着增加,在1%时产量达到最多。
本研究用毕赤酵母表达hIL-1α,仅用一步层析纯化,获得纯度高达95% 以上的重组蛋白。与原核表达体系相比,减少了破壁、复性等复杂的纯化步骤,提高蛋白的收率,降低了生产成本。对纯化后的rhIL-1α 进行活性检测发现,rhIL-1α 能抑制Bel-7402 细胞的增殖,与文献报道一致[21, 28, 29]。本研究为深入探讨IL-1α 功能机理提供了良好的条件,同时也为其产业化生产奠定了坚实的基础。
4 结论成功构建了rhIL-1α 的毕赤酵母表达体系,对其摇瓶发酵条件进行了优化,最适的发酵条件为装液量为100 mL/1 L 摇瓶、初始pH 为5.5、诱导转速200 r/min,诱导温度为26℃,甲醇添加量为1%,每12 h 补加一次,诱导4 d,最终获得rhIL-1α 的最高产量约30 mg/L,较优化前提高了47.9%。用DEAE弱阴离子交换层析一步法对其进行纯化,得到纯度高达95%,得率约40%,能抑制Bel-7402 细胞增殖的rhIL-1α。
| [1] | Dinarello CA. IL-1 : disoveries, controversies and future directions[J]. Eur J Immunol, 2010, 40(3): 599-606. |
| [2] | Sims JE, March CJ, Cosman D, et al. cDNA expression cloning of theIL-1 receptor, a member of the immunoglobulin superfamily[J].Science, 1988, 241(4865): 585-589. |
| [3] | Chizzonite R, Truitt T, Kilian PL, et al. Two high-affinity interleukin1 receptors represent separate gene products[J]. Proc Natl AcadUSA, 1989, 86(20): 8029-8033. |
| [4] | 刘海燕. 抗人IL-1α 单克隆抗体及其应用: 中国, 20111011425-35. 9[P]. 2011-05-30. |
| [5] | Apte RN, Voronov E. Is interleukin-l a good or bad‘guy’in tumorimmunobiology and imnmnotherapy?[J]. Immunol Rev, 2008,222 : 222-241. |
| [6] | DinareUo CA. Immunological and inflammatory functions of theinterleukin-1 family[J]. Annu Rev Immunol, 2009, 27 : 519-550. |
| [7] | Dinarello CA, In Durum SK, Oppenheim JJ, Feldmann M. Cytokinereference : a compendium of cytokines and other mediators of hostdefense[M]. Boston : Academic Press, 2001 : 307-318. |
| [8] | Schoch P, Pomytkin I. A pilot study on the effect of interleukin-1alpha on collagen deposition in aging skin[D]. Presentationabstract 12th Anti-Aging Medicine World Congress, 2014. |
| [9] | 林丹丹, 刘春亮, 包光明, 等. 小鼠IL-1α 多克隆抗体的制备及应用[J]. 细胞与分子免疫学杂志, 2011, 27(9): 1007-8738. |
| [10] | Ari H, Markus A. Intracellular functions of N-linked glycans[J].Science, 2001, 291 : 2364- 2369. |
| [11] | 苟万晓, 卫红伟, 胡元森, 等. 毕赤酵母发酵生产甲醇蛋白工艺条件的优化[J]. 中国酿造, 2014, 33(7): 0254-5071. |
| [12] | Charoenrat T, Ketudat M, Stendahl AH . Oxygen-limited fed-batchprocess : an altemative control for Pichia pastoris recombinantprotein processes[J]. Bioproc Biosyst Eng, 2005, 27(6): 399-406. |
| [13] | 娄瑞娟, 罗立龙, 张霞, 等. 巴斯德毕赤酵母表达系统的研究进展和前景展望[J]. 生物学杂志, 2010, 27(5): 1008-9635. |
| [14] | 闵兆升, 郭会明, 颜旭, 等. 巴斯德毕赤酵母(P. pastoris)高密度发酵研究进展[J]. 生物技术通报, 2014(3): 42-49. |
| [15] | 刘红, 潘红春, 蔡绍皙, 等. 发酵条件对毕赤酵母表达重组人干扰素糖基化的影响[J]. 生物工程学报, 2005, 21(1): 107- 112. |
| [16] | Ronanos MA, Clare JJ, Beesleyk KM, et al. Recombinant borde tellapertussis pertactin(p69)from the yeast Pichia pastoris : Highlevelproduction and immun ologica l properties[J]. Vaccine,1991, 9 : 901-906. |
| [17] | 孙士青, 王少杰, 李秋顺, 等. 考马斯亮蓝法快速测定乳品中蛋白质含量[J]. 山东科学, 2011, 24(6): 6-14. |
| [18] | Ming WP, Li MY, Dan J, et al. Inhibition of RAP1 enhances cornealrecovery following alkali injury[J]. iOVS, 2015, 56(2): 711-721. |
| [19] | Li YY, Lian HN, Jia QZ, et al. Proteome screening of pleuraleffusions identifies IL1A as a diagnostic biomarker for non-smallcell lung cancer[J]. Biochemical and Biophysical ResearchCommunications, 2015, 457(2): 177-182. |
| [20] | Rider P, Carmi Y, Voronov, et al. Interleukin-1alpha[J]. SeminImmunol, 2013, 25(6): 430-438. |
| [21] | 闫学文, 单士军. 白细胞介素1α 对人永生化角质形成细胞、水通道蛋白3 表达的调节[J]. 中国中西医结合皮肤性病学杂志, 2012, 11(4): 211-214. |
| [22] | 李树, 王杰. 小鼠皮肤损伤修复过程中白细胞介素1α 和白细胞介素1β 变化与损伤时间是关系[J]. 中国组织工程研究与临床康复, 2008, 12(15): 2879-2882. |
| [23] | Sygmund C, Gutmann A, Krondorfer I, et al. Simple and efficientexpression of Agaricus meleagris pyranose dehydrogenase in Pichiapastoris[J]. Appl Microbiol Biotechnol, 2012, 94(3): 695-704. |
| [24] | 王治, 郑甲, 唐诗哲, 等. 外源蛋白在巴斯德毕赤酵母中高效分泌表达的前沿技术[J]. 基因组学与应用生物学, 2014, 33(3): 689-694. |
| [25] | Zhu T, You L, Gong F, et al. Combinatorial strategy of sorbitolfeeding and low-temperature induction leads to high-levelproduction of alkaline β-mannanase in Pichia pastoris[J].Enzyme and Microbial Technology, 2011, 49(4): 407-412. |
| [26] | 高敏杰, 史仲平. 甲醇营养型重组毕赤酵母高效表达外源蛋白过程的控制与优化[J]. 中国化学工程学报, 2013, 21(2): 216-226. |
| [27] | Çelik E, Çalık P, Oliver SG. Metabolic flux analysis for recombinantprotein production by Pichia pastoris using dual carbon sources : Effects of methanol feeding rate[J]. Biotechnology andBioengineering, 2010, 105(2): 317-329. |
| [28] | Swati A, Deepali C, Vijay C, et al. Polymorphisms in IL-1gene cluster and its association with the risk of perinatal HIVtransmission, in an Indian cohort[J]. Immunology Letters, 2013,153 : 1-8. |
| [29] | Georgia P, Hilary ODC, Stephen GH, et al. IL1 A and IL4signalling in human ovarian surface epithelial cells[J]. Journalof Endocrinology, 2011, 211 : 273-283. |