牦牛是一种生活在高海拔地区的重要动物资源,品种原始,生产能力低下,这主要与其繁殖力较低有关,牦牛的实际繁殖水平一般仅为两年一胎或三年两胎[1]。由于其繁殖能力不强,因此有关如何提高牦牛繁殖率的研究将会成为当今和以后发展的趋势。目前,日趋成熟的体外受精和胚胎移植技术在该方面已经展开了应用。
黄体生成素(Luteinizing hormone,LH) 是动物体内重要的垂体促性腺激素,其对黄体的发育和维持起着重要作用,但其作用必须在黄体生成素受体(Luteinizing hormone receptor,LHR)的介导下发挥,因此对LHR 的研究是十分必要的。LHR 属于G 蛋白偶联受体超家族中的糖蛋白亚家族成员,其氨基酸序列和结构有高度同源性,具有7 个跨膜区、4 个胞质区以及由3 个环状区和N 端组成的细胞外区[2]。余四九等[3]对牦牛的发情特性及生殖激素含量的变化进行了系统的研究发现,LH 峰出现在发情开始后14 h 左右,提示LHR 基因在此时表达应该也会较高。阿依木古丽等[4]对发情周期不同阶段牦牛子宫中黄体生成素受体的表达变化进行了相关研究,结果表明发情周期不同阶段子宫中促黄体素受体的表达量是不同的,说明LHR 参与了发情周期不同阶段牦牛子宫功能变化的调控。李广君等[5]对济宁青山羊发情周期不同阶段LHR 在输卵管的分布及其mRNA 的表达进行过相关研究,发现LHR 阳性物质存在于发情周期各阶段的输卵管各段,且发情周期不同阶段mRNA 在输卵管各阶段的表达量也不相同,说明LH 对输卵管的功能具有一定的调节作用。但有关LHR 基因在牦牛发情周期不同阶段输卵管、卵巢、子宫中的表达差异比较尚无报道。鉴于此,本研究对LHR 基因在牦牛发情周期不同阶段输卵管、卵巢、子宫中的含量进行检测,分析其表达模式,为进一步揭示LHR 在牦牛生殖过程中发挥的作用奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 组织青海省西宁市定点屠宰场。分离屠宰后的卵巢,根据卵巢判断发情周期所处阶段,分别取卵泡期、黄体期雌性牦牛卵巢、输卵管、子宫组织样,用锡箔纸包好后放入事先标记好的布袋中,立即投入液氮中带回实验室,- 80℃ 保存备用。
1.1.2 主要试剂及仪器TransZol Up、TransStartTMTop Green qPCR SuperMix 均购自 TransGen Biotech 公司,RNA 反转录试剂盒购自Promega 公司;引物由北京华大基因研究中心合成;普通PCR 仪、凝胶成像系统均由Bio-Rad 公司提供,实时荧光定量PCR仪由 Roche 公司提供,超微量分光光度计由Implen公司提供。
1.2 方法 1.2.1 引物设计参照GenBank 发表的黄牛LHR基因序列(GenBank 登录号为AF491303 ;引物1和引物2) 和GAPDH 基因序列(GenBank 登录号为NM_001034034.2,引物3,作为普通PCR 内参引物),牦牛β-actin 基因序列(GenBank 登录号为DQ838049.1,作为RT-qPCR 内参基因),应用Primer5.0 软件设计3 对特异性引物(表 1)。
用TransZol Up 试剂提取不同时期牦牛卵巢、输卵管、子宫总RNA,然后取不同组织的总RNA 5 μL,用1% 琼脂糖凝胶电泳鉴定其完整性。利用超微量分光光度计测定所提取RNA 的OD260nm 与OD280nm 的比值,判断其比值是否落在1.8-2.0 之间,同时可得到RNA 的浓度值。根据测定结果筛选出合格的RNA 样品,然后调节这些RNA 的浓度至400 ng/μL 以进行下一步实验。最后按照RNA 反转录试剂盒说明书进行cDNA 第一链的合成,产物于-20℃保存。
1.2.3 RT-PCR 扩增反应体系、扩增程序及PCR 产物的检测以上述实验获得的cDNA 为模板,进行LHR 和β-actin 基因的PCR 扩增。优化后的PCR 反应条件为(20 μL 反应体系):Go Taq Green MasterMix 10 μL,上下游引物各0.5 μL,cDNA 1 μL,Nuclease-Free Water 8 μL。扩增程序:95℃ 2 min ;95℃ 30 s,60℃ 30 s,72℃ 30 s,3 个循环;72℃ 10234 生物技术通报 Biotechnology Bulletin 2015,Vol.31,No.9min。用1% 琼脂糖凝胶电泳检测PCR 产物,凝胶成像系统采集图像。随后将目的条带用胶回收试剂盒回收纯化,将纯化好的cDNA 与pMDR18-T vector 连接,并转化到JM109 感受态细胞中,将菌液送华大基因公司测序,使用DNAMAN 和MEGA5 软件进行序列组装,利用NCBI 的BLAST 软件对测序后的目的基因进行比对分析。
1.2.4 发情周期不同阶段牦牛卵巢、输卵管、子宫中LHR 基因的检测以上述实验获得的cDNA 为模板,进行LHR 和β-actin 基因的实时荧光定量PCR(RT-qPCR)扩增。优化后的反应条件为(20 μL 体系):2×TransStart Top Green qPCR SuperMix 10 μL,上下游引物各0.5 μL,cDNA 1 μL,ddH2O 8 μL。扩增程序:95℃ 5 min,95℃ 10 s,60℃ 15 s,72℃ 15s,45 个循环;95℃ 5 s,65℃ 1 min ;40℃ 30 s。每个样品重复3 次。待上述反应结束后,通过得到的溶解曲线来判定RT-qPCR 反应的特异性;获得每个样品的CT 值,运用2-ΔΔCT 法计算LHR 基因在各个组织的相对表达量,实验数据用x±s 表示。
2 结果 2.1 牦牛发情周期不同阶段卵巢、输卵管、子宫总RNA的提取及检测牦牛发情周期不同阶段卵巢见图 1。1% 琼脂糖凝胶电泳检测所提取总RNA 的完整性。通过凝胶成像系统采集的图像(图 2)可以清楚地看到28SrRNA、18S rRNA,5S rRNA 几乎看不到,说明所提取的总RNA 信息含量完整,无降解。通过超微量分光光度计所测得的样品OD260nm/OD280nm 比值均在1.8-2.0 之间,说明所提取的总RNA 纯度高,无蛋白质、基因组或者其他杂质的污染,可用于后续实验。

|
| 图 1 牦牛发情周期不同阶段卵巢 |
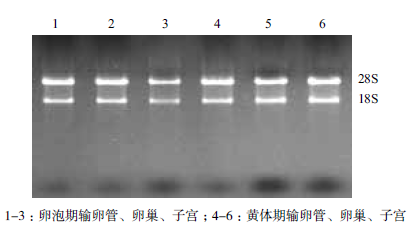
|
| 图 2 总RNA 琼脂糖凝胶电泳结果 |
LHR 和GAPDH 基因PCR 扩增产物通过1% 琼脂糖凝胶电泳检测后,可见在128 bp 和119 bp 处有明显的条带(图 3),与预期片段长度相符。经测序后得到128 bp 和119 bp 两段序列,Blast 比对分析表明,这两段序列可在GenBank 中公布的黄牛LHR 和GAPDH 序列中找到,其位置也与预期相符,并且与黄牛LHR 的同源性高达99%。用BLAST 和MEGA5软件对比并剪切编辑得到一条长128 bp 目的基因部分序列,牦牛LHR 基因的部分序列见图 4。结果说明可以运用RT-qPCR 法测定牦牛发情周期不同阶段内生殖器中LHR 的表达差异。

|
| 图 3 引物1(A)和引物3(B)RT-PCR 产物琼脂糖凝胶电泳结果 |
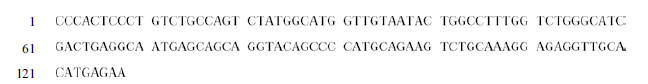
|
| 图 4 牦牛LHR 基因的部分序列 |
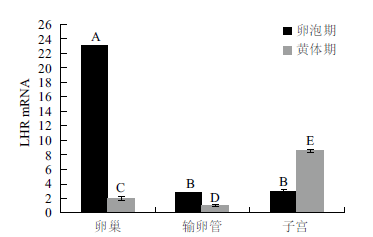
对RT-qPCR 结果分析(图 5,图 6,表 2)得出,LHR 和β-actin PCR 产物的Tm 值都很均一,熔解曲线上只有单一锐利的峰,表明在实时荧光定量PCR 过程中,荧光强度均来自特异性扩增产物,由此排除了引物二聚体和非特异性扩增产物的形成对试验结果的影响。由实验结果可知,LHR 基因在黄体期输卵管中的表达量最低,将黄体期输卵管LHR 基因的表达量选为对照组,因此,ΔΔCT=ΔCT 样品- ΔCT 黄体期输卵管。随着发情周期的不同,LHR基因在生殖器官中的表达量也存在差异。卵泡期,LHR 基因在卵巢中的表达量最高,与输卵管和子宫中的表达量差异显著(P < 0.05),在输卵管和子宫中的表达量差异不显著(P > 0.05);黄体期,LHR基因在子宫中的表达量最高,其次分别为卵巢、输卵管,三者相互之间LHR 基因的表达量存在差异显著性(P < 0.05)。卵巢中卵泡期LHR 基因的表达量高于黄体期,输卵管中LHR 基因的表达量在卵泡期略高于黄体期,子宫中黄体期LHR 基因的表达量略高于卵泡期。结果表明,LHR 基因在牦牛发情周期不同阶段对生殖系统具有重要的调节作用。

|
| 图 5 LHR 和β-actin 基因的熔解曲线 |
|
| 图 6 RT-qPCR 检测牦牛输卵管、卵巢、子宫中LHR 基因的表达结果 |
黄体生成素(LH)是哺乳动物生殖调控的重要激素,生理作用通过其受体(LHR)介导,因此有关LHR 基因的研究具有十分重要的意义。近年来,人们发现LH 除了影响传统的性腺靶器官外,LHR还存在于整个生殖道中,其对生殖道功能的发挥也起着重要的调控作用。李成娇等[6]通过免疫组化实验研究发现,在水牛的卵泡期和黄体期内生殖器官中,LHR 的表达量存在差异,卵巢中卵泡期LHR的表达量均高于黄体期;子宫中LHR 的表达量黄体期高于卵泡期;而输卵管并没有显著差异。本实验通过实时荧光定量PCR 法检测了LHR 基因在牦牛发情周期不同阶段输卵管、卵巢、子宫中的表达量,结果显示,卵巢中卵泡期LHR 基因的表达量高于黄体期,子宫中LHR 基因的表达量黄体期高于卵泡期,而输卵管中LHR 基因的表达量卵泡期略高于黄体期,与上述免疫组化实验结果基本相符。
卵巢是促性腺激素发挥作用的重要场所,是雌性动物的性腺。宋翔等[7]研究发现高繁山羊卵巢LHR 基因的表达量在发情前期和发情期高于发情后期和间情期,本研究结果与此相符。有研究表明卵泡发育后期由FSH 依赖型转向LH 依赖型,排卵前,颗粒细胞中LHR 数量达到最高水平,LH 峰后,卵泡黄体化依赖于颗粒细胞膜上的LHR[8]。本研究发现LHR 基因在牦牛卵巢中卵泡期的表达量最高,说明LHR 对卵泡的发育具有重要的调节作用。Abdennebi 等[9]研究发现多胎的罗曼诺夫绵羊LHRmRNA 在小卵泡的颗粒细胞和内膜细胞的表达量均高于法兰西岛绵羊,卢晟盛等[10]实验证实,当FSH 和LH 的添加浓度处于 0.25-2 μg/mL 时,FSH和LH 无论以何种浓度组合,均极显著促进猪卵母细胞的核成熟,可见卵巢中LHR mRNA 的表达量与繁殖率可能存在一定的关系。Saeki 等[11]对牛和唐杰等[12]对翼中山羊的研究也证实了这一点。
Derecka 等[13]研究发现在猪输卵管的早期黄体期和卵泡期存在LHR 转录物。Zheng 等[14] 在鼠的发情周期抽取的样本中发现LHR 的存在。Gawronska 等[15]研究发现在妇女月经周期期间,输卵管的LHR 浓度发生变化,分泌期要比增殖期含更高LHR。李广君等[5]的研究中表明济宁青山羊输卵管LHR 基因的表达量在发情前期和发情期高于发情后期和间情期,王丽等[16]在对沂蒙黑山羊发情周期中输卵管LHR 基因的表达差异研究中得到了同样的结果,本实验结果与上述研究结果是相符的,所以可以肯定的是LHR 对输卵管的功能活动具有重要的调节作用。
Friedman 等[17]研究发现LHR 及其mRNA 在牛子宫中发情周期不同阶段表达量存在差异,表明LH与LHR 处于动态的平衡过程,LHR 基因在不同时期的表达量及功能是不同的。阿依木古丽等[4]研究发现牦牛子宫中LHR 蛋白的表达量在发情前期和发情期低于发情后期和发情间期,石中强等[18]对沂蒙黑山羊子宫中LHR 基因在发情周期内表达规律的研究中发现了同样的结果,本实验结果与此是相符的。蒋进等[19]研究发现豚鼠子宫LHR mRNA 在发情周期第0、4 天表达水平较低,第12 天升至最高,说明发情周期不同时期的LHR mRNA 表达呈现明显的规律性,这与本研究结果是相符的。另外,Shemesh等[20]研究发现牛子宫静脉在整个发情周期都存在LHR mRNA 的表达及LHR 蛋白的合成,而在黄体期和排卵后期的LHR 含量较少。申颖等 [21]的研究中发现LHR 基因在济宁青山羊整个发情周期的子宫中都有表达,其中,发情期的表达水平最低,随之在间情期升至最高值,而后在发情前期降低。Rzucidlo等[22]对猪以及Sawitzke 等[23]对兔和鼠的研究结果也证实了相同的变化规律。
总之,LHR 是LH 发挥正常生理功能的重要结合位点。牦牛在发情周期不同阶段生殖系统中LHR基因的表达存在差异,说明LHR 在牦牛发情周期不同阶段对生殖系统发挥着重要的调节作用。有关牦牛LHR 基因表达的研究可以为提高牦牛繁殖率奠定重要的基础,为进一步探讨LHR 对牦牛生殖机能的调控规律提供了重要的理论依据。
4 结论牦牛输卵管、卵巢、子宫均具有表达LHR 基因的特性,且发情周期不同阶段表达量具有差异,卵泡期卵巢中表达量最高,黄体期子宫中表达量最高,说明LHR 在牦牛的繁殖过程中对生殖系统具有重要的调节作用。
| [1] | Li C, Wiener G. The yak[M]. RAP publication, 1995. |
| [2] | Fanelli F, Puett D. Structural aspects of luteinizing hormonereceptor[J]. Endocrine, 2002, 18(3): 285-293. |
| [3] | 余四九, 陈北亨. 牦牛发情特性及生殖激素含量的变化[J].动物学报, 1997, 43(2): 178-183. |
| [4] | 阿依木古丽, 蔡勇, 崔燕, 等. 发情周期不同阶段牦牛子宫中黄体生成素受体的表达变化[J]. 畜牧兽医学报, 2011, 42(5): 729-733. |
| [5] | 李广君, 王慧, 王树迎, 等. 济宁青山羊发情周期不同阶段LHR 在输卵管的分布及其mRNA 表达[J]. 中国农业科学,2011, 44(15): 3235-3245. |
| [6] | 李成娇, 朱晓玲, 李万宏, 等. 促性腺激素受体在雌性水牛生殖器官的表达定位研究[J]. 中国畜牧兽医, 2011, 38(4): 66-69. |
| [7] | 宋翔. 高繁山羊发情周期中卵巢内 LHR 的定位及其 mRNA 表达规律研究[D]. 泰安: 山东农业大学, 2009. |
| [8] | McRae R, Johnston H, Mihm M, et al. Changes in mouse granulosacell gene expression during early luteinization[J]. Endocrinology,2005, 146(1): 309-317. |
| [9] | Abdennebi L, Monget P, Pisselet C, et al. Comparative expressionof luteinizing hormone and follicle-stimulating hormone receptorsin ovarian follicles from high and low prolific sheep breeds[J].Biology of Reproduction, 1999, 60(4): 845-854. |
| [10] | 卢晟盛, 卢克焕. 促性腺激素对猪卵母细胞体外成熟的影响[J]. 西南农业大学学报, 2004, 26(6): 769-772. |
| [11] | Saeki K, Hoshi M, Leibfried-Rutledge ML, et al. In vitro fertilizationand development of bovine oocytes matured in serum-free medium[J]. Biology of Reproduction, 1991, 44(2): 256-260. |
| [12] | 唐杰. 山羊促性腺激素及其受体 mRNA 丰度的研究[D]. 保定: 河北农业大学, 2007. |
| [13] | Derecka K, Pietilä E, Rajaniemi H, et al. Cycle dependent LH/hCGreceptor gene expression in porcine nongonadal reproductivetissues[J]. Journal of Physiology and Pharmacology : an OfficialJournal of the Polish Physiological Society, 1995, 46(1): 77-85. |
| [14] | Zheng M, Shi H, Segaloff DL, et al. Expression and localizationof luteinizing hormone receptor in the female mouse reproductivetract[J]. Biology of Reproduction, 2001, 64(1): 179-187. |
| [15] | Gawronska B, Stepien A, Ziecik A. Role of luteinizing hormonein control of oviduct function[J]. Reproduction in DomesticAnimals, 2000, 35(3-4): 129-133. |
| [16] | 王丽, 李泰云, 王树迎, 等. 沂蒙黑山羊发情周期中输卵管促性腺激素受体基因的表达差异研究[J]. 中国兽医科学,2011, 41(8): 832-838. |
| [17] | Freidman S, Gurevich M, Shemesh M. Bovine cyclic endometriumcontains high-affinity luteinizing hormone/human chorionicgonadotropin binding sites[J]. Biol Reprod, 1995, 52(5): 1020-1026. |
| [18] | 石中强, 徐艳, 王树迎, 等. 沂蒙黑山羊子宫中 FSHR 和 LHR基因在发情周期内的表达规律[J]. 山东农业大学学报: 自然科学版, 2011(1): 48-54. |
| [19] | 蒋进, 曹少先, 茆达干, 等. 豚鼠发情周期不同时期的子宫LHR mRNA 差异表达研究[J]. 中国农业科学, 2011, 44(16): 3420-3426. |
| [20] | Shemesh M, Mizrachi D, Gurevich M, et al. Functional importanceof bovine myometrial and vascular LH receptors and cervical FSHreceptors[C]. Seminars in Reproductive Medicine, 2001, 19(1): 87-96. |
| [21] | 申颖, 王慧, 王树迎, 等. LHR 基因在济宁青山羊发情周期不同阶段子宫中表达差异的研究[J]. 畜牧兽医学报, 2009, 40(3): 338-342. |
| [22] | Rzucidlo SJ, Weigl RM, Tilton JE. Myometrial LH/hCG receptorsduring the estrous cycle and pregnancy in pigs[J]. AnimalReproduction Science, 1998, 51(3): 249-257. |
| [23] | Sawitzke AL, Odell WD. Uterine binding sites for LH/hCG canbe modulated by hormonal status in rabbits and rats[J]. ActaEndocrinologica, 1991, 124(3): 322-330. |






