2. 中国科学院沈阳应用生态研究所,沈阳 110016
2. Institute of Applied Ecology,Chinese Academy of Sciences,Shenyang 110016
金黄色葡萄球菌肠毒素(Staphylococcal enterotoxins,SEs)是致热性毒素超抗原(Pyrogenic toxinsuperantigen,PTSAgs)中的一种,有着相似的结构、功能和基因序列。作为超抗原(Superantigen,SAgs)家族中最主要的成员,SEs 能够在极低剂量下不经过抗原递呈细胞(Antigen presenting cell,APC)处理,直接与MHC- Ⅱ类分子和T 细胞Vβ 区结合成三聚体结构,刺激T 淋巴细胞增殖,其激活T 淋巴细胞数量是普通抗原的数千至数万倍[1]。因为SEs 所具有的超抗原活性,可作为免疫增强剂,在肿瘤的免疫治疗和疫苗佐剂方面具有应用前景[2]。
金黄色葡萄球菌肠毒素C2(Staphylococcal enterotoxinC2,SEC2)作为SEs 的典型代表,与其他型肠毒素一样都是潜在的胃肠毒素,可引起食物中毒,伴随着腹泻、呕吐和发热等病症。但与SEA 和SEB 相比,SEC2 毒性较为温和,更适合医药开发应用,因此近年来SEC2 广受研究者的关注。有大量关于其超抗原免疫活性特点的研究报道,而选取合适的实验动物作为研究模型则尤为重要[3, 4]。
豚鼠和BALB/c 小鼠都是免疫学研究中最常用的实验动物。豚鼠常常被用于过敏和传染病学等研究领域,李华等[5]以豚鼠作为支气管哮喘的动物模型,探究SEB 对其气道炎症及Th1/Th2 细胞因子的影响。而BALB/c 小鼠常常被用于免疫反应和肿瘤免疫治疗研究领域,我们前期研究曾以BALB/c 小鼠作为抗肿瘤实验动物模型,探究SEC2 及其衍生物改构体的抗肿瘤作用[6]。在感染与免疫研究中,尤其是疫苗及疫苗佐剂的研究领域,豚鼠是更适宜的实验动物模型。而在肿瘤治疗研究领域中,BALB/c小鼠则更适宜作为实验动物模型。目前对于金黄色葡萄球菌肠毒素的超抗原活性研究还没有有关确定合适的模式实验动物的报道,因此我们以SEC2 为例,对比分析豚鼠和BALB/c 小鼠对其超抗原活性的反应敏感程度,确立合适的模式动物,旨为进一步的理论研究和医药开发奠定基础。
1 材料与方法1.1 材料1.1.1 实验动物350-400 g SPF 级实验用雌性豚鼠和6-8 周龄BALB/C 雌性小鼠均购自辽宁长生生物技术有限公司,饲养于20-24℃,湿度约30% 室内清洁鼠笼具内,自由摄食,提供无菌全价营养颗粒饲料(豚鼠饲料含维生素C),饮用水符合中华人民共和国生活饮用水卫生标准;豚鼠和小鼠给药前适应环境饲养1 周,此期间内无精神不正常现象、无摄食不正常现象、无其他疾病发生。
1.1.2 试剂豚鼠和小鼠细胞因子IL-4、IFN-γ、IL-2和TNF-α 的ELISA 检测试剂盒购自美国TSZ 公司;异丙基-β-D- 硫代半乳糖苷(IPTG)购自Sigma 公司;MTS 购自Promega 公司;ProteinShow-G250 蛋白快速染色试剂盒和BCA 蛋白定量试剂盒均购自北京康为世纪生物科技有限公司;豚鼠和小鼠的淋巴细胞分离液购自达科为生物技术有限公司;RPMI 1640 细胞培养基和胎牛血清(FBS)购自Hyclone 公司,其他化学试剂均为国产分析纯试剂;可表达重组SEC2蛋白的大肠杆菌基因工程菌由本实验室保存[7]。
1.2 方法1.2.1 SEC2表达与纯化SEC2 蛋白的表达与纯化参照我们前期研究[7]中所述方法进行,获得纯化蛋白后,以15%SDS-PAGE 分析纯度。纯化的SEC2 按照Super-Bradford 法测定蛋白浓度,过滤除菌后-70℃保存。 1.2.2 体外淋巴细胞刺激增殖实验
豚鼠以心脏采血法收集血液15 mL,1∶1 体积比加入稀释液(RPMI 1640 培养基),混匀抗凝血,取15 mL 离心管,加入3 mL 淋巴细胞分离液(取用前恢复至室温并摇匀)于每支离心管,将稀释过的血液覆盖在分离液上层(保持液面分界明显),25℃下1 500 r/min离心30 min ;取中间白膜层即为淋巴细胞层,再加入2 mL RPMI 1640 培养基于每支离心管,颠倒洗涤。25℃下1 000 r/min 离心10 min,收集细胞;每支离心管内加红细胞裂解液(8.9 g NH4Cl,1 g KHCO3,37.2 mg Na2EDTA,pH7.2-7.4,定容至1 L,过滤除菌)1 mL,同上离心,收集细胞。小鼠以内眦采血法收集血液,同上方法收集小鼠的PBMC。
无菌条件下摘取豚鼠和小鼠脾脏,剪碎研磨过200 目细胞筛,红细胞裂解液去除红细胞,再以无血清RPMI 1640 清洗获得豚鼠和小鼠的脾淋巴细胞。以含10% 胎牛血清的RPMI 1640 培养基调整豚鼠和小鼠的PBMC 和脾淋巴细胞浓度,以5×106cells/ 孔加入96 孔细胞培养板中。再加入SEC2 使终浓度为1 ng/mL、10 ng/mL、100 ng/mL、1 000 ng/mL、10 000 ng/mL,以含10% 胎牛血清的RPMI 1640 培养基作阴性对照。另设SEC2 与终浓度为2.5 μg/mL 的植物凝集素(Phytohemagglutinin,PHA)协同刺激豚鼠的脾淋巴细胞。在CO2 浓度为5%、37℃下培养48 h,于倒置显微镜下观察豚鼠和小鼠的脾淋巴细胞增殖情况。MTS 染色法检测豚鼠和小鼠的PBMC 和脾淋巴细胞增殖,检测波长490nm,参比波长690 nm。
以增殖指数(Proliferation index,PI)表示刺激豚鼠和小鼠的PBMC 和脾淋巴细胞增殖能力,PI=实验组吸光值/ 阴性对照组吸光值。 1.2.3 SEC2 对豚鼠和小鼠体内给药方法
豚鼠和BALB/c 小鼠分别分成给药组和生理盐水对照组,豚鼠每组5 只,小鼠每组8 只。SEC2 给药剂量为单位体重剂量(2.5 mg/Kg),阴性对照组注射等体积生理盐水,豚鼠和小鼠各组均腹腔给药一次,分别在给药的第0 天、第7 天、第14 天,第21 天,第28 天和第35 天进行采血,豚鼠和小鼠分别以心脏采血法和内眦采血法进行采血。血液样品于4℃中静置30 min,在4℃下5 000 r/min 离心10 min 分离血清,血清保存于-70℃用于ELISA 检测。
1.2.4 检测豚鼠和小鼠的体重、体温给药后第1天开始,(以数字型动物体温计)检测豚鼠和小鼠的直肠温度,并称量动物体重,每隔3 d 检测一次,直到采血结束。豚鼠和小鼠的体温、体重用于反映在实验过程中豚鼠和小鼠的一般生理健康状况。
1.2.5 ELISA 检测血清中细胞因子IL-4、IFN-γ、IL-2 和TNF-α豚鼠和小鼠的血清中细胞因子IL-4、IFN-γ、IL-2 和TNF-α 采用ELISA 法检测。按试剂盒说明书操作,简述过程为:在96 孔板上分别设空白孔(空白对照孔不加样品及酶标试剂,其余步骤相同)、标准孔、待测样品孔。在酶标板上标准品准确加样50 μL,待测样品孔先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5 倍)。将样品加于酶标板孔底部,尽量不接触孔壁,轻轻晃动混匀。用封板膜封板后置37℃孵育30 min 后,弃去液体,甩干,每孔加满稀释好的洗涤液,静置30 秒后弃去洗涤液,如此重复5 次,拍干。加入标记抗体,再次孵育,后再次洗涤。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37℃避光显色10 min 后,每孔加50 μL 终止液终止反应,以空白调零,450 nm 测OD 值(测定应在终止液加入后的15 min 以内)。以标准品浓度和读数绘制标准曲线,并计算待测品浓度。
1.2.6 统计分析结果采用x±s 表示,每个样品至少3 次重复实验,每个实验至少3 次独立重复实验。采用t检验进行数据统计分析。P <0.05 认为具有统计学意义。 2 结果 2.1 金黄色葡萄球菌肠毒素C2的表达与纯化
由本实验室构建的可表达重组SEC2 的大肠杆菌工程菌经过培养,诱导,超声破壁,再经过亲和层析获得SEC2 蛋白纯品,经15%SDS-PAGE 电泳检测(图 1),纯度达到95% 以上。

|
| 图 1 SEC2 SDS-PAGE 电泳图 |
体外实验中,SEC2 可剂量依赖性的刺激BALB/c 小鼠PBMC(图 2)和BALB/c 小鼠脾淋巴细胞产生增殖效应(图 3),诱导显著增殖的最低SEC2 浓度为10 ng/mL(P<0.05)。在最高剂量SEC2刺激下(10 000 ng/mL),小鼠PBMC 的PI 值接近3(图 2),小鼠脾淋巴细胞的PI 值为2.7(图 3)。倒置显微镜对增殖细胞的观察发现,SEC2 刺激下的BALB/c 小鼠脾淋巴细胞形成了明显的增殖细胞簇,细胞簇周围的淋巴细胞分布紧密,并且增殖细胞簇的数量和大小随着SEC2 浓度增加而呈现递增趋势(图 4A-图 4E)。
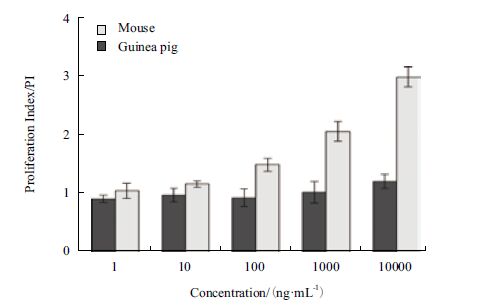
|
| 图 2 小鼠和豚鼠的PBMC 增殖指数 |
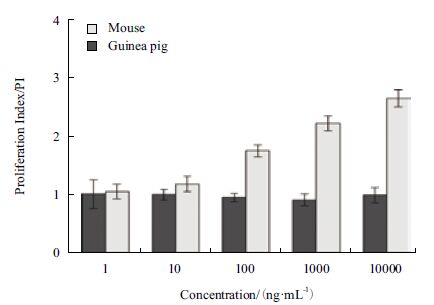
|
| 图 3 小鼠和豚鼠的脾淋巴细胞增殖指数 |

|
| 图 4 梯度浓度SEC2 与PHA 协同刺激豚鼠和小鼠的脾淋巴细胞增殖图 |
对豚鼠的PBMC 和脾淋巴细胞刺激实验发现,仅最高浓度的SEC2(10,000 ng/mL)刺激豚鼠的PBMC 产生增殖效应(P<0.05),但PI 值仅为1.2 左右(图 2)。此外,1-10 000 ng/mL 的SEC2 均未能激活豚鼠脾淋巴细胞产生任何显著增殖效应(P>0.05),甚至出现增殖指数<1 的状况(图 3)。这说明在SEC2 作用下,豚鼠脾淋巴细胞的死亡速度已经超过增殖速度。倒置显微镜观察发现,在梯度浓度的SEC2 刺激下,豚鼠的脾淋巴细胞并没有形成明显的增殖细胞簇,且细胞分布稀疏。仅阳性对照PHA 刺激豚鼠脾淋巴细胞产生增殖细胞簇(图 4-F-J)。
SEC2 腹腔给药后豚鼠和BALB/c 小鼠的体温情况如图 5 所示,豚鼠和小鼠的SEC2 给药组和生理盐水组体温均没有显著性差异(P>0.05),结果表明SEC2 对豚鼠和小鼠并没有产生显著的致热活性。豚鼠和小鼠的体重如图 6 所示,豚鼠的SEC2 给药组和生理盐水组体重均没有显著性差异(P>0.05),但是在检测第15 d 后,两组体重变化趋势逐现差异,SEC2 给药组体重增长速度明显慢于对照组,并且最终对照组体重高于SEC2 给药组大约14.78%,而小鼠的SEC2 给药组和生理盐水组体重增重相对平稳,但是从免疫第1 天到免疫第30 天,给药组的小鼠增重显著低于生理盐水组小鼠,并在第33 后恢复至正常水平。结果表明SEC2 对豚鼠和小鼠的摄食均产生了显著性的负面影响。
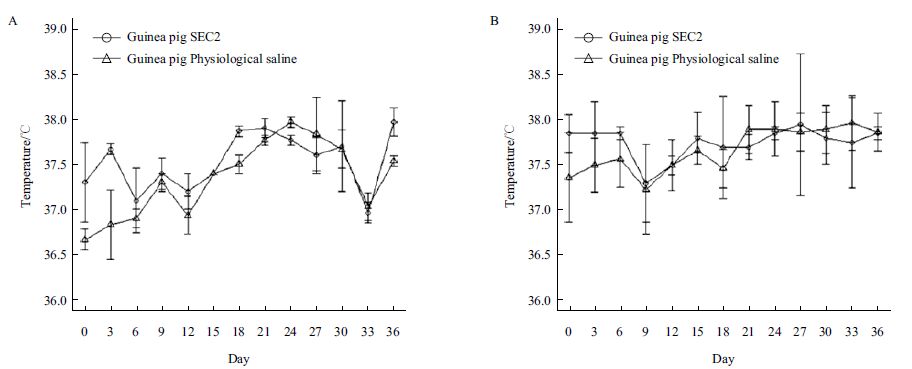
|
| 图 5 豚鼠(A)和小鼠(B)的SEC2 给药组和生理盐水组体温 |
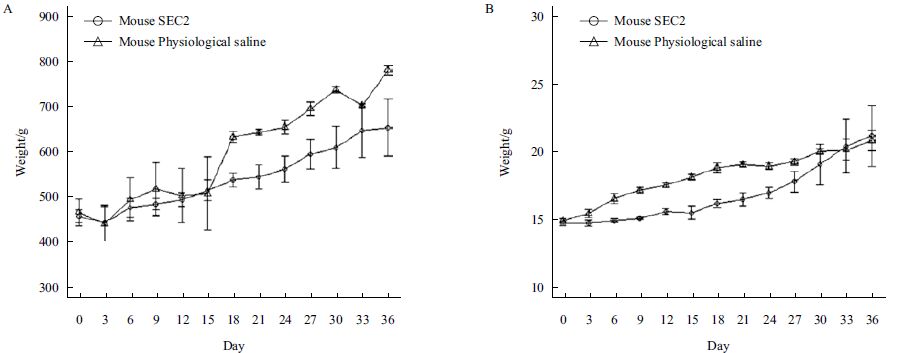
|
| 图 6 豚鼠(A)和小鼠(B)的SEC2 给药组和生理盐水组体重 |
本实验通过ELISA 法检测豚鼠和小鼠给药后血清中细胞因子IL-4、IFN-γ、IL-2 和TNF-α 的分泌水平。实验结果(图 7)表明,豚鼠的SEC2 给药组血清中四种细胞因子与豚鼠生理盐水对照组相比没有显著性差异(P>0.05)。而在BALB/c 小鼠实验中,SEC2 在给药初期即能够强烈诱导小鼠产生IL-4,在免疫后第7 天,IL-4 的分泌水平开始呈现上升趋势,第14 天达到最高,之后持续到第28 天开始出现下降趋势,至第35 天仍显著高于生理盐水对照组(P<0.05),表明SEC2 能够诱导小鼠产生强烈的体液免疫应答,而对豚鼠无显著性作用。SEC2 给药后第21 天开始诱导小鼠产生IFN-γ,且随着时间推移逐步升高,直至第35 天仍处于上升趋势,而SEC2却不能诱导豚鼠产生IFN-γ。SEC2 给药后第7 天即可强烈诱生小鼠血清中IL-2 水平(P<0.05),到给药后第28 天达到峰值,直至第35 天仍处于较高水平。SEC2 同样诱导小鼠分泌TNF-α,其分泌水平从给药后第7 天开始逐步升高,第14 天时显著高于生理盐水对照组,直至第35 天仍处于上升趋势。以上实验结果初步说明SEC2 在豚鼠体内既没有诱导细胞免疫也没有诱导体液免疫,暗示豚鼠可能并不是SEC2 超抗原活性的敏感动物;而SEC2 可以强烈刺激BALB/c 小鼠免疫系统,诱导了小鼠血清中细胞因子的显著性升高,进一步表明BALB/c 小鼠是SEC2超抗原活性的反应敏感动物。

|
| 图 7 豚鼠和小鼠给药后血清细胞因子分泌水平 |
豚鼠和BALB/c 小鼠都是免疫学研究中常用的模式动物,并且都有报道用于SEs 的超抗原活性研究方面。例如,在豚鼠鼻腔多次施加金黄色葡萄球菌肠毒素B(SEB)可以刺激豚鼠黏膜免疫系统引发过敏性鼻炎[8];而在以BALB/c 小鼠为模式动物的肿瘤免疫治疗研究中,SEA、SEB 和SEC2 均可强烈激活小鼠免疫系统,对肿瘤实现免疫治疗作用[9]。
SEs 作为一种超抗原,其激活T 淋巴细胞的主要途径是与含特异性Vβ 侧链的T 淋巴细胞受体(TCell Receptor,TCR)识别结合,并且不同种类SEs识别Vβ 种类也不同,这是决定超抗原活性的最重要因素[10]。另外,不同动物种属之间其TCR 的Vβ也有明显差异。如人的TCR 有24 种Vβ 亚型,而小鼠有22 种Vβ 亚型,并且人和小鼠之间TCR 的Vβ 氨基酸序列也存在明显差异。以上这些因素导致SEs 的超抗原活性具有一定种属差异性[11]。SEC2是SEs 家族中毒性温和且活性较高的一种,极有潜力作为免疫激活剂用于医药领域,因此近年来对于其作用机理和应用的研究增多,这就需要合适的模式动物用于研究,而关于对SEC2 超抗原活性敏感的模式动物,目前尚无研究报道。因此本文研究目的就是对比分析豚鼠和BALB/c 小鼠对SEC2 超抗原作用的敏感性,寻找更适合用于SEC2 超抗原活性研究的模式动物。
本研究的体外实验结果发现,SEC2 并没有像促进小鼠的PBMC 和脾淋巴细胞增殖那样促进豚鼠的PBMC 和脾淋巴细胞增殖,相反,甚至在较低浓度刺激下出现了大量细胞死亡,为了提升豚鼠脾淋巴细胞对SEC2 的敏感性,我们设计以SEC2 和PHA联合刺激豚鼠的脾淋巴细胞,结果发现联合刺激与PHA 单独刺激相比,并未增加豚鼠脾淋巴细胞增殖细胞簇的数量和大小,二者效果无明显差异。由此结果推断,可能是由于豚鼠对SEC2 超抗原活性的刺激并不敏感导致。在进一步的体内实验中,我们用ELISA 法检测SEC2 腹腔注射后豚鼠和小鼠各组血清中细胞因子IL-4、IFN-γ、IL-2 和TNF-α 的分泌。IL-4 和IFN-γ 是诱导体液免疫和细胞免疫的关键性细胞因子。其中,IL-4 在促进B 淋巴细胞增殖的同时,也能够刺激肥大细胞的增殖,并且提升巨噬细胞递呈抗原能力[12]。IFN-γ 属Ⅱ型干扰素,主要由T 淋巴细胞产生,具有增强细胞免疫功能,同时还可以刺激中性粒细胞,促进其吞噬作用和增强巨噬细胞表面MHC Ⅱ类分子的表达等作用[13]。IL-2 主要由活化的CD4+T 细胞产生,可促进Th0 细胞增殖分化,并且增强细胞毒性T 淋巴细胞(Cytotoxiclymphocyte,CTL)活性[14, 15]。TNF-α 主要由巨噬细胞和自然杀伤细胞(Natural killer cell,NK)分泌产生,与相应受体结合后引起靶细胞溶解,并且可增强中性粒细胞的吞噬能力,增强抗体依赖的细胞介导的细胞毒性作用(Antibody-dependent cell-mediatedcytotoxicity,ADCC)[16]。对以上这些细胞因子的检测,可以较为系统的评价SEC2 超抗原活性对动物免疫系统的激活能力。实验结果表明,豚鼠的SEC2给药组和生理盐水组血清中,各细胞因子没有显著性差异,SEC2 没有诱导豚鼠免疫系统产生有效的细胞因子;而在小鼠体内,SEC2 能显著性地诱导小鼠大量分泌上述细胞因子。以上体内和体外实验结果可以初步证明,豚鼠的免疫系统对SEC2 的超抗原作用不敏感;而BALB/c 小鼠的免疫系统对SEC2 的超抗原活性表现出很好的敏感性,更适合作为研究SEC2 超抗原活性的模式动物。
李华和Tang 等[5, 8]的研究发现SEB 可以激活豚鼠免疫,而本研究采用的SEC2,尽管在一级结构上与SEB 较为同源,但却未能发现对豚鼠免疫系统的激活效应。分析其可能的原因,SEC2 和SEB 尽管一级结构相似,均与MHC- Ⅱ类分子的α 链和TCR的Vβ 区特异位点结合,但是在三级结构上还存在一些差异。SEB 和SEC2 的晶体结构表明,除了SEC2具有锌离子结合位点外,在SEC2 的51-61 氨基酸位点(涉及β2 和β3 折叠区)、97-110 氨基酸位点(涉及二硫环结构和β5 折叠的部分区域)、120-129氨基酸结构位点(涉及β6 折叠部分区域)、137-140氨基酸结构位点(涉及β6 和β7 折叠区)、152-155氨基酸结构位点(涉及β8 折叠区)和193-194 氨基酸结构位点(涉及β10 折叠区)均有不同[17]。这些重要位点的不同可能导致了SEB 与SEC2 蛋白分子三维结构的细微差异,进而在免疫识别过程中造成了很大不同。SEB 与小鼠TCR 的Vβ3、Vβ7 和Vβ8具有更好的亲和力,而SEC2 与小鼠TCR 的Vβ8.2、Vβ8.3 结合更强[11]。由此判断,SEB 和SEC2 在与TCR 结合上的微弱差别可能是造成豚鼠与BALB/c小鼠对SEC2 敏感性截然不同的主要因素,不过该假设需要进一步实验验证。
4 结论体外实验结果表明,SEC2 不能刺激豚鼠的PBMC 和脾淋巴细胞增殖,而能够剂量依赖性地刺激BALB/c 小鼠的PBMC 和脾淋巴细胞增殖。体内实验结果表明,SEC2 可强烈激活小鼠体内免疫系统,显著提升小鼠血清中细胞因子IL-2、IL-4、IFN-γ 和TNF-α 的分泌水平,而对豚鼠体内免疫无明显刺激作用。研究结果初步说明,与豚鼠相比,BALB/c 小鼠的免疫系统对SEC2 的超抗原刺激作用更加敏感,更适合作为研究SEC2 超抗原活性的模式动物。
| [1] | Fraser JD, Proft T. The bacterial superantigen and superantigen-likeproteins[J]. Immunological Reviews, 2008(225):226-243. |
| [2] | Wang XG, Xu MK, Zhang HW, et al. Enhancement of superantigenactivity and antitumor response of staphylococcal enterotoxin C2 bysite-directed mutagenesis[J]. Cancer Immunol Immunother, 2009(58):677-686. |
| [3] | Liu YL, Xu MK, Zhang HW, et al. SEC2-induced superantigen andantitumor activity is regulated through calcineurin[J]. AppliedMicrobiology and Biotechnology, 2013, 97(22):9695-9703. |
| [4] | Liu YL, Xu MK, Li X, et al. The construction of a bifunctional fusionprotein consisting of SEC2 and EGFP[J]. Biotechnology andApplied Biochemistry, 2014, 61(5):565-571. |
| [5] | 李华, 陆丽, 刘金保, 等. 金黄色葡萄球菌肠毒素B 对豚鼠哮喘模型Th1/Th2 细胞因子的影响[J]. 免疫学杂志, 2006, 22(3):139-141. |
| [6] | 张国俊, 徐明恺, 孙健, 等. 增强型金黄色葡萄球菌肠毒素C2突变体及其超抗原活性[J]. 生物工程学报, 2013, 29(6):803-813. |
| [7] | 张国俊, 邹谨, 徐明恺, 等. 活性增强的SEC2 截短突变蛋白的构建及其生物活性研究[J]. 生物技术, 2012, 22(6):31-35. |
| [8] | Tang XY, Sun R, Hong SL, et al. Repeated intranasal instillation withstaphylococcal enterotoxin B induces nasal allergic inflammation inguinea pigs[J]. American Journal of Rhinology & Allergy, 2011,25(3):176-181. |
| [9] | Xu MK, Wang XG, Cai YM, et al. An engineered superantigen SEC2exhibits promising antitumor activity and low toxicity[J]. CancerImmunology Immunotherapy, 2011, 60(5):705-714. |
| [10] | Li ZJ, Omoe K, Shinagawa K, Yagi J, et al. Interaction betweensuperantigen and T-cell receptor Vbeta element determines levelsof superantigen-dependent cell-mediated cytotoxicity of CD8(+)T cells in induction and effector phases[J]. Microbiol Immunol,2009, 53(8):451-459. |
| [11] | Llewelyn M, Sriskandan S, Terrazzini N, et al. The TCR Vb signatureof bacterial superantigens spreads with stimulus strength[J].International Immunology, 2006, 18(10):1433-1441. |
| [12] | Ranasinghe C, Trivedi S, Danushka K, et al. IL-4 and IL-13 receptors:Roles in immunity and powerful vaccine adjuvants[J].Cytokine & Growth Factor Reviews, 2014, 25(4):437-442. |
| [13] | Ogawa, Hiromi, Mukai K, Kawano Y, et al. Th2-inducingcytokines IL-4 and IL-33 synergistically elicit the expression oftransmembrane TNF-a on macrophages through the autocrineaction of IL-6[J]. Biochemical and Biophysical ResearchCommunications, 2012, 420(1):114-118. |
| [14] | Sharma R, Fu SM, Ju ST. IL-2 :A two-faced master regulator ofautoimmunity[J]. Journal of Autoimmunity, 2011, 36(2):91-97. |
| [15] | Liao W, Lin JX, Leonard, et al. IL-2 family cytokines :new insightsinto the complex roles of IL-2 as a broad regulator of T helper celldifferentiation[J]. Current Opinion in Immunology, 2011, 23(5):598-604. |
| [16] | Pullyblank AM, Guillou PJ, Monson JRT, et al. Interleukin-1and tumor-necrosis-factor-alpha may be responsible for the lyticmechanism during antitumor antibody-dependent cell-mediatedcytotoxicity[J]. British Journal of Cancer, 1995, 72(3):601-606. |
| [17] | Papageorgion AC, Acharya KR, Shapiro R, et al. Crystal-structureof the superantigen enterotoxin c2 from Staphylococcus aureusreveals a zinc-binding site[J]. Structure, 1995, 3(8):769-779. |




