卷烟烟气的化学成分多达3 800 多种[1],其中大多数成分是无害的,只有少数有害[2]。弄清楚这些有害成分的致病作用机制及其抑制途径,对于保护卷烟消费者的健康具有重要意义。烟草特有亚硝胺(TSNAs)是由烟草内源性生物碱通过亚硝胺化作用而产生的,是只存在于烟草、烟草制品和烟草烟气中的亚硝胺类化合物。到目前为止,尚未在其他食品中发现[3]。有关TSNAs 的研究报道很多,不仅是因为它们是烟草制品的主要有害成分之一,它还对机体健康造成极大危害,有证据表明,TSNAs与肺部、口腔、食道、胰脏、肝脏等部位发生的病变有关[4]。而4-(甲基亚硝氨基)-1-(3- 吡啶基)-1-丁酮(NNK)是TSNAs 中含量高、致癌能力强的一种烷化剂类致癌物[5],是卷烟主流烟气的代表性有害成分之一[6, 7],国际癌症组织将其列为一级致癌物[8]。实验研究证实,NNK 可诱发多种动物的多种肿瘤发生。我们研究组所构建的小鼠毒理模型显示,吸烟和灌胃的动物模型中,对小鼠的肺部细胞和肝部细胞损伤最大[9, 10]。鉴于报道的动物体内实验及我们前期研究的结果,本实验以体外培养小鼠正常肝细胞(NCTC 1469 细胞)为研究对象,采用四氮唑盐比色分析法(MTT 法)和流式细胞仪检测细胞凋亡,观察不同剂量NNK 对NCTC 1469 的细胞毒性及凋亡情况,为进一步研究NNK 诱导肝细胞损伤奠定基础。
1 材料与方法 1.1 材料小鼠肝细胞NCTC 1469 购自中国典型培养物保藏中心;NNK 购自Toronto Research Chemicals Inc ;DMEM 培养液、噻唑蓝、胰蛋白酶购自Solarbio 公司;胎牛血清购自杭州四季青生物工程材料有限公司;Annexin V-FITC 细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;实时荧光定量PCR 试剂盒购自宝生物大连有限公司;CO2 培养箱HF160W(Heal Force);倒置相差显微镜(Observer A1,Zeiss);流式细胞仪(Becton-Dickinson,FACS Calibur);酶标仪(GENEios Plus,TECAN);荧光定量PCR(Stepone Plus,ABI)。
1.2 方法 1.2.1 细胞培养细胞株于含10% 胎牛血清的高糖DMEM 培养液中,37℃,5%CO2 培养箱内培养,隔天传代。取对数生长期的细胞用于试验研究。
1.2.2 NNK 对细胞毒性作用的检测采用MTT 比色法,用DMEM(含10% 新生小牛血清)培养液调整细胞浓度,以1×104 个/mL 接种于96 孔培养板中,每孔接种100 μL 细胞悬液,置37℃、5%CO2 饱和湿度条件下培养12 h 后弃原培养液,再分别加入含NNK 浓度为0.1、0.2、0.3、0.4、0.5 mg/mL 的新鲜DMEM 培养液200 μL,阴性对照组加入不含NNK 的等量完全培养基。同时设空白组对照调零,空白对照组除不加细胞外其余条件与阴性对照组相同,每组均设5 个平行孔。置于培养箱中分别培养12、24和36 h 后,每孔加入5 g/L MTT 溶液 20 μL,孵育4 h,弃上清,加入二甲基亚砜(DMSO)150 μL/ 孔振荡10 min 后,检测490 nm 波长下吸光度值(A)。按公式计算各组细胞存活率,细胞存活率=[(实验孔A 值-空白孔 A 值)(/ 对照孔A 值- 空白孔 A 值)]×100%。实验重复3 次。
1.2.3 NNK 胁迫NCTC 1469 细胞的形态观察将生长良好的细胞分为对照组(正常培养的细胞)和实验组,实验组中分别加入NNK 0.1、0.2、0.3、0.4、0.5 mg/mL,对照组不加NNK,培养24 h。倒置显微镜动态观察细胞形态的变化。
1.2.4 细胞凋亡检测将对数生长期的细胞消化接种到六孔板中,次日,待细胞贴壁后,分别加入含NNK 浓度为0.1、0.2、0.3、0.4、0.5 mg/mL 的新鲜DMEM 培养液,同时设立阴性对照组;置于培养箱中培养24 h,用0.25% 胰酶(不含EDTA)消化收集细胞,制成细胞悬液,调整细胞密度至5×105mL,常规加入Annexin V-FITC 及PI 染色,流式细胞仪(FCM)检测细胞凋亡情况。实验重复3 次。
1.2.5 凋亡基因Bcl-2 和Bax 的表达取对数生长期的细胞分为实验组和对照组,对照组未加药物,实验组加入NNK 使其终浓度为0.1、0.2、0.3、0.4、0.5mg/mL。37℃、5%CO2 饱和湿度条件下培养24 h 后,实验组和对照组NCTC 1469 细胞分别用Trizol 试剂提取RNA,依照提取试剂盒操作得到白色沉淀,加入0.01% 焦碳酸二乙酯(DEPC)40 μL,使RNA 完全溶解。紫外分光光度计法测定RNA 的A260 和A280比值和含量,用DEPC 水将各组总RNA 调整至同一浓度,分别逆转录合成cDNA,以GAPDH 为内参基因进行实时荧光定量PCR,基因引物序列详见表 1。根据Ct 值计算出内参基因和处理组基因的△ Ct,再用对照组△ Ct- 处理组△ Ct 得到△△ Ct,最终根据2- △△ Ct 得出处理组样本基因相对于对照组样本基因的量。
应用SPSS17.0 软件对实验数据进行统计学分析。计量指标用x±s 表示,组间比较用单因素方差分析(ANOVA),检验水准α=0.05。
2 结果 2.1 NCTC 1469细胞形态学的变化倒置相差显微镜如图 1 观察可见,对照组细胞贴壁生长,细胞排列均匀,大小基本一致,轮廓清晰,悬浮细胞少。随NNK 浓度上升,细胞生长密度逐渐下降,出现细胞皱缩等形态学改变、细胞数量及生长密度逐渐减少、细胞颗粒增多。经0.1 mg/mLNNK 作用24 h 后的细胞,正常细胞减少,开始出现细胞碎片。并且随着NNK 浓度逐渐增加,上述变化更加明显。

|
| 图 1 不同浓度NNK 作用24 h 后NCTC 1469 细胞形态学的改变(200x) |
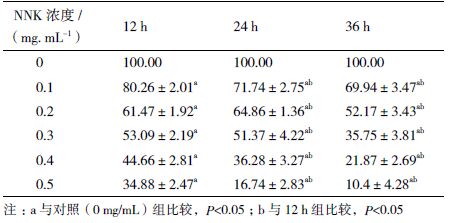
细胞存活率是细胞毒理作用的检测指标之一,MTT 结果(表 2)显示,在不同浓度NNK 的作用下,各药物浓度组细胞存活率与同时间点对照组比较均明显下降,差异具有统计学意义(P<0.05)。线性回归分析,存在明显的剂量- 效应关系(12 h∶b=-0.085,P<0.05 ;24 h∶b=-0.117,P<0.05 ;36 h∶b=-0.138,P<0.05)。且随着时间逐渐延长,与同浓度组比较均明显下降,差异具有统计学意义(P<0.05)。可见,NNK 能降低NCTC 1469 细胞存活率,并呈浓度和时间依赖性。
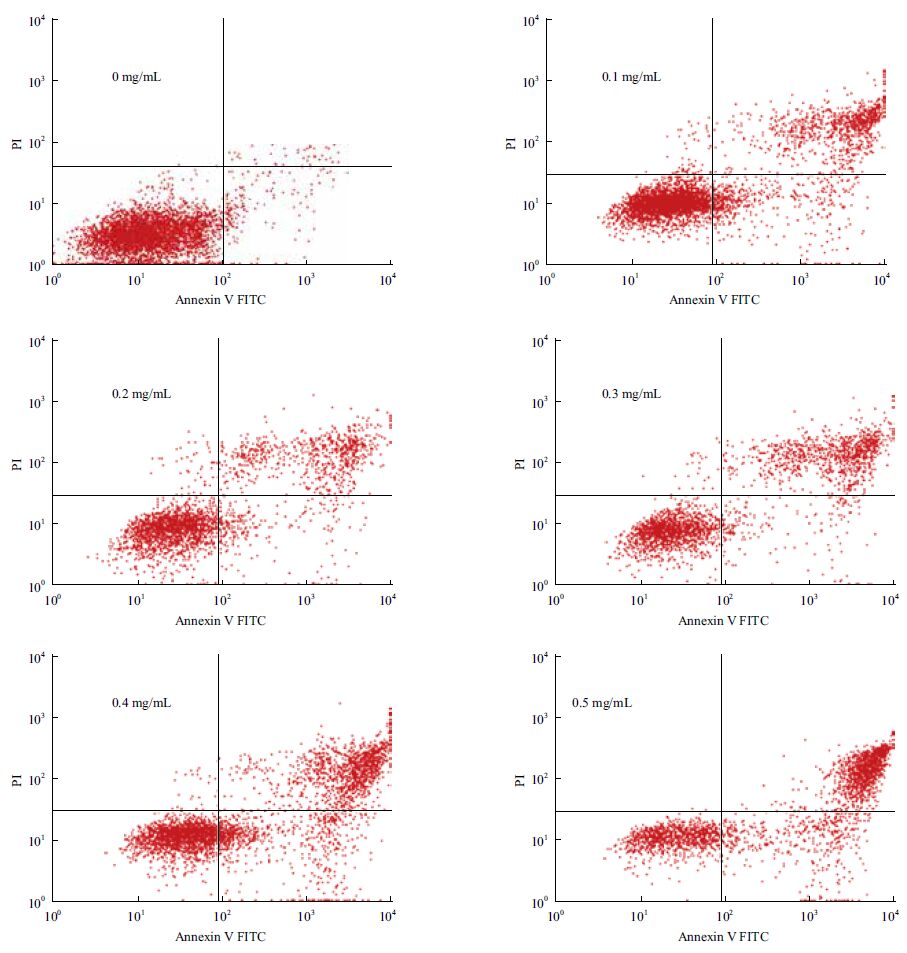
流式细胞仪Annexn V-FITC/PI 双染法检测细胞凋亡如图 2 所示,由于晚期凋亡细胞和坏死细胞(右上象限)多为早期凋亡细胞(右下象限)继发而来,故将两者之和记为总体凋亡率。对照组细胞凋亡率仅约(7.46±1.58)%,NNK 作用24 h 后NCTC 1469 细胞的凋亡率分别为(16.79±2.01)%、(26.87±1.67)%、(41.78±3.19)%、(50.89±3.94)%和(65.86±4.54)%。与对照组比较,不同浓度组间凋亡率差异具有统计学意义(P<0.05)。
|
| 图 2 NNK 体外作用对NCTC 1469 细胞凋亡率的影响 |
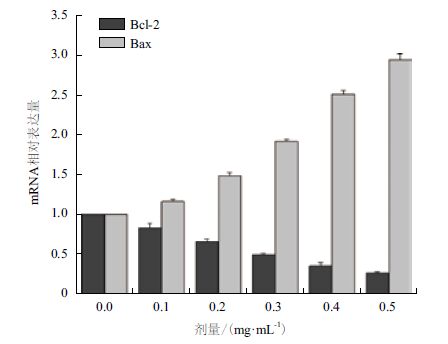
如图 3 所示,随着NNK 作用浓度的增加,NCTC 1469 细胞的Bcl-2 基因mRNA 表达明显减少,而Bax 基因的mRNA 表达上升,Bcl-2/Bax 比值趋小。
|
| 图 3 不同浓度NNK 处理NCTC 1469 细胞24 h 后Bcl-2和Bax mRNA 的表达 |
吸烟能引起并发症已是不争的事实[11]。香烟中主要的致癌物有两大类:一是多环芳烃类,如苯并芘;二是亚硝胺,一支香烟燃烧产生的烟气中有0.1-0.5μg NNK[12],NNK 可引起DNA 链断裂、碱基突变、DNA 加合物形成等,从而导致细胞病变[13, 14, 15]。小鼠毒理模型显示烟气能够导致肝部损伤,可能与烟草特有亚硝胺有关。
本研究之所以选用肝部细胞作为研究对象,主要基于前期的研究基础,为进一步揭示NNK 损伤肝部细胞的机理而展开的。在我们的前期研究中,无论吸烟还是灌胃的毒理模型中均显示,肺部和肝部是损伤最大的组织。本研究通过NNK 对小鼠正常肝细胞NCTC 1469 的胁迫作用,并为后期进一步作用机制的研究奠定基础。MTT 结果表明,NNK 在体外能显著降低NCTC 1469 细胞的存活率,随着NNK浓度的加大和作用时间的延长,细胞存活率逐渐下降,提示NNK 浓度和时间依赖性地影响细胞存活率。
细胞凋亡是由基因控制细胞主动性自杀过程,其细胞增殖调节机制的失控与癌变过程密切相关,且可促进肿瘤的发生。经NNK 作用后的NCTC 1469细胞,在倒置相差显微镜下观察细胞形态,可见细胞生长密度逐渐下降,体积缩小。作用24 h 后,有大量不规则细胞脱落,细胞碎片较多。上述细胞形态变化说明,NNK 对NCTC 1469 的胁迫能通过细胞凋亡程序来启动细胞抑制作用。该研究采用Annexin V-FITC/PI 双染法检测NNK 体外作用对NCTC 1469细胞凋亡的影响。随着NNK 浓度的增加凋亡率逐渐上升,说明NNK 通过诱导NCTC 1469 细胞程序性凋亡来抑制生长。抑制机制可能有直接损伤细胞膜、影响线粒体的通透性[16]、阻滞细胞周期、降低MMP 等。
细胞凋亡是为维持内环境稳定,由基因控制的细胞自主的有序的死亡,其原因和途径是复杂多样的,许多基因共同参与这一过程,包括抗凋亡基因和促凋亡基因。其中Bcl-2 家族成员在细胞凋亡的过程中起着至关重要的作用[17]。Bcl-2 家族按其功能可分为两大类:一类是促凋亡基因,代表基因是Bax 基因,主要分布于线粒体的外膜上。Bax 过度表达可以诱导某些细胞自发凋亡,且可以 参与并促进其他因素诱导的细胞凋亡。另一类是抗细胞凋亡基因,代表基因是Bcl-2,与肿瘤的发生和耐药性密切相关。若Bcl-2 和Bax 表达量平衡则细胞正常生存,Bcl-2 表达水平上升时可以和Bax 结合形成异源二聚体抑制细胞凋亡,Bax 表达水平上升可形成同源二聚体拮抗Bcl-2 的作用,促进细胞凋亡[18]。本研究发现,不同浓度NNK 作用NCTC 1469 细胞后检测Bcl-2 和Bax 基因的表达水平,随着药物浓度的上升,Bcl-2 基因的mRNA 表达量下降,而Bax 基因的mRNA 表达上升,Bcl-2/Bax 比例下降,呈现负相关性的关系,由此说明,NNK 诱导NCTC 1469 细胞凋亡的机制可能是通过下调Bcl-2 mRNA 和上调Bax mRNA 表达量来实现的。
本实验是细胞毒理模型初步建立阶段,我们选择经典的Bcl-2 和Bax 基因作为研究对象,虽然mRNA 定量PCR 结果能反映出NNK 能诱导Bcl-2 和Bax 发生相应的表达变化,但两基因翻译成功能蛋白还需要经过转录后的修饰和蛋白质翻译的调控;如果仅通过Western blot 来验证Bcl-2 和Bax 表达蛋白的量的变化,既脱离不了常规的研究方法,又不能对两基因的调控机理作以解释,因此本实验未利用Western blot 验证两基因的蛋白水平上的变化,我们正通过其它分子生物学方法研究两基因的调控机理,这将在后续研究结果中加以报道。
4 结论NNK 能降低NCTC 1469 细胞存活率,并诱导其凋亡,且通过调节Bcl-2 和Bax 的相对表达量诱导其凋亡,具体机制及与其它凋亡信号通路的关系有待进一步研究。
| [1] | 毛友安. 卷烟烟气中烟草特有亚硝胺的新分析技术及其对酶活性影响的研究[R]. 湖南大学博士后研究工作报告. 长沙: 2004. |
| [2] | Rodgrman A. The composition of cigarette smoke : problems withlists of tumorigens[J]. Bitr Tabakforsch Int, 2003, 20 : 402-437. |
| [3] | 刘万峰, 王元英. 烟草中烟草特有亚硝胺的研究进展[J]. 中国烟草科学, 2002, 24(2): 11-14. |
| [4] | Hecht SS. Biochemistry, biology, and carcinogenicity of tobaccospecificN-nirosamines[J]. Chem Res Toxicol, 1998, 11 : 559-603. |
| [5] | Djordjevic MV, Brunnemann KD, Hoffmann D. Identificationand analysis of a nicotine-derived N-nitrosamino acid and othernitrosamino acids in tobacco[J]. Carcinogenesis, 1989, 10(9): 1725-1731. |
| [6] | World Health Organization technical series : No. 95 1. The scientificbasis of tobacco product regulation[R]. Genewa : World HealthOrganization, 2008 : 69. |
| [7] | 谢剑平, 刘惠民, 朱茂祥, 等. 卷烟烟气危害性指数研究[J].烟草科技, 2009(2): 5-15. |
| [8] | International Agency for Research on Cancer(IARC).IARC monographs on the evaluation of carcinogenic risks tohumans : V01. 89. Smokeless tobacco and some tobacco-specificN-nitrosamines[M]. Lyon : International Agency for Research onCancer, 2007 : 59. |
| [9] | 宁维, 陈利平, 李瑜, 等. 卷烟烟气体内安全评价方法研究[J].河南农业科学, 2013, 42(9): 152-156. |
| [10] | 宁维, 陈利平, 李瑜, 等. 全烟气致小鼠肺损伤模型的建立[J].烟草科技, 2013, 11 : 36-40. |
| [11] | 邹小农. 中国肺癌流行病学[J]. 中华肺癌防治杂志, 2007,14(12): 881-883. |
| [12] | Wynder EL, Hoffmann D. Smoking and lung cancer : scientificchallenges and opportunities[J]. Cancer Res, 1994, 54(20): 5284-5295. |
| [13] | Wu X, Zhao H, Suk R, et al. Genetic susceptibility to tobaccorelated cancer[J]. Oncogene, 2004, 23(38): 6500-6523. |
| [14] | Akopyan G, Bonavida B. Understanding tobacco smoke carcinogenNNK and lung tumorigen- esis[J]. Int J Oncol, 2006, 29(4): 745-752. |
| [15] | Haussmann HJ. Smoking and lung cancer : future researchdirections[J]. Int J Toxicol, 2007, 26(4): 353-364. |
| [16] | Zhang H, Yang J Y, Zhou F, et al. Seed Oil of Brucea javanicainduces apopotic death of acute myeloid leukemia cells via both thedeath receptors and the mitochondrial-related pathways[J]. EvidBased Complement Alternat Med, 2011, 28 : 965-969. |
| [17] | Tsukaharas S, Yamamoto S, Shew TT, et al. Inhalation of lowlevel formaldehyde increases the bcl 2/bax expression ratio inthe hippocampus of immunologically sensitized mice[J].Neuroimmunomodulation, 2006, 13(2): 63-68. |
| [18] | Parikh N, Koshy C, Dhayabaran V, et al. The N-terminus andalpha-5, alpha-6 helices of the pro-apoptotic protein Bax, modulatefunctional interactions with the anti-apoptotic protein Bcl-xL[J].BMC Cell Biol, 2007, 8 : 16-20. |