聚唾液酸(Polysialic acid,PSA)是以N- 乙酰神经氨酸为单体,以 α-2,8 和/ 或 α-2,9 糖苷键连接的聚合度在 8-400 的聚阴离子型线性多糖[1, 2, 3, 4],通常存在于脊椎动物细胞的神经黏附分子(NCAM)末端和一些致病菌(如大肠杆菌K1 株和奈瑟斯脑膜炎球菌)细胞表面。在脊椎动物体内,PSA 参与细胞迁移、突触形成等生物功能且与神经系统的可塑性有关。由于PSA 具有良好的生物相容性和生物可降解性,因此PSA 可用作神经再生修复的组织工程支架材料[5]。另外,PSA 在结构上具有较多羟基,从而具有高度亲水性,再加上其非免疫原性,使得聚唾液酸化的药物可以延长在血液循环中的半衰期,是目前发现可以替代聚乙二醇(PEG)的比较理想的蛋白类药物缓释材料[6]。
目前,生产PSA 的唯一方法是通过微生物发酵,之后从发酵液中提取、纯化来制备[7, 8],用于生产PSA 的大肠杆菌(Escherichia coli)主要有K235 和K1 两株[9, 10]。从1999 年起,本实验室对利用E.coli K235 生产PSA 进行研究,通过诱变、培养基的优化、培养条件的优化,使PSA 的产量较出发菌株提高了5 倍[9, 11]。但总体而言,PSA 的产量仍较低,且菌株的PSA 产量不稳定,难以满足产业化的需求。
我们前期研究发现E.coli K235 发酵生产PSA受溶氧的严重影响[12],而氧作为电子传递链(Electron transport chain,ETC)的最终电子受体直接影响微生物细胞内的能荷(Energy charge,EC)和氧化还原状态。调节微生物细胞内能荷、还原力的方法有细胞改造和发酵工艺调节两种方法。其中,细胞改造方法包括:(1)通过基因工程操作使与NAD+/H代谢有关的酶过量表达[13, 14];(2) 将与NAD+/H竞争的代谢途径删除[15, 16];(3)引入其他生物的NAD+/H 再生系统[17, 18]。发酵工艺调节方法包括:补加(1)外源电子受体例如富马酸[19]、乙醛[20];(2)不同氧化还原状态的碳源[21],如山梨醇、葡萄糖、葡萄糖酸钠;(3)NAD+ 的前体。本研究尝试利用不同氧化还原状态的碳源和NAD+ 合成的前体来调控菌体细胞内能荷、还原力水平,探索其与PSA合成之间的联系,用于指导PSA 的生产合成。
1 材料与方法 1.1 材料大肠杆菌(Escherichia coli CCTCC M208088),由江南大学糖化学与生物技术教育部重点实验室保藏。ATP、ADP、AMP、UMP、UTP、NAD+ 等购于Sigma-Aldrich 公司,其他药品由国药试剂提供。
斜面培养基(g/L):氯化钠5,胰蛋白胨10,牛肉膏3,琼脂粉20,pH7.2-7.4。种子培养基(g/L):氯化钠5,胰蛋白胨10,牛肉膏3,pH7.2-7.4。发酵培养基(g/L):山梨醇40,硫酸铵4.94,磷酸氢二钾(三水)26.2,胰蛋白胨1.5,硫酸镁0.9,pH7.8(灭菌前)。
1.2 方法 1.2.1 斜面培养将保存于4℃ 冰箱里的菌种,挑取一环到准备好的固体斜面培养基上,在37℃ 恒温箱内恒温培养12 h。
1.2.2 种子培养将斜面培养活化后的种子接种两环于250 mL 三角瓶中(内装50 mL 种子培养基)后,放置于摇床中培养,摇床条件为转速250 r/min、温度37℃,培养8-10 h。
1.2.3 发酵培养将准备好的种子培养基按照4%的接种量接种于250 mL 三角摇瓶(内装35 mL 发酵培养基)后,250 r/min、37℃培养60 h。
1.2.4 烟酸对PSA发酵的影响 准确称取1 g 烟酸溶于1 L 蒸馏水中,配制成1 g/L 的烟酸溶液,灭菌待用。向分装灭菌的1.2 的发酵培养基中(35mL/250 mL)分别加入上述1 g/L 的烟酸溶液175 μL、350 μL、525 μL、700 μL,配制成含烟酸为5 mg/L、10 mg/L、15 mg/L、20 mg/L 的发酵培养基,研究烟酸对PSA 发酵的影响。
1.2.5 分析方法 1.2.5.1 生物量测定将样品稀释至一定倍数后,测定600 nm 下吸光值,然后对照 OD600 吸光度- 菌体干重的标准曲线计算生物量,OD600=1.0 相当于 0.4g/L 细菌干重。
1.2.5.2 PSA 的测定对PSA 的测定采用间苯二酚法[12]。
1.2.5.3 碳源及有机酸含量的测定发酵液离心后即得待测样品,利用高效液相色谱(LC-2010A,岛津)测定,色谱柱为Aminex HPX-87H(9 μm,300mm×7.8 mm,Biorad);流动相为5 mmol/L 硫酸;流动相流速0.6 mL/min ;示差检测器;柱温35℃ ;进样量5 μL。
1.2.5.4 胞内核苷酸的测定样品的处理:取4 mL对数中期发酵液,经4℃,12 000 r/min 离心10 min后,弃去上清,得到菌体,将获得的菌体悬浮于2mL 预冷的0.1 mol/L pH7.4 的磷酸钾缓冲液中,超声波破碎(超声1 s,间隔1 s,)10 min,之后经4℃,12 000 r/min 离心10 min,得到的上清于HPLC 中进行测定。
色谱条件:色谱柱为InertSustain C18柱(5 μm,4.6mm×250 mm,Shimadzu);流动相为20% 乙腈与含20 mmol/L 四丁基溴化铵的0.4 mol/L pH7.0 磷酸钠缓冲液以1∶1 混合;流动相流速0.5 mL/min ;紫外检测器;检测波长254 nm ;柱温25℃ ;进样量10 μL。
2 结果 2.1 装液量对PSA发酵的影响 2.1.1 装液量对PSA 合成和菌体生长的影响由图 1 可以看出,与装液量35 mL 的发酵结果相比,其它装液量下菌体的PSA 产量和生长状况都较差,尤其在装液量大时更为明显。当装液量为50 mL 时PSA 产量和生物量分别为1.08 g/L 和3.02 g/L,而装液量为35 mL 时,PSA 产量和生物量分别达1.51 g/L和4.07 g/L。山梨醇消耗与PSA 产量、菌体生长趋势相一致。如图 1 所示,当装液量为35 mL,菌体的山梨醇消耗量最大,为22.40 g/L。
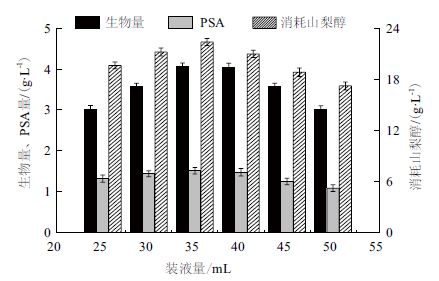
|
| 图 1 不同装液量下的发酵参数 |
不同装液量下有机酸的合成情况如图 2 所示。在装液量小的情况下,柠檬酸合成量较高;当装液量为25 mL 时,柠檬酸的合成量最高,为62.33 mmol/L。而当装液量分别为35 mL、40 mL、45 mL、50 mL 时,柠檬酸的合成量比较接近,为55 mmol/L 左右。获得PSA 产量最高的装液量(35 mL)下,乙酸的合成量也最低(1.82 mmol/L),远低于其它装液量下的乙酸合成量,表明该条件下供氧充足,消耗的山梨醇用于菌体生长和PSA 合成。在各个装液量下乳酸、琥珀酸的合成量较低或无法检测到,而在所有的装液量下没有乙醇的合成(数据没有给出)。
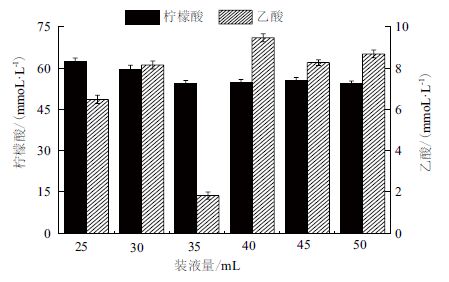
|
| 图 2 不同装液量下的有机酸合成量 |
根据上述结果可知,E.coli 合成PSA 受溶氧的影响,而氧作为ETC 的最终电子受体与氧化磷酸化产生能量密切相关。在不同装液量下胞内能荷与PSA 合成的关系如图 3 所示,随着摇瓶装液量的增大,胞内ATP 含量缓慢下降,从25 mL 装液量的3.22 μM/g·cell 下降到50 mL 装液量的2.65 μM/g·cell,而EC 水平在装液量为35 mL 时最低(0.22),此时PSA 的产量最高。

|
| 图 3 不同装液量下的胞内能荷、UTP、UMP |
在E.coli 合成PSA 的过程中,ATP 除了用于菌体生长外,还用于合成UTP、CTP、GTP 等高能物质。其中UTP 用于UDP- 葡萄糖胺和CTP 的生成,CTP 用于活化PSA 合成前体——N- 乙酰神经氨酸(Neu5Ac)和2- 酮基-3- 脱氧辛酸(KDO),因此菌体细胞内UTP、CTP 的含量也将影响PSA 合成。装液量对胞内UTP、UMP 的影响如图 3 所示,随着装液量的增加,胞内UTP 的量先下降后上升,在装液量为35 mL 时菌体细胞内的UTP 含量最低,为3.38μM/g·cell。而菌体细胞内UMP 的含量随装液量的增加先上升后下降,在装液量为35 mL 时UMP 含量最高,为83.19 μM/g·cell。菌体合成PSA 消耗的UTP 转化为UDP、UMP,从而使UMP 的量明显高于其他装液量。
根据上述分析,菌体PSA 合成和溶氧有紧密的联系,而氧气在代谢过程中作为电子受体接受通过ETC 传递的质子并最终被氧化为水,伴随氧气的氧化同时释放能量,同时携带电子的载体是NADH,其与胞内氧化还原水平密切相关,因此胞内能荷、还原力的变化存在一定的关联性。故初步确定PSA的合成与能荷、还原力有密不可分的关系。
2.2 不同氧化还原状态的碳源对PSA发酵的影响 2.2.1 碳源对PSA 合成和菌体生长的影响分别以40 g/L 山梨醇、葡萄糖、木糖、葡萄糖酸钠为碳源发酵生产PSA,结果如图 4 所示。发现E.coli K235可以利用不同的碳源进行菌体生长,利用葡萄糖酸钠为唯一碳源时菌体干重(1.66 g/L)仅是对照组(4.07 g/L)的40.8%。与其他碳源相比,山梨醇是生产PSA 最有效的碳源。在以葡萄糖、木糖、葡萄糖酸钠为唯一碳源时,菌体的PSA 产量极低,甚至无法合成PSA,而以山梨醇为唯一碳源时,PSA 产量最高。此结果表明,菌体细胞的还原状态较高时更有利于PSA 的生成。

|
| 图 4 不同碳源下的发酵参数 |
在消耗碳源方面,当以山梨醇、葡萄糖、木糖为碳源时,发酵结束时碳源的消耗量分别为22.40g/L、18.88 g/L 和17.35 g/L,消耗碳源量比较接近;而以葡萄糖酸钠为碳源时,发酵结束后葡萄糖酸钠的消耗量达到37.41 g/L,碳源基本全部耗尽,如图 4 所示。利用不同碳源发酵生产PSA 时,山梨醇、葡萄糖、木糖的消耗主要在发酵过程的前25 h,而葡萄糖酸钠为碳源时,其碳源消耗速度非常快,在发酵进行仅12 h时,葡萄糖酸钠的消耗量将近30 g/L。在以葡萄糖酸钠作为碳源时,葡萄糖酸钠的消耗量虽然很高,但是菌体浓度和PSA 产量都较低,且乙酸大量合成。
2.2.2 碳源对有机酸合成的影响在呼吸方式方面,当以山梨醇为碳源时,菌体主要进行有氧呼吸,无氧呼吸产物极少,发酵液中乙酸、乳酸的含量分别仅为1.82 mmol/L 和0.26 mmol/L(图 5)。而当以葡萄糖、木糖、葡萄糖酸钠为碳源时,无氧呼吸明显加强,发酵液中存在大量被氧化的副产物如乙酸,无氧呼吸代谢产物量明显高于以山梨醇为碳源的发酵液中无氧呼吸代谢产物量。以葡萄糖酸钠和葡萄糖为碳源时,发酵液中乙酸的量分别高达287.93mmol/L 和86.57 mmol/L(图 5)。而乙酸的生成伴随1 分子ATP 的生成,这样胞内ATP 水平有所提高,更有利于菌体的生长。另外,一般情况下,乙酸的大量生成是由糖酵解途径和三羧酸循环的不平衡引起的。在以葡萄糖或葡萄糖酸钠为唯一碳源的情况下,除了积累大量的乙酸外,还有较多的乳酸生成(积累的乳酸量分别为1.70 mmol/L 和0.29 mmol/L),比以山梨醇或木糖为碳源的乳酸积累量要高。而乳酸的生成意味着从丙酮酸到乙酰-CoA 这一步的代谢速率降低,从而使糖酵解途径和三羧酸循环之间的不平衡降低。
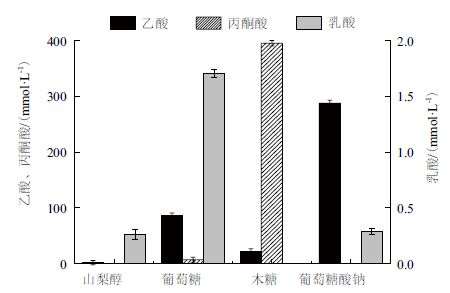
|
| 图 5 不同碳源下有机酸的合成量 |
当以木糖为碳源时,发酵液中存在大量的丙酮酸,高达395.4 mmol/L,没有乳酸的生成,而其他碳源下的发酵液中并无丙酮酸的积累,如图 5 所示。木糖为碳源时发酵液中乙酸的积累相对于葡萄糖、葡萄糖酸钠为碳源时低。由于木糖在代谢过程中主要经过糖酵解途径生成丙酮酸,在丙酮酸节点只有小部分经乙酰-CoA 转化为乙酸。在E.coli 的代谢过程中,由丙酮酸生成乙酰-CoA 时伴随甲酸的生成,而在4 种不同氧化还原状态的碳源下发酵液中都未检测到有甲酸的积累,这可能是由于无氧呼吸形成的甲酸在甲酸脱氢酶(Formate dehydrogenase,FDHF)的催化下分解为二氧化碳和氢气。同时4 种碳源下柠檬酸的合成量较接近、琥珀酸的合成量较低(数据未给出)。
2.2.3 不同碳源对胞内核苷酸的影响分别以山梨醇、葡萄糖、木糖、葡萄糖酸钠为碳源进行PSA 发酵时,最终PSA 合成量明显不同,测定对数中期胞内的EC 水平,结果如图 6 所示。与对照(以40 g/L山梨醇为碳源的发酵)相比,以葡萄糖或葡萄糖酸钠为碳源时,胞内的EC 水平较高,分别为0.42 和0.40,远高于对照的0.22。通过以上分析可知,当以葡萄糖或葡萄糖酸钠为碳源时,菌体在代谢过程中生成浓度较高的乙酸,而乙酸的生成也偶联合成ATP,所以当葡萄糖或葡萄糖酸钠作为碳源时,胞内的ATP、EC 水平相对较高。当以木糖为碳源时,由于菌体生成大量的丙酮酸,积累的丙酮酸并未通过无氧或有氧呼吸的方式释放能量,从而导致以木糖为碳源时,胞内的ATP 水平较低,且EC 水平最低(0.21)。以葡萄糖酸钠为碳源时,虽然生成乙酸量和生成乙酸偶联生成的ATP 量要远远高于以葡萄糖为碳源的情况,但由于其生成PSA 量要高于后者,且在PSA 的合成中需要大量的能量,最终导致胞内ATP、EC 水平低于以葡萄糖为碳源的发酵。
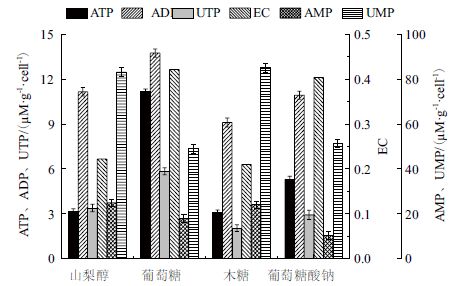
|
| 图 6 不同碳源对胞内核苷酸的影响 |
PSA 的合成需要UTP 的参与并生成UDP- 葡萄糖胺,足量的UTP 是合成PSA 的基础。在4 种不同的碳源下,以葡萄糖为碳源时,胞内的UTP 含量最高(5.85 μM/g.cell)。此时没有PSA 的合成,所以UTP 可以在胞内积累,相应UMP 的量在胞内减少,如图 6 所示。同理,在以葡萄糖、木糖、葡萄糖酸钠为碳源时,PSA 产量越低,胞内UTP 含量越高,UMP 含量越低。当以山梨醇为碳源时,菌体进行有氧呼吸生成的ATP 激活UTP 合成代谢中的天冬酸氨基甲酰转移酶,从而导致胞内的UTP 含量相对较高,且合成PSA 时消耗的UTP 使胞内的UMP、UDP 含量也有所提高,胞内的UMP 量高达83.2 μM/g.cell。
2.3 添加NAD+的前体烟酸对PSA发酵的影响 2.3.1 烟酸对PSA 合成和菌体生长的影响向以山梨醇为碳源的发酵培养基中添加不同浓度的NA,研究NA 对PSA 发酵的影响。当向发酵培养基中添加NA 后,PSA 的产量会下降(图 7),而且生物量、消耗山梨醇量也会随之下降。向培养基中加入不同浓度的NA 后,PSA 产量从对照(没有添加NA)的1.51 g/L 下降到0.5 g/L 左右,生物量同样出现明显的下降趋势。NA 的添加使山梨醇的消耗量明显下降,当添加NA 的量为10 mg/L 时,山梨醇消耗量仅为8.03 g/L,比对照的山梨醇消耗量下降了64.2%。加入NA 后PSA 产量和生物量的下降可能是由于山梨醇的消耗量大幅度降低、微生物细胞的分解代谢受阻所致。
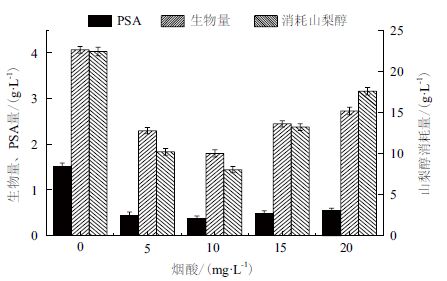
|
| 图 7 烟酸对PSA 发酵的影响 |
微生物细胞中存在大量辅因子,如ATP、ADP、AMP、NADH、NAD+、NADPH、NADP+、乙酰-CoA 及其衍生物、维生素和微量元素等,这些辅因子是大量生化反应的基础。作为辅因子NAD+/H 参与许多生化反应,胞内NAD+/H 的改变会影响细胞生长和代谢产物的合成,甚至导致代谢流发生改变。当向发酵培养基中添加NA 后,使还原性代谢产物(聚唾液酸、琥珀酸、乳酸)的产量降低甚至消失,如图 8 所示。当加入的NA量为5 mg/L 时,琥珀酸和乳酸的合成量从对照的0.14 mmol/L、0.26 mmol/L 分别下降到0.02 mmol/L、0.03 mmol/L。当NA 的添加量高于5 mg/L 时,菌体就不再合成琥珀酸和乳酸。与琥珀酸、乳酸不同的是,当加入NA 后,即使浓度较高,仍有不需要消耗NADH 的乙酸正常合成。乙酸的合成使细胞减少对NADH 的利用量,从而导致细胞氧化还原状态的平衡。添加NA 后,菌体合成的柠檬酸量稍有降低(数据未给出)。
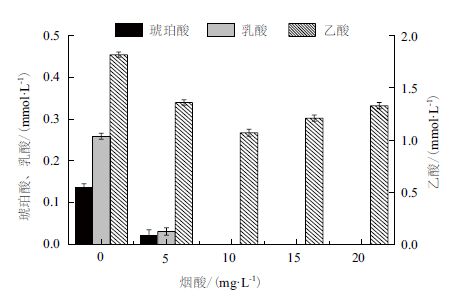
|
| 图 8 烟酸对有机酸合成的影响 |
向山梨醇的发酵培养基中添加不同浓度的NA,其中以不含NA 的培养条件为对照,取对数中期的细胞,测定胞内的EC、还原力水平。由于E.coli 可以NA 作为合成NAD+的前体物质,与对照相比,当向发酵培养基中添加NA 后,胞内的NAD+ 水平提高,如图 9 所示。还原力(NADH/NAD+)水平相对降低,此时菌体会减少对NADH 的利用,从而导致琥珀酸、乳酸的合成量降低(合成琥珀酸、乳酸所需要的酶是依赖NADH的酶),如图 10 所示。
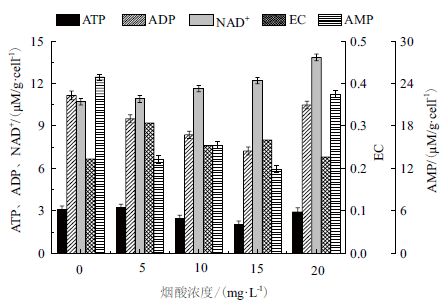
|
| 图 9 烟酸对胞内能荷的影响 |

|
| 图 10 烟酸对胞内NAD+ 量、菌体有机酸合成量的影响 |
在向发酵培养基中添加NA 后,菌体合成的乙酸量降低,而乙酸的生成偶联ATP 的再生,同时,发酵培养基中较高浓度的NA 导致胞内还原力水平降低后,抑制NADH 通过ETC 产生能量,故添加NA 后菌体细胞内的ATP 水平有所降低。如图 9 所示,当加入的NA 量为15 mg/L 时,胞内的ATP 水平仅为2.05 μM/g.cell,比对照的低34.2%。故添加NA 后,ATP 的不足导致PSA 的合成量明显降低,由于用于PSA 合成的ATP 量减少,胞内的EC 水平要高于对照的0.22。
在向发酵培养基中添加NA 后,PSA 合成量降低,故合成PSA 消耗的UTP 量降低,菌体细胞内积累的UTP 量增加,如图 11 所示。当添加10 mg/L NA 后,菌体细胞内的UTP 量高达3.67 μM/g·cell,高于对照的3.38 μM/g·cell。与UTP 的变化相反,当菌体由于添加NA 使合成PSA 的量降低时,菌体细胞内积累的UMP 会降低,从对照的83.2 μM/g·cell 下降到36.6 μM/g·cell。
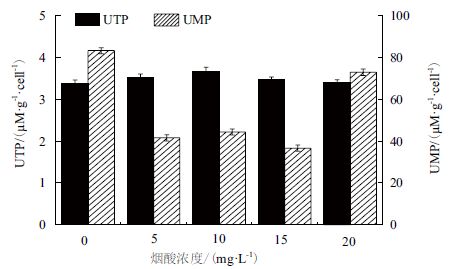
|
| 图 11 烟酸对胞内UTP、UMP 的影响 |
本研究在利用不同氧化还原状态的碳源发酵生产PSA 时,最终PSA 产量明显不同,其中以山梨醇为碳源时PSA 产量最高,这与山梨醇在代谢过程中产生较多的NADH 使细胞处于较高的还原状态有关。Hong 等[23]在利用E.coli 工程菌生产琥珀酸时,选用山梨醇和葡萄糖分别作为碳源,结果表明山梨醇作为碳源提高琥珀酸产量与其提高胞内还原力(消耗1 mol 山梨醇可以形成3 mol NADH,而同样消耗1 mol 葡萄糖却只能产生2 mol NADH)有密切的关系,因为从PEP 向琥珀酸的转化中需要2 分子NADH,而在山梨醇的代谢过程中比葡萄糖可形成更多的NADH[24]。同样在琥珀酸的生产中,Lin等[21]在利用山梨醇为碳源时的产量比以葡萄糖为碳源时的高81%,而琥珀酸产量的提高是在胞内可利用的NADH 量增加时产生,同时胞内NADH 的增加也导致乙醇(在生成乙醇时需要消耗2 分子NADH)的产量提高了62%。最近,Liu 等[25]在利用E.coli 生产莽草酸时,由于山梨醇较高的还原性使莽草酸的产量是用葡萄糖为碳源时的3.7 倍。本研究中以葡萄糖、葡萄糖酸钠为碳源时胞内较高的ATP、EC 水平与乙酸的生成有关,因为乙酸的生成偶联ATP 的合成;以木糖为碳源时,由于菌体生成大量的丙酮酸,积累的丙酮酸并未通过无氧或有氧呼吸的方式释放能量,从而导致以木糖为碳源时,胞内的ATP、EC 水平都较低。
微生物会自动调节胞内的NADH 水平,而对NADH/NAD+ 的比没有严格的要求[26, 27]。向培养基中添加NA 后,虽然胞内NAD+ 总量提高,但NADH水平基本维持平衡状态,从而导致胞内还原力水平下降。由于PSA 的合成需要在较高的还原环境下进行,所以向培养基中加入NA 后,PSA 产量会降低。Liu 等[20]利用光滑球拟酵母发酵生产丙酮酸时,当向发酵培养基中添加8 mg/L NA 后,胞内的NAD+量从未添加NA 的13.1 mg/g DCW 提高到28.6 mg/gDCW,从而降低了胞内NADH/NAD+ 水平;由于在丙酮酸合成代谢中需要消耗NAD+,故导致葡萄糖的消耗速率和丙酮酸的产量分别增加了48.4%、29%。
微生物细胞内NADH/NAD+ 水平的改变会导致代谢产物组成的变化。Berrios-Rivera 等[28]向E.coli内引入来自Candida boidinii 的NADH 再生途径,该途径中的甲酸脱氢酶(Formate dehydrogenase,FDH)可以将甲酸转化为二氧化碳,并伴随NADH 的生成,而存在于E.coli 内的FDH 在催化过程中没有NADH 的生成,故该异源代谢途径的引入可以提高菌体细胞内的还原水平。在厌氧和好氧条件下,异源NADH 再生途径对代谢物的组成都产生显著的影响,在厌氧条件下主要形成还原代谢产物乙醇,而在好氧条件下由于胞内NADH 的增多使菌体在有氧环境中却转向厌氧代谢,主要表现在乙醇、乳酸、琥珀酸等厌氧代谢产物的大量合成中。本研究向E.coli 的发酵培养基中添加NA 后,胞内的NAD+ 水平明显提高,此时菌体就会降低对NADH 的利用。由于琥珀酸合成需要消耗2 分子的NADH,乳酸的合成需要消耗1 分子的NADH,菌体为了达到胞内氧化还原的平衡,减少了向琥珀酸、乳酸的代谢流量,当NA 的添加量大于5 mg/L,菌体甚至停止合成琥珀酸、乳酸。
4 结论可以利用装液量、不同氧化还原状态的碳源、烟酸等来调控菌体细胞内的核苷酸变化。当装液量为35 mL 时,PSA 产量达到最高值1.51 g/L,由于合成PSA 消耗胞内大量的ATP,导致EC 水平较低。较其他碳源而言,山梨醇高的还原性使其成为发酵生产PSA 的最有效碳源。胞内NAD+、NADH 量的改变会影响PSA 合成。当胞内NAD+ 增多会使PSA合成量减少,反之胞内NADH 增多会使PSA 合成量增多。
| [1] | Rodriguez-Aparicio LB, Reglero A, Ortiz AI, et al. Effect of physicaland chemical conditions on the production of colominic acid byEscherchia coli in a defined medium[J]. Applied Microbiologyand Biotechnology, 1988, 27(5-6): 474-483. |
| [2] | Barker SA, Jones RG, Somers PJ. Improvements in the productionand isolation of colominic acid[J]. Carbohydrate Research, 1967,3(3): 369-376. |
| [3] | Inoue S, Inoue Y. Development profile of neural cell adhesionmolecule glycoforms with a varying degree of polymerization ofpolysialic acid chains[J]. The Journal of Biological Chemistry,2001, 276(34): 31863-31870. |
| [4] | Nakata D, Troy FA. Degree of polymerization(DP)of polysialicacid(polySia)on neural cell adhesion molecules(N-CAMS): development and application of a new strategy to accuratelydetermine the DP of polySia chains on N-CAMS[J]. The Journalof Biological Chemistry, 2005, 280(46): 38305-38316. |
| [5] | Haile Y, Berski S, Drager G, et al. The effect of modified polysialicacid based hydrogels on the adhesion and viability of primaryneurons and glial cells[J]. Biomaterials, 2008, 29(12): 1880-1891. |
| [6] | Chen C, Constantinou A, Chester KA, et al. Glycoengineeringapproach to half-Life extension of recombinant biotherapeutics[J].Bioconjugate Chemistry, 2012, 23(8): 1524-1533. |
| [7] | Camino CC, Maria LJ. High production of polysialic acid byEscherichia coli K-92 grow in a chemically defined medium regulatedby temperature[J]. Biological Chemistry Hoppe-Seyler, 1990, 371(11): 1101-1106. |
| [8] | 郭良栋, 钱世钧, 叶军, 等. 产多聚唾液酸的菌种筛选及产酸条件[J]. 微生物学报, 1998, 38(2): 103-107. |
| [9] | 贾薇. 聚唾液酸生产菌的诱变育种及发酵研究[D]. 无锡: 无锡轻工大学, 1999. |
| [10] | Rode B, Endres C, Ran C, et al. Large-scale production andhomogenous purification of long chain polysialic acids from E. coliK1[J]. Journal of Bacteriology, 2008, 135(2): 202-209. |
| [11] | 于军华. 聚唾液酸生产菌种的选育及其发酵工艺的研究[D].无锡: 无锡轻工大学, 2000. |
| [12] | 张琦. 聚唾液酸发酵和分离纯化工艺的研究[D]. 无锡: 江南大学, 2009. |
| [13] | Berrios-Rivera SJ, San KY, Bennett GN. The effect of NAPRTaseoverexpression on the total levels of NAD, the NADH/NAD(+)ratio, and the distribution of metabolites in Escherichia coli[J].Metabolic Engineering, 2002, 4(3): 238-247. |
| [14] | Heuser F, Schroer K, Lutz S, et al. Enhancement of the NAD(P)(H)pool in Escherichia coli for biotransformation[J]. Engineering inLife Sciences, 2007, 7(4): 343-353. |
| [15] | Geertman JM, van Maris AJ, van Dijken JP, et al. Physiological andgenetic engineering of cytosolic redox metabolism in Saccharomycescerevisiae for improved glycerol production[J]. MetabolicEngineering, 2006, 8(6): 532-542. |
| [16] | Zhang YP, Li Y, Du CY, et al. Inactivation of aldehydedehydrogenase : A key factor for engineering 1, 3-propanediolproduction by Klebsiella pneumoniae[J]. Metabolic Engineering,2006, 8(6): 578-586. |
| [17] | Hou J, Lages NF, Oldiges M, et al. Metabolic impact of redoxcofactor perturbations in Saccharomyces cerevisiae[J]. MetabolicEngineering, 2009, 11(4-5): 253-261. |
| [18] | Zhang Y, Huang Z, Du C, et al. Introduction of an NADHregeneration system into Klebsiella oxytoca leads to an enhancedoxidative and reductive metabolism of glycerol[J]. MetabolicEngineering, 2009, 11(2): 101-106. |
| [19] | de Graef MR, Alexeeva S, Snoep JL, et al. The steady-state internalredox state(NADH/NAD+)reflects the external redox state andis correlated with catabolic adaptation in Escherichia coli[J].Journal of Bacteriology, 1999, 181(8): 2351-2357. |
| [20] | Liu LM, Li Y, Shi ZP, et al. Enhancement of pyruvate productivityin Torulopsis glabrata : Increase of NAD(+)availability[J].Journal of Bacteriology, 2006, 126(2): 173-185. |
| [21] | Lin H, Bennett GN, San KY. Effect of carbon sources differingin oxidation state and transport route on succinate productionin metabolically engineered Escherichia coli[J]. Journal ofIndustrial Microbiology and Biotechnology, 2005, 32(3): 87-93. |
| [22] | Svennerholm L. Quantitative estimation of sialic acids[J].Biochimica et Biophysica Acta, 1957, 24(4): 604-611. |
| [23] | Hong SH, Lee SY. Importance of redox balance on the productionof succinic acid by metabolically engineered Escherichia coli[J].Applied Microbiology and Biotechnology, 2002, 58 : 286-290. |
| [24] | San KY, Bennett GN, Berrios-Rivera SJ, et al. Metabolicengineering through cofactor manipulation and its effects onmetabolic flux redistribution in Escherichia coli[J]. MetabolicEngineering, 2002, 4 : 182-192. |
| [25] | Liu XL, Lin J, Hu HF, et al. Metabolic engineering of Escherichiacoli to enhance shikimic acid production from sorbitol[J]. WorldJournal of Microbiology and Biotechnology, 2014, 30(9): 2543-2550. |
| [26] | Wimpenn, JWT, Firth A. Levels of nicotinamide adeninedinucleotide and reduced nicotinamide adenine dinucleotidein facultative bacteria and the effect of oxygen[J]. Journal ofBacteriology, 1972, 111(1): 24-32. |
| [27] | Matin A, Gottschal JC. Influence of dilution rate on NAD(P)andNAD(P)H concentrations and ratios in a Pseudomonas sp. grownin continuous culture[J]. Journal of General Microbiology, 1976,94(2): 333-341. |
| [28] | Berrıos-Rivera SJ, Bennett GN, San KY, et al. Metabolicengineering of Escherichia coli : increase of NADH availability byoverexpressing an NAD+-dependent formate dehydrogenase[J].Metabolic Engineering, 2002, 4(3): 217-229. |




