2. 内蒙古科技大学 数理与生物工程学院,包头014010
2. School of Mathematics,Physics and Biological Engineering, Inner Mongolia University of Science & Technology,Baotou 014010
酵母菌普遍存在于葡萄园葡萄叶片、果实、根际以及土壤团粒中,尤其是叶片和果实表面是各种酵母的天然栖息地。在传统的葡萄和葡萄酒产区,酵母菌已逐渐适应了当地的气候条件、土壤条件和葡萄品种,再加上自然选择的作用而形成适应于不同类型葡萄酒的菌系[1, 2, 3]。酿酒酵母菌的发酵特性因菌株的不同而存在明显差异,菌株的不同导致利用的底物不同、生成的化学物质不同,从而使葡萄酒的呈味物质存在差异,赋予产品独特的风味[4, 5]。从酿造学的观点来看,用本土菌种接种发酵或者与其他菌种相混合进行发酵,可以生产出具有地区特色的葡萄酒[6]。当地优选的菌种由于适宜当地的风土环境,因而具有更强的发酵竞争力。
内蒙古西部地区,属中温带半干旱大陆性气候,日照充足,干旱少雨,昼夜温差大,有效积温高,是我国的优质酿酒葡萄产区。从当地的酿酒葡萄基地中分离具有优良特性的葡萄酒酵母,对酿造具有地域特色和独特风格的产地葡萄酒具有重要的价值。
本研究对分离自内蒙古西部几个葡萄酒产区的6 株酵母菌进行耐受性实验和发酵实验,筛选适于工业生产应用的优良酵母菌株,有望供地方特色葡萄酒生产利用。
1 材料与方法 1.1 材料 1.1.1 实验用培养基YPD 培养基(Yeast Extract Peptone Dextrose Medium)[7]:酵母浸粉1%(W/V),蛋白胨2%(W/V),葡萄糖2%(W/V)。
1.1.2 实验菌株供试菌株为内蒙古西部酿酒葡萄产区通过分离鉴定得到6 株酿酒酵母(Saccharomyces cerevisiae)和1 株商业酵母D254。
1.1.3 菌种活化和扩大培养将保藏的酿酒酵母菌株分别接种于YPD 液体培养基中,于28℃下培养48 h。随后,将活化后的菌种按5%的接种量接种于已装有100 mL YPD 液体培养基的三角瓶中,于28℃、转速72 r/min 摇床中培养。
1.1.4 葡萄汁将新鲜、成熟的赤霞珠葡萄经破碎压榨,过滤取汁,葡萄汁含糖量228.1 g/L,总酸8.5g/L,pH 值3.3,添加总SO2 约60 mg /L。
1.2 方法 1.2.1 酿酒酵母耐受性分析将灭菌的YEPD 液体培养基10 mL 加入带有杜氏发酵管的试管中,分别在采用不同温度(9℃、12℃、15℃、18℃)、不同pH 值(1.5、2.0、2.5、3.0、3.5、4.0),不同浓度的乙醇(10%vol、12%vol、16%vol、18%vol)、SO2(100mg/L、150 mg/L、200 mg/L、250 mg/L)、糖(30%、40%、50%、60%)、盐(8%、10%、12%、14%、16%)条件下,按酵母终浓度106 个/mL 的量接种,做3 个平行重复,25℃下培养3 d,观察酵母菌的生长情况[8]。
1.2.2 发酵试验以赤霞珠为原料酿造葡萄酒,将原料破碎取汁。然后将活化的菌株以终浓度106个/mL 的量接种于1 L 的葡萄汁中,28℃静置发酵。设置3 个平行重复,每隔24 h,摇动瓶子,以驱除CO2,称重。当失重量为24 h 之前总重量的0.2% 时,视为发酵终止。根据CO2 失重量绘制发酵曲线,并测定各菌株发酵液的酒精度、总酸、挥发酸、残糖等指标。
1.2.3 检测方法参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[9],酒精度(20℃条件下)采用酒精计法、残糖量采用费林试剂直接滴定法、总酸(以酒石酸计)采用指示剂法、挥发酸(以乙酸计)采用蒸馏法测定。
1.2.4 统计方法各生化指标数据采用SPASS 19.0统计软件进行分析。差异显著性设为P<0.05。
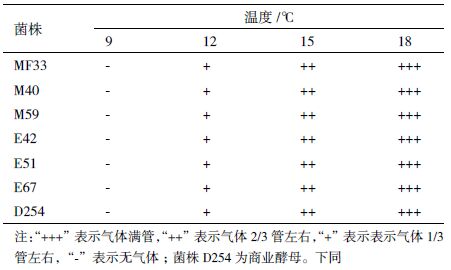
2 结果 2.1 酿酒酵母耐受性试验 2.1.1 酵母对低温耐受性测试结果菌株对低温耐受性测试结果见表 1。由表 1 可知,所有供试菌株均不能耐受 9℃以下的低温,12℃时生长明显受到抑制,各菌株对低温的耐受性无明显差异。
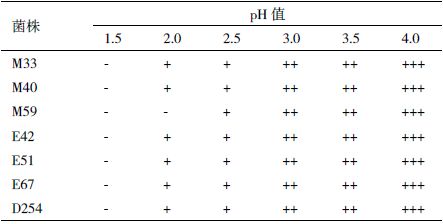
由表 2 可知,在pH 为3.0-4.0 时,所有供试菌株均能旺盛生长;而在pH 为2.5 时,则生长受到抑制,大部分菌株均能耐受pH2.0 的酸度。菌株M59 最低只能耐受pH2.5 的环境,pH2.0 时不能生长,耐受能力最弱。
菌株对酒精耐受性测试结果见表 3。随着酒精含量的增高,酵母菌的生长逐渐减弱。菌株在酒精含量为10%和14%时,均能正常生长。菌株M33 和菌株M59 不能耐受16%的酒精。菌株E42 和E51 的耐酒精能力最强。
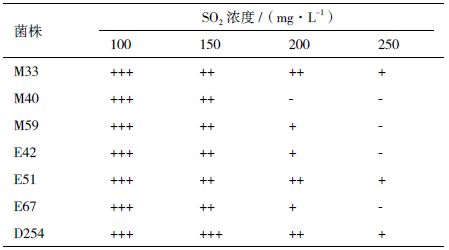
在生产葡萄酒过程中,葡萄原料较好的情况下,SO2 使用量在30-100 mg/L ;在葡萄原料相对较差的情况下,使用量不超过80-150 mg/L[10]。葡萄酒酿造中酵母菌株要求有较高的耐SO2 能力。菌株对SO2 耐受性测试结果见表 4,除M40 外,所有供试菌株均能耐受200mg/L 的SO2。菌株M33、E51 和D254 的耐SO2 能力最强。
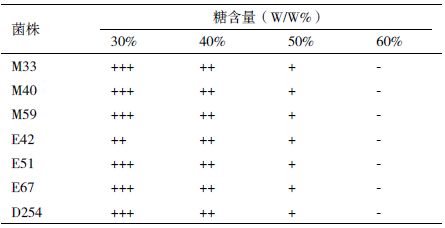
由表 5 可知,所有供试菌株均可耐受50%的糖,糖浓度达到60%时不能生长,各菌株对高糖的耐受性无明显差异。
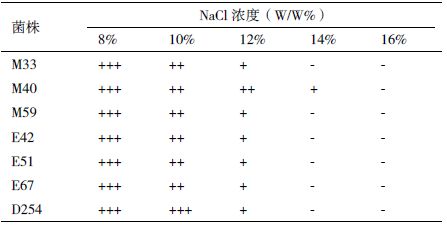
由表 6 可知,NaCl 浓度在8%-10%时,所有供试菌株生长状态良好;当浓度达到14%时,大部分的供试菌株不能生长,菌株M40 能耐受14%的NaCl,耐受能力最强。
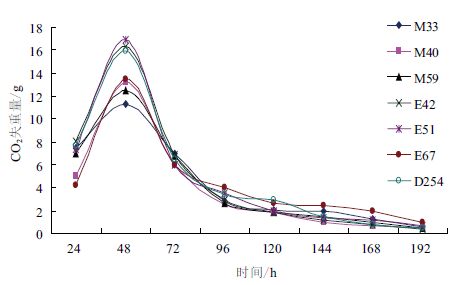
不同酵母发酵速率变化曲线见图 1。从图 1 中可以看出,菌株E67、M40 起酵迟缓,其余菌株起酵较快且起酵时间相差不大;发酵进行到48 h 时,所有菌株的CO2 失重量达到高峰,此时发酵速率最高,其后速率逐渐降低。
|
| 图 1 不同酵母发酵速率变化曲线 |
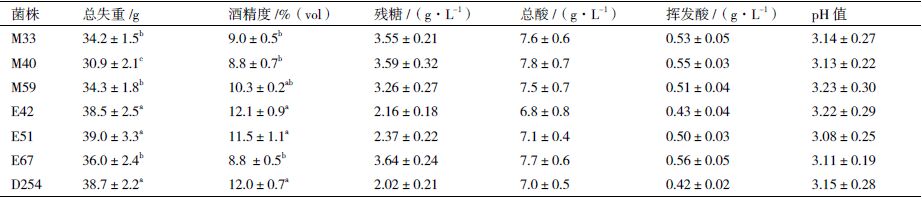
不同酵母发酵的葡萄酒的理化指标见表 7。据表 7 可知,所有菌株发酵的葡萄酒的酒精度、残糖和挥发酸等指标均符合国家标准[11],即葡萄酒的酒精度≥ 7%(vol),干葡萄酒残糖含量≤ 4 g/L,挥发酸含量≤ 1.2 g/L。商业菌株D254 与菌株E42 和E51 总CO2 失重量、酒精度差异不显著,但与其他菌株差异显著。由此可知,6 株本土酵母菌中E42 和E51 的总CO2 失重量最高、产酒精能力比较强,虽然E51 酒样挥发酸比商业菌株D254 高,但挥发酸含量均符合国家标准理化指标要求。
酿酒酵母在发酵过程中会受到各种胁迫条件的影响,当胁迫条件超过细胞的生理功能极限时便会对细胞的生存能力和发酵过程产生负面的影响[12]。为了避免发酵过程受到阻遏或发生迟滞现象,要求酵母必须具备足够的胁迫应答能力以抵御不良条件所造成的影响[13]。掌握菌株对胁迫条件的耐受性是进行工业生产的基础,为有针对性地选育菌株提供了依据。
在葡萄酒的酿造中,具有较高酒精耐性的酵母菌株是保证较高的酒精产率和发酵顺利进行的前提条件。酒精浓度过高会对酵母产生毒性,抑制细胞的生长及发酵活性。所以,酵母的发酵能力很大程度上取决于它们自身耐酒精能力的大小[14, 15]。酒精耐受性不强可能会导致发酵缓慢或终止,糖不能被完全发酵,残糖量较高。酒精耐受性是各种胁迫条件中国内外研究最多的,张穗生等[16]研究了酿酒酵母酒精耐受性机理,邢建宇等[17]采用Plackett-Burman 设计方法研究了培养基的成分对酿酒酵母生长以及乙醇耐受能力的影响。吴华昌等[18]从白酒窖池的酒糟中筛选出一株能耐18% 乙醇的酵母菌株。本试验中,商业酵母D254 不能耐受18% 的酒精,但菌株E42 和E51 在酒精含量为18%仍能生长,优于商业酵母D254,酒精耐受力最强。
高渗透胁迫主要发生在发酵初期,糖是酒精发酵的基质,高浓度的葡萄糖产生的渗透压会抑制酵母菌的生长,因此要求酿酒酵母菌株应具有较高的高渗透耐受性。含糖量在12%-18%的葡萄汁起酵迅速,随着糖浓度的升高,发酵逐渐受到抑制[19, 20]。杨鲁君等[21]从黄酒厂的麦曲、酒药、发酵醪中分离到具有耐高渗透压的酿酒酵母菌株。本试验中的所有菌株均能耐受50% 以下的葡萄糖浓度,不能耐受60% 葡萄糖浓度。NaCl 浓度较高时,使发酵醪具有较高渗透压,同样会引起酵母的一些变化,抑制酵母的生长繁殖和发酵性能[22],试验中的菌株除M40 外,所有菌株均不能耐受14% 的NaCl。
在本研究的酵母耐受性试验中,商业菌株D254与供试菌株差异不显著,并没有体现它的优越性。在酿酒酵母的筛选和评价试验中,小容器发酵是非常关键的试验手段,它必须在相同的发酵条件下,体现不同酵母对葡萄酒的分析和感官质量的影响[23]。发酵试验中各菌株发酵后的葡萄酒的理化指标均符合国家标准,菌株E42 和E51 具有良好的乙醇转化能力。短时间的试验无法对菌株做出全面的评价,其在中试和大生产中的发酵性能仍需多年大量的观察和试验。
4 结论本研究分离的酿酒酵母各菌株对低温和高糖的耐受性无明显差异;菌株E59 最低只能耐受pH2.5的环境,pH2.0 时不能生长,耐受低pH 值能力最弱;菌株E42 和E51 能耐受18% 的酒精,耐酒精能力最强;E51 和M33 能耐受250 mg/L 的SO2,耐SO2 能力最强;菌株M40 能耐受14%的NaCl,耐受盐能力最强。发酵实验中,菌株E67、M40 的发酵迟缓,其余菌株无差异;菌株E42 和E51 产酒精能力最强。综合比较,菌株E42 和E51 由于耐性优良,产酒精能力强,是具有潜在应用价值的菌株。
| [1] | Fleet GH. Wine[M]. ASM Press, Washington, DC, 2001, 747-772. |
| [2] | Torija MJ, Rozes N, Poblet M, et al. Yeast population dynamics inspontaneous fermentations : comparison between two different wineproducingareas over a period of three years[J]. Antonie vanLeeuwenhoek, 2001, 79(3-4): 345-52. |
| [3] | Granchi L, Ganucci D, Messini A, Vincenzini M. Oenologicalproperties of Hanseniaspora osmophila and Kloeckera corticis fromwines produced by spontaneous fermentations of normal and driedgrapes[J]. FEMS Yeast Research, 2002, 2(3): 403-407. |
| [4] | Lambrechts MG, Pretorius IS. Yeast and its importance to winearoma-a review[J]. South -African Journal for Enology Viticulture,2000(21): 97-129. |
| [5] | Fleet GH. Yeast interactions and wine flavor[J]. InternationalJournal Food Microbiology, 2003, 86(1-2): 11-22. |
| [6] | Heard G. Novel yeasts in winemaking looking to the future[J].Food Australia, 1999(, 51): 347-352. |
| [7] | Barnett JA, Payne RW, Yarrow D. 酵母菌的特征及鉴定手册[M].胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1984. |
| [8] | 苑伟, 王学锋, 刘延琳. 优选酿酒酵母菌株发酵性能研究[J].中国酿造, 2010(9): 48-52. |
| [9] | GB/T 15038—2006. 葡萄酒、果酒通用分析方法[S]. 北京: 中国标准出版社, 2006. |
| [10] | Roger BB, Singleton VL, Hada FB, et al. 葡萄酒酿造学——原理及应用[M]. 赵光鳌, 译. 北京: 中国轻工业出版社, 2001 : 103-107. |
| [11] | GB15037-2006. 葡萄酒[S]. 北京: 中国标准出版社, 2006. |
| [12] | Carrasco P, Querol A, del Olmo M. Analysis of the stress resistanceof commercial wine yeast strains[J]. Archives of Microbiology,2001, 175(6): 450-457. |
| [13] | Ivorra C, Pérez-Ortín JE, del Olmo M. An inverse correlationbetween stress resistance and stuck fermentations in wine yeasts. Amolecular study[J]. Biotechnology and Bioengineering, 1999, 64(6): 698-708. |
| [14] | 吴帅, 肖冬光, 原通磊, 等. 高耐性酿酒酵母菌种的筛选[J].酿酒科技, 2006, 147(9): 37-40. |
| [15] | 张强, 郭元, 韩德明. 酿酒酵母乙醇耐受性的研究进展[J].化工进展, 2014, 33(1): 187-192. |
| [16] | 张穗生, 黄日波, 周兴. 酿酒酵母乙醇耐受性机理研究进展[J]. 微生物学通报, 2009(10): 1604-1608. |
| [17] | 邢建宇, 杨莉. 培养基中各营养组分对酿酒酵母发酵的影响[J]. 食品研究与开发, 2011, 30(2): 139-142. |
| [18] | 吴华昌, 肖振, 邓静. 一株耐高浓度乙醇酒精酵母的筛选及发酵特性的研究[J]. 中国酿造, 2012(3): 111-114. |
| [19] | Madhavan A, Srivastava A, Kondo A, et al. Bioconversion of lignocellulose-derived sugars to ethanol by engineered Saccharomycescerevisiae[J]. Critical Reviews in Biotechnology, 2012, 32(1): 22-48. |
| [20] | 赫尔姆特, 汉斯等, 宋尔康译. 葡萄酒微生物学[M]. 北京: 轻工业出版社, 1989 : 16-26. |
| [21] | 杨鲁君, 蒋予箭, 李余动. 黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J]. 中国食品学报, 2013, 13(9): 71-77. |
| [22] | Chen CS. Wateractivity-concentration models for solutions ofsugars, salts and acids[J]. Journal of Food Science, 1989, 54 : 1318-1321. |
| [23] | 李华. 小容器酿造葡萄酒[J]. 酿酒科技, 2002, 112(4): 70-74. |