2. 山东农业大学生命科学学院,泰安 271018
2. College of Life Science,Shandong Agricultural University,Taian 271018
脂肪酶(Lipase,EC3.1.1.3),又称三酰基甘油水解酶,不仅催化酯水解反应还能催化酯合成反应和转酯反应,为重要的工业酶之一,广泛应用于生物能源、油脂工业、食品加工、皮革绢纺原料脱脂、洗涤工业、医药及饲料工业等诸多领域[1, 2, 3]。洋葱伯克霍尔德氏菌(Burkholderia cepacia)脂肪酶在酶法催化生产生物柴油中极具应用前途[4, 5]。然而,目前脂肪酶的生产成本问题成为酶法制备生物柴油的最大制约因素,优良产酶菌种的发酵工艺优化已成为提高脂肪酶产量和质量的关键途径。本实验室在前期分离鉴定了产脂肪酶的洋葱伯克霍尔德氏菌Lu10-1[6]。本研究拟采用单因素和正交试验对Lu10-1 的产酶条件进行优化,并考察该酶的酶学性质,旨在为进一步提高脂肪酶的市场竞争力和拓宽其工业应用范围奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种洋葱伯克霍尔德氏菌B. cepacia Lu10-1由本实验室保藏。
1.1.2 培养基种子培养基(g/L):蛋白胨 10,牛肉浸提物 5,NaCl 5,pH 值7.0。发酵基础培养基(g/L):蛋白胨10,蔗糖5,K2HPO4 2,橄榄油10,MgSO4 0.5,pH 值7.0。
1.2 方法 1.2.1 培养方法种子培养:将活化菌种接种到10mL 种子培养基中,32℃、200 r/min 培养12 h。发酵培养:根据实验方案改变培养基组成及培养条件,按5% 接种量将上述种子液接入50 mL 发酵培养基中,32℃、200 r/min 培养48 h。
1.2.2 单因素优化改变发酵基础培养基组分如下:(1)碳源:可溶性淀粉、蔗糖、乳糖、葡萄糖、甘油(浓度设0.5%、1.0%、1.5% 三水平);(2)氮源:蛋白胨、酵母粉、(NH4)2SO4、NaNO3、尿素(浓度设1.0%、1.5%、2% 三水平);(3)橄榄油添加量为1 g/L、2 g/L、3 g/L、4 g/L 四水平;(4)K2HPO4:1 g/L、1.5 g/L、2 g/L、2.5g/L、3 g/L ;(5) 金属离子:CaCl2、MgCl2、CuCl2、MnCl2、ZnCl2(浓度设1 mmol/L、2.5 mmol/L 两水平)。
改变发酵条件如下:(1) 培养温度设25℃、28℃、30℃、32℃、37℃五个水平;(2)pH 设7.5、8.0、8.5、9.0、9.5 五个水平。每个实验组只改变一个因素,其他条件一致。
1.2.3 正交试验在以上单因素的基础上,设计正交试验来优化发酵条件,采用“四因素三水平”方案,选取4 个对产酶影响显著的因素进行实验。
1.2.4 分析方法 1.2.4.1 菌体生物量测定采用分光光度计检测菌液在600 nm 波长处的吸光度值,即OD600,以此测定菌体的生物量。
1.2.4.2 脂肪酶酶活测定脂肪酶的酶活力测定采用以橄榄油为反应底物的碱式滴定法[7]。酶活单位(U)定义为:在pH 7.0、50℃条件下,1 min 内水解产生1 μmoL 的的游离脂肪酸所需的酶量。
1.2.4.3 最适反应温度及热稳定性测定
以橄榄油为底物,50 mmol/L 磷酸钾缓冲液(pH8.0),在不同温度(35-80℃)测定脂肪酶活力,以酶活最高为100%,其余酶活与之相比计算相对酶活。将脂肪酶粗酶液放置于50-80℃)的水浴保温,每隔一定时间将部分酶液取出,立即冰浴冷却,测定残留酶活。
1.2.4.4 最适反应pH
值及pH 稳定性测定 以50mmol/L 的Na2HPO4/ 柠檬酸(pH4.0-6.0)、K2HPO4/KH2PO4(pH6.5-8.5)和NaHCO3/Na2CO3(pH9.0-11.0)缓冲液为酶活测定缓冲液,在37℃测定脂肪酶酶活,考察酶的最适作用pH。将酶在不同pH 值(pH5.0-11.0)的缓冲液中,于37℃下放置24 h 后测残余脂肪酶酶活,以初始未保温(4℃,pH8.0)的酶活为100%,残余酶活与之相比计算相对酶活。
1.2.4.5 有机溶剂对脂肪酶酶活的影响5 mL 脂肪酶酶液中加入终浓度75%(V/V)不同有机溶剂(甲醇、乙醇、异丙醇、丁醇、丙酮、正己烷、苯),20℃放置18 h 后测定酶活。以未加有机溶剂的酶活设为100%,其余酶活与之相比计算相对酶活。
1.2.4.6 表面活性剂对脂肪酶酶活的影响5 mL 脂肪酶酶液中加入不同浓度表面活性剂(Triton X-100、Tween 20、Tween 80、SDS 和TDOC),37℃ 保温5 min 后测酶活。以未加表面活性剂的酶活设为100%,其余酶活与之相比计算相对酶活。
2 结果 2.1 B. cepacia Lu10-1产脂肪酶发酵条件优化 2.1.1 种子生长曲线和最佳种龄的确定菌体生长分为延迟期、对数期、稳定期和消亡期4 个时期。由图 1 可知,0-6 h 为菌体生长延迟期,菌株在6 h以后开始进入快速生长的对数期,并在10 h 后进入稳定期,随后菌体生长速度逐渐放慢,在有限的空间内,菌体生长达到饱和。选择对数中后期的菌种最为合适,即可以确定生长8-10 h 的种子为最佳种龄。

|
| 图 1 B. cepacia Lu10-1 种子生长曲线 |
培养基中碳源是最重要的组成部分。分别以0.5%、1.0%,1.5% 三个水平的可溶性淀粉、蔗糖、乳糖、葡萄糖、甘油为碳源,其他条件一致,测定酶活力,将最大脂肪酶活力设为100%,在30℃,200 r/min 摇瓶发酵48 h 以确定碳源对B. cepaciaLu10-1发酵产酶的影响,结果见图 2。可溶性淀粉对B.cepacia Lu10-1 产脂肪酶促进作用最大,且最适浓度为1% ;而乳糖和甘油作碳源时产酶酶活相对较小,不适合作培养基中的碳源。因而,选择1% 可溶性淀粉为碳源最适于脂肪酶产量的提高。

|
| 图 2 碳源对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
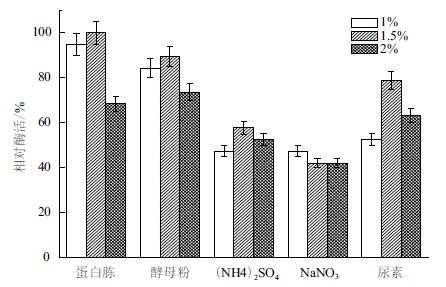
培养基中除了碳源外,氮源也很关键。分别以1.0%、1.5%、2.0% 三个水平的蛋白胨、酵母粉、(NH4)2SO4、NaNO3、尿素为氮源,其他条件一致,测定酶活力。由图 3 可知,蛋白胨对于B. cepaciaLu10-1 产酶作用效果最好,且最适浓度为1.5% ;其次是酵母粉,而(NH4)2SO4、NaNO3 作氮源时产酶酶活只有50%-60%,不适合作发酵培养基的氮源。
|
| 图 3 氮源对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
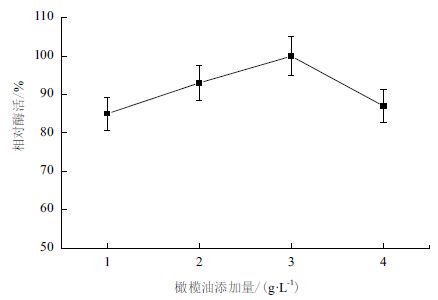
橄榄油是脂肪酶作用的底物,也常作为脂肪酶表达的诱导物,其使用量对脂肪酶诱导表达效果影响很大。发酵培养基中橄榄油的添加量对B.cepacia Lu10-1 发酵产酶的影响结果见图 4。由图 4可知,初始脂肪酶活性随橄榄油添加量增大而提高,橄榄油添加量在3 g/L 时产酶活力最大,随后橄榄油添加量增多反而使脂肪酶活力降低。
|
| 图 4 橄榄油添加量对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
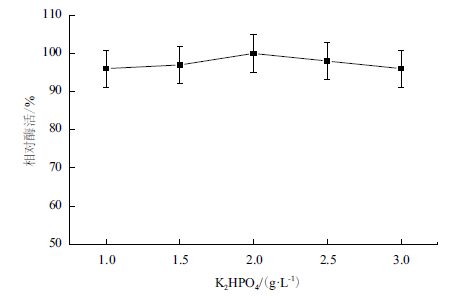
菌株B. cepacia Lu10-1 在不同浓度K2HPO4的培养基中,产酶情况差异不大(图 5)。在2 g/LK2HPO4 的培养基中,菌株产酶能力达到最大值。
|
| 图 5 K2HPO4 对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
为确定金属离子对B. cepacia Lu10-1 产酶是否有影响,分别将1.0 mmol/L 和2.5 mmol/L 的CaCl2、MgCl2、CuCl2、MnCl2、ZnCl2 添加到发酵培养基中,30℃,200 r/min 培养36 h 后测酶活结果见图 6。将最大脂肪酶活力设为100%,由图 6 可知不同金属离子对菌体产脂肪酶的作用不尽相同,Ca2+、Mg2+、Cu2+、Mn2+、Zn2+ 对脂肪酶均没有促进作用,其中1mmol/L 的CaCl2 的抑制作用最大。

|
| 图 6 金属离子对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
温度是菌体生长和蛋白合成分泌的重要影响因素。分别在25℃、28℃、30℃、32℃、35℃,200 r/min条件下摇瓶培养48 h 测定菌体生长和产酶情况,结果见图 7。由图 7 可知,温度过低,使菌体生长缓慢;随温度升高,菌体生长产酶速度加快;在32℃下酶活力达到最大值,但温度过高会导致酶活降低。因此,32℃为菌体生长和产酶的最适温度。

|
| 图 7 温度对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
pH 值也影响微生物代谢和产物合成的另一重要因素。图 8 结果显示,控制初始pH 在8.0-9.0有利于菌株生长和产酶,初始pH 在8.0 时菌体生长最快,在pH9.0 时酶活最高,综合考虑最适产酶发酵培养基的pH 值为9.0。

|
| 图 8 初始pH 值对B. cepacia Lu10-1 产脂肪酶酶活的影响 |
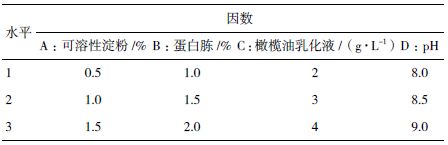
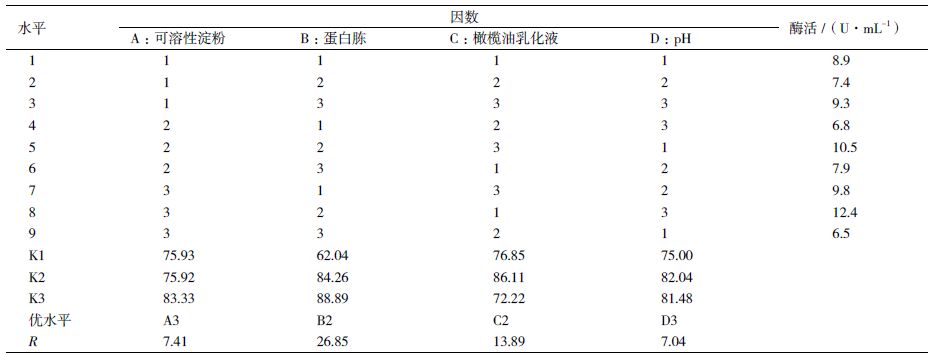
在上述单因素的基础上,设计正交试验来优化发酵条件,采用“四因素三水平”方案,选取可溶性淀粉、蛋白胨、橄榄油乳化液、pH 对产酶影响显著的因素进行实验。具体实验设计方案如表 1 所示。
正交试验结果及极差分析如表 2 所示。极差值的大小表明该因素水平的改变对结果的影响大小,极差值越大,该因素对脂肪酶产量的影响就越大。由表 2 极差值大小,各因素对脂肪酶产量的影响从大到小依次为:蛋白胨、橄榄油乳化液、可溶性淀粉、pH。为了获得最高产量,应选择的最优组合是A3B2C2D3,即可溶性淀粉1.5%,蛋白胨1.5%、橄榄油乳化液3 g/L、pH9。采用此最优组合培养菌体最终酶活达12.4 U/mL,比初始酶活提高2.7 倍。
由于脂肪酶在生物化工、纺织等工业上应用大多需要在高温条件下进行,因此对B. cepacia Lu10-1 脂肪酶的最适温度和热稳定性的考察十分必要。B. cepacia Lu10-1 脂肪酶在35-80℃范围内的酶活力测定结果见图 9-A。随着温度的升高,酶活力也逐渐升高,在温度达到60℃时酶活最高;而当温度继续上升后,酶活力逐渐下降,可能是由于高温造成了酶蛋白逐渐变性。由图 9-A 可知,酶作用的最适温度为60℃,在此温度下酶活力达到最高,以该值作100% 脂肪酶活力,50℃、70℃时脂肪酶相对活力都能达到80%,80℃时酶几乎失活,只有10% 的相对酶活。将B. cepaciaLu10-1 脂肪酶分别于50℃、60℃、70℃和80℃下保温,考察其热稳定性,结果如图 9-B,该酶在60℃以下比较稳定,保温100 h 后仍有80% 以上的活性;在70℃下保温30 h,酶活残留60% 左右,保温100h,酶活仍可达50% 以上;80℃下保温8 h 后,酶活力基本丧失。

|
| 图 9 B. cepacia Lu10-1 脂肪酶的最适温度(A)及热稳定性(B) |
及pH 稳定性 将脂肪酶活力测定缓冲液体系分别调至不同的pH,以最高酶活点为相对酶活100%,相对酶活与pH 的关系如图 10-A 所示。结果表明B. cepacia Lu10-1 脂肪酶的最适pH 为9.0。为考察B. cepacia Lu10-1 脂肪酶的pH 稳定性,将其置于pH 5.0-11.0 的缓冲体系中37℃保温24 h 后,测定残留酶活。由图 10-B 可知,脂肪酶在pH6.0-9.0 范围内均具有很好的稳定性,相对酶活力均保持在95% 以上;在pH5.0-11.0 范围内保温24 h,酶活仍可保持在70% 以上;而当pH 大于10 时,脂肪酶稳定性急剧下降。

|
| 图 10 B. cepacia Lu10-1 脂肪酶的最适pH(A)和pH 稳定性(B) |
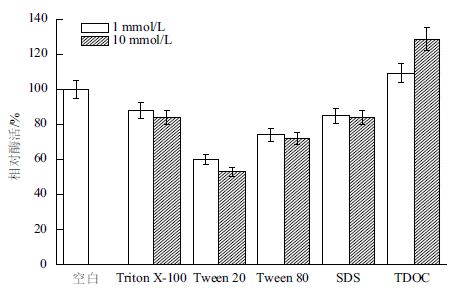
表面活性剂对脂肪酶的影响成为应用的关键。洗涤剂中主要使用的是非离子表面活性剂和阴离子表面活性剂,本研究考察常用的非离子表面活性剂Triton X-100、Tween 20、Tween 80 和阴离子表面活性剂SDS、TDOC 对B. cepacia Lu10-1 脂肪酶活性的影响。结果(图 11)表明,在1 mmol/L 或10mmol/L 浓度下,Triton X-100、Tween 20、Tween 80和SDS 对脂肪酶活性均有抑制作用,其中Tween 20的抑制作用最明显;TDOC 对脂肪酶有一定程度的激活作用,其中10 mmol/L 的TDOC 使脂肪酶活力提高28.7%。
|
| 图 11 表面活性剂对B. cepacia Lu10-1 脂肪酶酶活的影响 |
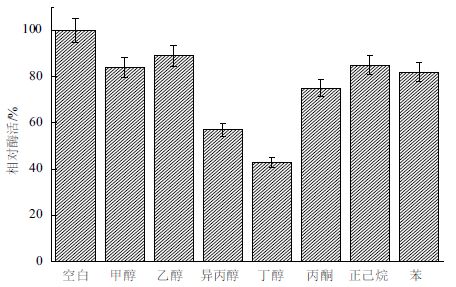
生物柴油的生产在有机相中进行,这就要求参与生产的脂肪酶具有良好的有机溶剂耐受性。将B.cepacia Lu10-1 脂肪酶在终浓度75% 的常用有机溶剂中于20℃保温18 h,考察其在有机溶剂中的稳定性。由图 12 可知,Lu10-1 脂肪酶在甲醇、乙醇、丙酮、正己烷、苯中均具有较好的稳定性,而在异丙醇、丁醇中稳定性较差。Lu10-1 脂肪酶在有机溶剂尤其是甲醇、乙醇中良好的稳定性,使其在生物柴油制造方面显示出巨大的潜力。
|
| 图 12 有机溶剂对B. cepacia Lu10-1 脂肪酶酶活的影响 |
目前,脂肪酶的大规模工业应用仍然受制于酶活低和生产成本高的限制。通过改良发酵参数,创造适合菌体生长和产酶的最佳条件以提高酶产量,降低生产成本在工业上有重要意义。影响微生物脂肪酶发酵的因素主要有:碳源、氮源、诱导剂、金属离子、发酵温度、pH 等。在碳源方面,淀粉等碳水化合物对B. cepacia Lu10-1 脂肪酶发酵有很好的促进作用;在氮源方面,有机氮源相对于无机氮源能更好地促进B. cepacia Lu10-1 发酵产酶;在诱导剂方面,最适浓度的橄榄油可大大提高B. cepacia Lu10-1脂肪酶的产量;在金属离子方面,Ca2+、Mg2+、Cu2+、Mn2+、Zn2+ 对B. cepacia Lu10-1 脂肪酶均没有促进作用,这与Rashid 等[8]研究发现Ca2+ 能显著提高Pseudomonas sp. KB700A 低温脂肪酶产量的结果不一致。采用正交设计法对B. cepacia Lu10-1 脂肪酶的培养基组成和发酵条件进行优化,筛选获得适宜发酵产酶的最优组合,使B. cepacia Lu10-1 脂肪酶产量显著提高。
脂肪酶作为重要的工业用酶之一,其酶学性质也备受关注。不同来源脂肪酶,其适宜温度、作用pH 及酶的抑制剂和激活剂等都有较大差异。因此考察B. cepacia Lu10-1 脂肪酶的酶学性质具有较高的理论价值和应用价值。一般微生物脂肪酶最适温度在30-40℃之间[9, 10]。本研究报道的B. cepacia Lu10-1脂肪酶具有较高的作用温度为60℃,而且稳定性很好,60℃以下保温100 h 仍保持80% 以上的酶活。大多数细菌脂肪酶作用pH 在中性或碱性范围内[10]。本研究报道B. cepacia Lu10-1脂肪酶的最适pH为9.0,有较宽的pH 稳定性,在pH5.0-10.0 之间内保温24h 酶活均超过70%。此外,该酶还表现为较好的耐醇性,在甲醇、乙醇、丙酮、正己烷、苯中保温18h 仍能保持75% 以上的活性。由此可见,B. cepaciaLu10-1 脂肪酶具有热稳定性好、pH 稳定范围宽以及良好的有机溶剂耐受性,已经具备了作为工业用酶的条件,应用前景广阔。
4 结论B. cepacia Lu10-1 适宜发酵产脂肪酶的培养基组成和发酵参数为:可溶性淀粉1.5%,蛋白胨1.5%,橄榄油3 g/L,K2HPO4 2 g/L,发酵温度32℃,初始pH 9.0,培养48 h 酶活达12.4 U/mL,比初始酶活提高了2.7 倍。B. cepacia Lu10-1 脂肪酶的最适温度和pH 值分别为60℃和9,60℃以下保温100 h 仍保持80% 以上的酶活,在pH5.0-10.0 之间内保温24 h 酶活均超过70%,在甲醇、乙醇、丙酮、正己烷、苯中保温18 h 酶活保持75% 以上。
| [1] | Hasan F, Shah AA, Hameed A. Industrial applications of microbiallipase[J]. Enzyme and Microbial Technology, 2006, 9 :235-251. |
| [2] | Jaeger KE, Reetz MT. Microbial lipases form versatile tools forbiotechnology[J]. Trends in Biotechnology, 1998, 16(9):396-403. |
| [3] | Jaeger KE, Eggert T. Lipases for biotechnology[J]. CurrentOpinion in Biotechnology, 2002, 13(4):390-397. |
| [4] | Yang J , Guo D , Yan Y , et al . Cloning , expression andcharacterization of a novel thermal stable and short-chain alcoholtolerant lipase from Burkholderia cepacia strain G63[J]. Journalof Molecular Catalysis B-Enzymatic, 2007, 45(3-4):91-96. |
| [5] | 贾彬, 刘文山, 杨江科, 等. 洋葱伯克霍尔德菌脂肪酶的基因改造及其在毕赤酵母中组成型和诱导型的表达[J]. 微生物学报, 2010, 50(9):1194-1201. |
| [6] | Ji X, Lu G, Gai Y, et al. Colonization of Morus alba L. by the plantgrowth-promoting and antagonistic bacterium Burkholderia cepaciastrain Lu10-1[J]. BMC Microbiology, 2010, 10 :243-254. |
| [7] | Van HE, Litthauer D, Verger R. Biochemical characterisation andkinetic properties of a purified lipase from Aspergillus niger inbulk phase and monomolecular films[J]. Enzyme and MicrobialTechnology, 2002, 30(7):902-909. |
| [8] | Rashid N, Shimada Y, Ezaki S, et al. Low-temperature lipase frompsychrotrophic Pseudomonas sp. strain KB700A[J]. Applied andEnvironmental Microbiology, 2001, 67(9):4064-4069. |
| [9] | 刘光烨, 卢世珩. 烟色红曲霉耐热解脂酶的形成及特性[J].微生物学报, 1995, 35(2):109-114. |
| [10] | 恽丽红. Burkholderia mana SYBC LI-1 产脂肪酶发酵条件优化及酶学性质研究[D]. 无锡:江南大学, 2008. |