2. 中国科学院上海高等研究院,上海 201210
2. Shanghai Advanced Research Institute of Chinese Academy of Sciences, Shanghai 201210
过氧化氢酶(Catalase,简称CAT),催化H2O2分解为H2O 和O2。目前CAT 已广泛应用于食品、纺织、造纸和医药等行业,其中在纺织染整工艺中主要用于织物漂白后残余H2O2 的消除,与传统化学工艺相比,具有环境友好、面料后续印染质量高等优点[1]。但值得注意的是,印染工序通常是在高温(T>70℃)碱性(pH>9)的环境中进行的,这就需要CAT 具备嗜热嗜碱的应用特性。而目前市场上仍缺乏具备优良纺织应用特性的CAT[2]。
CAT 按蛋白催化中心的结构差异可分为两类:(1)含铁卟啉结构CAT,又称铁过氧化氢酶(FeCAT);(2)由锰离子代替铁离子的卟啉结构,又称锰过氧化氢酶(MnCAT)[3]。尽管目前已发现的CAT 中85% 以上属于FeCAT,但近年来研究发现个别来源于高温碱性环境中古细菌的MnCAT 具有嗜热嗜碱的优良特性[4, 5, 6, 7, 8]。例如,本实验室在前期研究中首次实现了Thermus thermophius HB27 来源的MnCAT 在大肠杆菌中的异源活性表达,酶学性质研究表明,该Mn-CAT 在80℃保温2 h,酶活力不损失;在pH9.0-11.0 的环境中放置2 h,残留酶活在90% 以上,具有良好的工业应用潜力[9]。但同时研究发现,该菌株在发酵过程中需添加终浓度为14 mmol/L MnCl2,产酶量才达到最高值25 U/mL[9]。由于MnCAT 的蛋白活性中心含有两个Mn2+,因此在培养基中添加Mn2+,对MnCAT 三维结构的正确折叠具有关键作用。然而过高浓度的Mn2+ 也会对菌体生长产生抑制作用,影响到后续的正常发酵;在这种情况下,通过共表达Mn2+ 转运蛋白MntH 提高Mn2+ 的吸收速率,从而降低蛋白表达对培养基中高浓度Mn2+ 的需求,可能成为一种解决方案,因此本研究进一步构建MntH 与MnCAT 的共表达基因工程菌E. coliBL21(DE3)/pET28a-MnCAT/pACYC-mntH ;同时,考察共表达MntH 蛋白后培养基中Mn2+ 浓度变化对MnCAT 活性表达的影响。此外,在摇瓶水平上还对该菌株的发酵培养基及培养条件进行优化,并在5 L发酵罐中进行验证实验。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒重组大肠杆菌E. coli BL21(DE3)/pET28a-MnCAT/pACYC-mntH,标记为EC-01,由实验室构建保藏。
1.1.2 培养基
LB 培养基(g/L):蛋白胨10,酵母粉5,氯化钠10。添加1.5% 琼脂为LB 固体培养基。初始发酵培养基(g/L):甘油 10,蛋白胨 10,酵母粉 5,K2HPO4 12.54,KH2PO4 2.31,FeSO4·7H2O 0.01,MgSO4·7H2O 0.5。
1.1.3 试剂异丙基-β-D- 硫代半乳糖苷(IPTG)、卡那霉素(Kan)和氯霉素(Cm)等试剂购自上海生工生物工程有限公司;酵母粉、蛋白胨购自Oxoid(英国)公司。其它试剂均为国产分析纯。
1.1.4 引物根据NCBI 数据库中E. coli BL21(DE3)全基因组序列中的mntH 基因序列设计引物,上游引物mntH_F 为:5'-CATATGACGAACTATCGCGTTGAGAGTAGC-3'( 下划线部分为限制性内切酶Nde I 的识别序列);下游引物mntH_R 为:5'-CTCGAGCTACAATCCCAGCGCCGTC-3'( 下划线部分为限制性内切酶Xho I 的识别序列),引物由上海生工生物工程有限公司合成纯化。
1.2 方法 1.2.1 重组表达质粒pACYC-mntH 的构建与鉴 定以E. coli BL21(DE3)的基因组DNA 为模板,利用引物mntH_F 和mntH_R,PCR 扩增基因mntH的DNA 片段;割胶回收PCR 产物,体外连接至载体pMD18-T,转化至菌株E. coli DH5α 感受态细胞;挑选阳性克隆,提取质粒pMD18-mntH,酶切,电泳鉴定后,由上海生工生物工程有限公司测序,对测序结果进行分析。
质粒pMD18-mntH 经Nde I/Xho I 双酶切后,与同样经Nde I/Xho I 双酶切的载体pACYCDuet-1 DNA片段进行体外T4 连接,转化至菌株E. coli DH5α 感受态细胞;挑选阳性克隆,提取质粒,双酶切电泳鉴定后,送至上海生工生物工程有限公司测序,对测序结果进行分析。
1.2.2 培养方法种子培养:取100 μL 保藏于-80℃甘油管中的菌液接入含35 μg/mL Kan 和12.5 μg/mLCm 的LB 培养基中(50 mL 培养基/250 mL 三角瓶),于37℃,200 r/min 培养8-10 h。
发酵培养:将培养8-10 h 的种子以5% 的接种量接入含35 μg/mL Kan 和12.5 μg/mL Cm 的发酵培养基(100 mL 培养基/500 mL 三角瓶),在37℃、200 r/min 培养24 h。
发酵罐培养:5 L 发酵罐中装发酵培养基2.5 L,接种量10%,温度37℃,初始搅拌转速300 r/min,自动流加氨水控制pH 值在7.0,发酵过程中通过调控搅拌转速和通风量控制溶氧(DO)为30%。
1.2.3 锰过氧化氢酶酶活的测定参考文献[10],取1 mL 发酵液于12 000 r/min 离心3 min,收集菌体,用50 mmol/L pH8.0 的Tris-HCl 缓冲液洗涤两次,重悬于1 mL 相同缓冲液中,超声破碎10 min(开5 s,关9 s)后,离心所得上清液即为粗酶液。
采用分光光度法37℃测定CAT 的酶活力,反应体积为3 mL,包括0.1 mL 的酶液样品和2.9 mL 含10 mmol/L H2O2 的50 mmol/L pH 8.0 Tris-HCl 缓冲液,H2O2 的分解速率用紫外分光光度计在240 nm 下测定。酶活活力单位(U/mL)的定义为:在37℃、pH 8.0的条件下每分钟分解1 μmol H2O2 所需的CAT 酶量为一个酶活单位。
2 结果 2.1 重组质粒pACYC-mntH的构建及验证在转化平板上挑选单菌落,培养过夜后提取质粒pMD18-mntH,用限制性内切酶Nde I 和Xho I 进行双酶切,得到长度分别约为1 241 bp 和2 699 bp的两个片段,大小与预期值相符,测序结果显示与NCBI 数据库中的mntH 基因序列一致,表明重组质粒pMD18-mntH 构建正确。
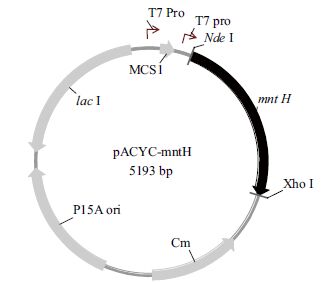
利用限制性内切酶Nde I 和Xho I 分别双酶切质粒pMD18-mntH 和pACYCDuet-1,连接转化后在平板上挑选单菌落,培养过夜后提取质粒,进行双酶切鉴定。如图 1 所示,DNA 凝胶电泳的结果与预期值相符,表明重组质粒pACYC-mntH 构建正确。重组表达质粒pACYC-mntH 物理图谱,见图 2 所示。

|
| 图 1 重组质粒pACYC-mntH 经Nde I/Xho I 双酶切的琼脂糖凝胶电泳 |
|
| 图 2 重组质粒pACYC-mntH 的物理图谱 |
菌株E. coli DH5α/pACYC-mntH 在含Cm 抗性的LB 培养基中过夜培养,提取质粒pACYC-mntH,并将其转化至E. coli BL21(DE3)/pET28a-MnCAT 的感受态细胞中,从而获得 mntH 和MnCAT 共表达基因工程菌BL21(DE3)/pET28a-MnCAT/pACYC-mntH,标记为EC-01。如图 3 所示,SDS-PAGE 分析验证MntH 与MnCAT 共表达,蛋白大小与理论值或文献[8]报道一致。

|
| 图 3 重组大肠杆菌EAC-01 的SDS-PAGE 分析 |
将基因工程菌EC-01 在LB 培养基中活化过夜后,按5% 转接至含有含35 μg/mL Kan 和12.5 μg/mLCm 的发酵初始培养基中,对发酵条件进行优化,考察培养基中的Mn2+ 添加量、碳氮源、诱导条件、培养温度、初始pH 值等对基因工程菌发酵产MnCAT的影响。
2.3.1 Mn2+ 添加量对重组菌发酵产MnCAT 的影 响适量Mn2+ 的存在是MnCAT 蛋白晶体正确三维构象的必要条件,但当Mn2+ 浓度过高时会抑制菌株的生长。在本研究中,当菌株EC-01 在发酵培养基中生长至OD600 0.8-1 时,添加0.1 mmol/L IPTG 进行诱导培养,同时在培养基中分别填加0、1、2、4、6、8、10、12、14 和16 mmol/L MnCl2,考察不同Mn2+浓度对重组菌发酵产MnCAT 的影响。
如图 4 所示,当培养液中的Mn2+ 浓度范围为1-6mmol/L 时,重组菌发酵产MnCAT 的活力较高,其中当Mn2+ 添加终浓度1 mmol/L 时,最终所测得CAT酶活力可达158 U/mL,且在1-6 mmol/L Mn2+ 浓度范围内,菌体的生长量基本相同。本研究在后续实验中选择1 mmol/L 低浓度的Mn2+ 添加量。

|
| 图 4 Mn2+ 浓度对重组菌生长及产MnCAT 的影响 |
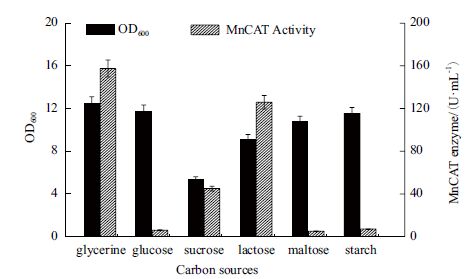
碳源是菌体合成自身骨架的主要物质,是影响菌体生长和外源基因表达的关键因素之一。本实验中菌株EC-01 在碳源分别为总摩尔数相同(以10 g/L 的甘油为基准)的可溶性淀粉、蔗糖、乳糖、葡萄糖、麦芽糖和甘油培养基中培养,考察不同碳源对发酵产MnCAT 的影响。
如图 5 所示,菌株EC-01 对6 种碳源的利用情况差异较大,当分别以甘油、葡萄糖、可溶性淀粉为单一碳源时,菌体培养24 h 后的生长量均较高,麦芽糖次之,而蔗糖为碳源时菌体生长量最低;就产酶情况而言,以甘油为碳源时,检测到的CAT 酶活力最高,乳糖和蔗糖次之,因此确定甘油为最佳碳源。在此基础上,进一步考察了不同甘油浓度对菌体生长和产酶的影响。
|
| 图 5 碳源种类对重组菌生长及产MnCAT 的影响 |
由图 6 所示,当甘油浓度为7 g/L 时,检测到的酶活力最高,达到183 U/mL ;随着甘油添加量的增加,菌体的生长量缓慢降低,产酶量也呈下降趋势。

|
| 图 6 甘油浓度对重组菌生长及产MnCAT 的影响 |
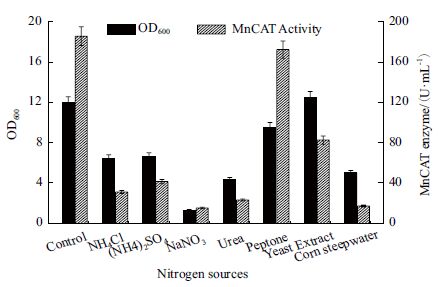
菌株EC-01 以甘油为碳源,分别以总氮摩尔数相同(以初始培养基中的蛋白胨10 g/L 和酵母粉5 g/L 为基准)的NH4Cl、(NH4)2SO4、NaNO3、尿素、蛋白胨、酵母粉和玉米浆作为氮源,考察不同氮源对发酵产MnCAT 的影响。
由图 7 所示,以蛋白胨为氮源时菌体的产酶量较高;而当以酵母粉为氮源时,菌体的生长量最大;对照培养基中采用蛋白胨和酵母粉复合氮源,此时菌体的生长量和MnCAT 产量均比较高;而以其它物质作为单一氮源时,菌体的生长量和产酶量均受到严重影响。在此基础上,进一步考察了在质量总量相同的情况下,考察了不同比例的酵母粉∶蛋白胨配比(1∶1,1∶2,1∶3,1∶4,1∶5)对菌体生长和产酶的影响。
|
| 图 7 氮源种类对重组菌生长及产MnCAT 的影响 |
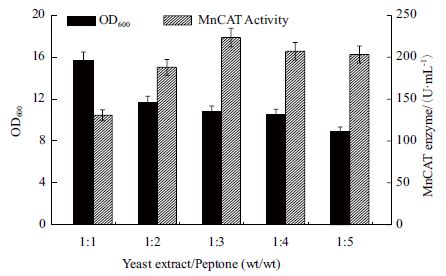
由图 8 所示,当酵母粉和蛋白胨的复配比例为1∶1 时,菌体的生长量最高;而当酵母粉和蛋白胨的复配比例为1∶3 时,菌体的产酶量最高,检测酶活可达223 U/mL,是对照复配比1∶2 条件下的1.2倍。综合考虑,在后续的实验中选择酵母粉和蛋白胨的复配比例为1∶3。
|
| 图 8 酵母粉和蛋白胨复配比例对重组菌生长及产MnCAT的影响 |
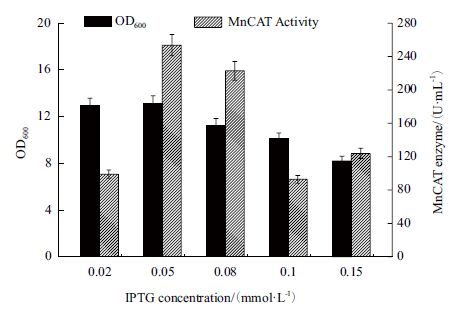
IPTG 作为诱导剂,其浓度对重组蛋白的合成速率和表达水平具有重要影响,本实验选择IPTG 诱导浓度分别为0.02、0.05、0.08、0.1、0.15、0.3、0.5mmol/L,考察IPTG 浓度对发酵产MnCAT 的影响。
由图 9 所示,尽管随着IPTG 浓度的增加,MnCAT 的诱导表达强度会逐渐增强,但IPTG 对菌体的毒性作用也逐渐显现;当IPTG 浓度大于0.05mmol/L 时,菌体的生长量和产酶量均开始下降,因此,最佳的IPTG 诱导浓度为0.05 mmol/L。
|
| 图 9 IPTG 浓度对重组菌生长及产MnCAT 的影响 |
由于IPTG 具有一定的生理毒性,添加至培养基中时会对菌体的正常生理代谢活动产生影响,因此在添加IPTG 前,先让菌体生长至一定菌浓,将有助于重组酶的活性表达。本实验分别选取菌株生长至OD600 为1、5、10 时,添加0.05 mmol/L IPTG 进行诱导培养,这3 个OD600 值分别处于菌体生长的延滞期、对数生长前期和对数生长后期。
由图 10 所示,改变初始诱导菌体浓度后,菌体的生长量变化不大,但对菌体的产酶量影响显著。当初始诱导菌体浓度为5 时,检测到CAT 酶活值达到378 U/mL,是对照条件下(初始诱导菌体浓度为1)时1.7 倍,可见在对数生长前期进行IPTG 诱导发酵,产酶效果最佳。

|
| 图 10 初始诱导菌体浓度对重组菌发酵生产MnCAT 的影响 |
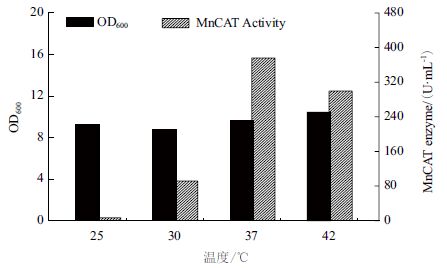
当重组菌EC-01 在37℃培养至OD600 约为5 时,添加0.05 mmol/L IPTG,分别选择25℃、30℃、37℃ 和42℃诱导培养,考察不同诱导温度对重组菌发酵生产MnCAT 的影响。
如图 11 所示,当采用37℃进行诱导发酵时,菌株的产酶量最高,酶活分别是30℃和42℃的4.1倍和1.2 倍;当采用25℃进行诱导发酵时,菌株基本不产MnCAT。
|
| 图 11 诱导温度对重组菌发酵生产MnCAT 的影响 |
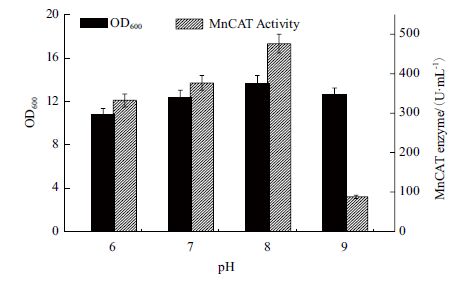
改变发酵培养基的初始pH,从而考察不同初始pH 对菌体生长和产酶的影响。如图 12 所示,当初始培养基pH 为8 时,菌体的生长量和产酶量均最高,检测酶活性可达476 U/mL。
|
| 图 12 初始pH 对重组菌发酵生产MnCAT 的影响 |
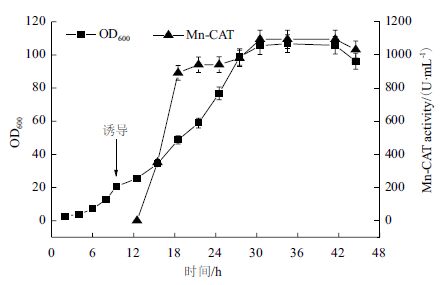
根据摇瓶发酵优化的最佳营养及环境条件,选择在5 L 发酵罐中进行验证;发酵过程中当初始碳源耗尽后,采用pH-stat 方式进行了甘油的流加。如图 13 所示,在发酵0-6 h,菌株生长处于延滞期,之后菌体进入对数生长期;当在对数生长期前期添加IPTG 进行诱导后,MnCAT 开始大量合成,在发酵12-18 h 期间MnCAT 快速增加,之后进入缓慢增加的状态,当发酵30 h 时,菌体的产酶量最高,检测酶活性可达1 094 U/mL ;在发酵30 h 以后,菌体进入稳定期;在发酵41 h 后,菌体生长进入了衰退期。
|
| 图 13 重组菌株EC-01 发酵产MnCAT 的过程曲线 |
高温嗜碱过氧化氢酶是纺织工业清洁生产的一种重要酶制剂,其菌种选育一直受到研究者的关注。目前,文献报道的CAT 主要以FeCAT 为主,其酶学性质随筛选环境的不同而显示差异。例如,赵志军等[10]从碱性纺织废水中筛选获得了产过氧化氢酶菌株 Bacillus subtilis WSHDZ-01,其所产CAT 的最适pH 范围为pH 9.0-11.0,但最适温度范围为30-50℃,属于中温嗜碱酶。而Zeng 等[11, 12]筛选获得一株产CAT 的沙雷氏菌SYBC08,其所产CAT 的最适温度范围为50-70℃,但最适pH 范围为pH 6.0-8.0 属中性酶。与这些FeCAT 相比,一些来源于火山口古细菌的MnCAT 具有良好的嗜热嗜碱特性。例如,来源于Metallosphaera hakonensis 和Thermusthermophius 的MnCAT 的最适pH 最适温度均能满足纺织印染工序环境条件(T>70℃,pH>9)的要求[7, 8]。
值得的注意的是,尽管上述MnCAT 的具有良好的酶学特性,但该类酶目前报道的酶活值最高仅为20-25 U/mL[9],而已报道的FeCAT 酶活值最高可达50 369 U/mL[13],这主要是由于该类MnCAT 的原始菌株筛选至火山口等恶劣环境中,原始菌株的规模化培养存在困难,而其基因工程菌的构建与发酵优化方面的研究才刚刚起步[6]。本研究结果表明,当Mn2+ 转运蛋白MntH 与来源于Thermus thermophilusHB27 的MnCAT 的进行共表达时,培养基中添加少量的Mn2+ 就可以满足MnCAT 蛋白正确折叠的需求;而同时随着培养液中Mn2+ 浓度的降低,可大幅降低Mn2+ 对菌体正常生长的抑制作用,为后续的发酵条件优化研究奠定基础。通过摇瓶培养基和培养条件的优化,菌株的产酶量达到可达476 U/mL,是优化前(158 U/mL)的3 倍,是单独表达MnCAT 时酶活(25 U/mL)的19 倍;当将摇瓶最佳培养基及最佳培养条件在5 L 发酵罐中进行验证时,MnCAT 的酶活值进一步提高至1094 U/mL,为目前文献报道的大肠杆菌表达该类嗜热耐碱含锰过氧化氢酶的最高酶活水平。这些研究成果表明该类高温嗜碱MnCAT 基因工程菌在发酵优化方面仍有较大的提升潜力。
4 结论本研究成功构建了Mn2+ 转运蛋白MntH 与MnCAT 共表达的大肠杆菌基因工程菌,使得MnCAT在低浓度Mn2+ 培养液中实现了高效活性表达;通过单因素实验进一步优化了发酵培养基组分和发酵环境条件,大幅提高了MnCAT 的表达活性,增强了该酶的应用前景。
| [1] | 张东旭, 堵国成, 陈坚. 微生物过氧化氢酶的发酵生产及其在纺织工业的应用[J]. 生物工程学报, 2010, 26(11):1473-1481. |
| [2] | 冷晒祥, 钱国坻, 华兆哲, 等. 漂白残液酶解处理对活性染料染色的影响[J]. 纺织学报, 2007, 28(7):77-81. |
| [3] | Chelikani P, Fita I, Loewen P. Diversity of structures and propertiesamong catalases[J]. Cellular and Molecular Life Sciences, 2004,61(2):192-208. |
| [4] | Hidalgo A, Betancor L, Mateo C, et al. Purification of a catalasefrom Thermus thermophilus via IMAC chromatography :effect of thesupport[J]. Biotechnology Progress, 2004, 20(5):1578-1582. |
| [5] | Thompson VS, Schaller KD, Apel WA. Purification andcharacterization of a novel thermo-alkali-stable catalase fromThermus brockianus[J]. Biotechnology Progress, 2003, 19(4):1292-1299. |
| [6] | Whittaker JW. Non-heme manganese catalase-the‘ other’ catalase[J]. Archives of Biochemistry and Biophysics, 2012,( 525):111-120. |
| [7] | Ebara S, Shigemori Y. Alkali-tolerant high-activity catalase froma Thermophilic bacterium and its overexpression in Escherichiacoli[J]. Protein Expression and Purification, 2008, 57(2):255-260. |
| [8] | Hidalgo A, Betancor L, Moreno R, et al. Thermus thermophilus asa cell factory for the production of a thermophilic Mn-dependentcatalase which fails to be synthesized in an active form in Escherichiacoli[J]. Applied and Environmental Microbiology, 2004, 70(7):3839-3844. |
| [9] | 何晓娟, 薛正莲, 赵志军, 等. Thermus thermophilus HB27 锰过氧化氢酶在大肠杆菌中的表达及酶学性质分析[J]. 中国生物工程杂志, 2014, 34(2):52-58. |
| [10] | 赵志军, 华兆哲, 刘登如, 等. 碱性过氧化氢酶高产菌的筛选, 鉴定及发酵条件优化[J]. 微生物学通报, 2007, 34(4):667-671. |
| [11] | Zeng HW, Cai YJ, Liao XR, et al. Production, characterization,cloning and sequence analysis of a monofunctional catalase fromSerratia marcescens SYBC08[J]. Journal of Basic Microbiology,2011, 51(2):205-214. |
| [12] | Zeng HW, Cai YJ, Liao XR, et al. Serratia marcescens SYBC08catalase isolated from sludge containing hydrogen peroxideshows increased catalase production by regulation of carbonmetabolism[J]. Engineering in Life Sciences, 2011, 11(1):37-43. |
| [13] | 周丽萍, 过氧化氢酶基因工程菌的构建与发酵优化[D]. 无锡:江南大学, 2011. |




