2. 天津双联科鑫生物科技有限公司,天津 300403
2. Tianjin Shuanglian Kexin Biotechnology Co.,Ltd,Tianjin 300453
铁元素不仅参与维持微生物细胞内多相体系的渗透平衡,还是微生物代谢过程中多种酶反应的必要成分,铁元素的缺乏能够限制微生物的生长。在中性和碱性条件下,铁元素主要以不溶的矿物质形式存在,难以满足微生物的正常生长。在可溶性铁极度缺乏的环境中,微生物通过合成和分泌铁载体获取铁元素。铁载体是一类特异性螯合Fe3+ 的金属配体,与Fe3+ 结合的官能团和中心结构具有多样性,主要包括氧肟酸型、儿茶酚型和多羟基羧酸型[1]。
铁载体对Fe3+ 具有较高亲和力,与Fe3+ 形成稳定的络合物,在任何pH 值下对不溶性铁矿物质的溶解度都有显著地影响。有研究报道,假单胞菌Pseudomonas sp. 和P. mendocin 在铁元素缺乏下,能够从不溶性的赤铁矿(Hematite)中获取铁元素维持自身的生长[2, 3]。假单胞菌产生的铁载体,不能被本属以外的其它微生物利用,因此能够抑制其它微生物的生长,减少植物根部病原菌的数量;同时,铁载体铁离子络合物也可作为一种铁源被植物利用,促进植物的生长,这些特点使假单胞菌在植物的生物防护中能够发挥重要作用[4]。
为了进一步挖掘微生物资源,本研究从环境中分离了高产铁载体菌株,分析了铁载体对4 种常见致病菌的抑制作用,同时还分析了铁载体溶解不溶性未定型铁氧化物(Poorly crystalline iron hydroxides,PCIH)的能力,旨在为生防菌的候选菌株,用于植物细菌性感染的防治和促进植物的生长。
1 材料与方法 1.1 材料Luria-Bertani(LB)培养基用于细菌的常规培养;Modified Sucrose-Aspartate 培养基(MSA)、ModifiedKing B 培养基(MKB)、Succinate medium(SM)[5]和Arginine medium(AM)[6],主要用于细菌铁载体的合成;Chrome Azurol S 溶液(固体CAS 则需额外添加10 g/L 琼脂)[7],用于检测铁载体。
未定型铁氧化物(Poor crystalline iron hydroxides,PCIH) 的制备:0.02 mol/L Fe(NO3)3,快速加入1 mol/L NaOH 至pH 值为7.0,室温下搅拌24h,离心,水洗除去大量的Na+ 和NO3- 后,真空冷冻干燥24 h。使用前加入到培养基中,115℃灭菌25 min[8]。
1.2 方法 1.2.1 高产铁载体菌株的筛选取蓟运河土壤梯度稀释,稀释液涂布在MSA 平板上,待菌落长出后覆盖一层CAS 蓝色培养基,观察菌落周围颜色变化,15 min 内与CAS 发生颜色变化的菌株被定义为PSSP(Potentially strong siderophore producers);而颜色变化不完全或者颜色变化时间超过12 h 的菌株被定义为BSP(Borderline siderophore producers)[9],将菌落周围颜色发生变化的菌株划线纯化。挑单菌落于液体MSA 培养基中,30℃、200 r/min 培养24 h 后,10 000 r/min 离心5 min,取等体积无细胞上清与CAS 溶液混合,室温下静置1 h,测定OD680[10]。用铁载体活性单位(Siderophore units,SU)表示铁载体的产量,SU=[(Ar-As)/Ar]×100%,Ar 是未接种的培养基与等体积CAS 混合OD680,As 是菌株上清与等体积CAS 混合OD680 ;并对细菌产铁载体能力进行划分,As/Ar 从1.0-0 之间以0.2 为间隔,每减小0.2 增加一个“+”,一般产铁载体能力较高的细菌其As/Ar 低于0.5[11]。
1.2.2 琼脂扩散法测定PSSP菌株对常见致病菌的抑菌情况 采用琼脂扩散法[12]测定PSSP 菌株的抑菌效果,具体步骤是对PSSP 菌株单菌落打孔,连同培养基一起取出放置在事先涂布有金黄色葡萄球菌、藤黄微球菌、普通变形杆菌和副溶血性弧菌的MKB平板上,37℃培养12-24 h,测定抑菌圈大小。
1.2.3 菌株的分子鉴定铁载体按照文献提供的方法提取菌株的基因组DNA[13],并以此为模板利用通用引物27F 和1492R 扩增16S rRNA 片段,PCR产物纯化后进行序列测定,将得到的序列递交于GenBank,通过Blast 检索,在GenBank 中的已知序列中进行同源性分析,确定与分离菌株同源程度最高的序列;同时利用Ribosomal Database Project Ⅱ软件Classifer,对分离的菌株进行进一步分类分析;利用MEGA5.0 中Neighbor-Joining 方法构建系统进化树,确定菌株的进化地位。
1.2.4 液体混合法测定铁载体对常见致病菌的抑菌情况在MSA 培养基中加入FeCl3,使培养基中Fe3+ 的终浓度分别为0、0.5、1、5、10、100、200μmol/L,30℃、200 r/min 培养,每个浓度3 个平行,24 h 后测定菌株的生长和铁载体产量SU。Z158 在Fe3+ 终浓度为0 和100 μmol/L 条件下的发酵液上清以20% 的体积加入到已接种指示菌的液体MKB 培养基中,同时以只接种指示菌的液体MKB 培养基为对照,每组3 个平行,16 h 后测定指示菌的生长状况OD600[11]。
1.2.5 不同培养基对菌株Z158 铁载体产量的影响MKB 培养基、MSA 培养基、SM 培养基和AM培养基,4 种常用于铁载体产生的培养基,同时以LB 培养基作对照培养Z158,每组3 个平行,24 h后测定Z158 在不同培养基中铁载体产量SU。
1.2.6 菌株Z158 对不溶性未定型铁氧化物的利用实验每升培养基中添加1 g 8- 羟基喹啉,充分混匀后加入500 mL 氯仿萃取8- 羟基喹啉,上层无色透明溶液即是无铁SM 培养基[14]。在无铁SM 培养基中分别加入3 种不同形式的铁源,即0.1 g/L 不溶性PCIH 粉末、终浓度为1 μmol/L Fe3+ 和终浓度为1μmol/L EDTA-Fe3+,同时以无铁培养基为对照,每组3 个平行,12 h 和24 h 时测定Z158 生长情况和铁载体产量。
本实验使用到的玻璃器皿均用浓盐酸溶液过夜浸泡,然后去离子水清洗3 遍。实验中避免使用铁制器械,接种采用铂金丝接种针。
2 结果 2.1 高产铁载体菌株的筛选利用MSA-CAS 平板从土壤样品中共分离到172 株产生铁载体的菌株,PSSP(Potentially strongsiderophore producers)菌株有13 株,BSP(Borderlinesiderophore producers)菌株有159 株。进一步用液体CAS 方法定量测定了分离菌株的铁载体产量,发现BSP 菌株的SU 值均在60% 以下,与MSA-CAS平板上BSP 菌株的颜色变化缓慢一致;13 株PSSP菌株产生铁载体的能力均为++++,其中菌株Z13 铁载体产量最大,SU=74.6%(表 1)。
采用琼脂扩散法分析分离菌株的抑菌能力,结果显示,13 株PSSP 菌株中,10 株对普通变形杆菌有抑制作用,2 株对金黄色葡萄球菌有抑制作用,1株对副溶血性弧菌有抑制作用,1 株对藤黄微球菌有抑制作用。其中菌株Z158 对金黄色葡萄球菌、藤黄微球菌、普通变形杆菌和副溶血性弧菌4 种指示菌都有明显的抑制作用,抑菌圈大小分别为15.0mm、13.8 mm、10.1 mm 和8.9 mm。根据抑菌数据,选择菌株Z158 作进一步分析。
菌株Z158 在含有0 μmol/L 和100 μmol/L Fe3+ 的培养基中铁载体产量分别为70.8% 和19.9%,将两种不同铁载体含量的无细胞上清分别与4 种致病菌分别混合培养,结果显示低铁载体含量上清几乎无抑制作用,高铁载体含量上清对金黄色葡萄球菌、藤黄微球菌、普通变形杆菌和副溶血性弧菌的抑菌率分别为51.3%、50.2%、37.1% 和28.0%(图 1)。
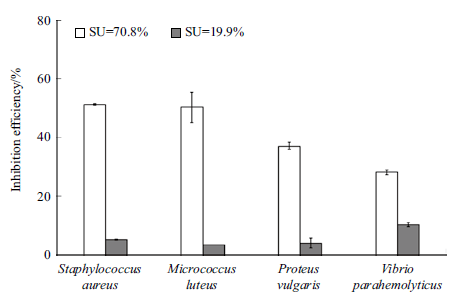
|
| 图 1 菌株Z158 不同含量的铁载体对致病菌的抑菌率 |
根据材料与方法所述,扩增菌株Z158 的16SrRNA 基因片段,测序后得到扩增的基因片段长度为1 418 bp,上传至GenBank 获得的登录号为KP322019。通过Blast 检索,与GenBank 中的已知序列进行比对,发现与Pseudomonas aeruginosaALK319 同源程度为100%。为了进一步对分离菌株进行分类,利用16S rRNA 专业网站RibosomalDatabase Project Ⅱ提供的工具Classifier,对Z158 的序列进行分析,鉴定该分离菌株与铜绿假单胞菌的同源程度为100%。构建Z158 系统进化树(图 2),Z158 与P. aeruginosa ATCC15692、P. aeruginosaPAO1、P. aeruginosa 4EA 和P. aeruginosa ALK319 的同源程度高,遗传差异小;其中P. aeruginosa PAO1是典型模式菌株,能产生对Fe3+ 高亲和力的脓青素(Pyoverdine);从印度果阿邦分离到的P. aeruginosa4EA 可产生pyochelin 和pyoverdine 两种铁载体。综合以上结果,鉴定Z158 属于铜绿假单胞菌。
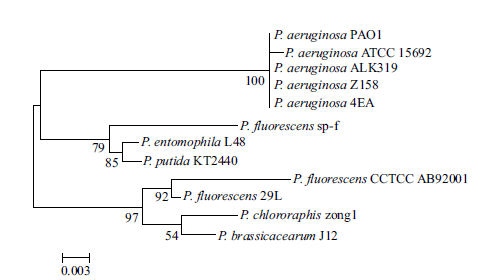
|
| 图 2 Z158 系统进化树 |
菌株Z158 在5 种含有不同碳氮源和微量元素的培养基中的生长和铁载体产量不同,从表 2 可知,Z158 在营养丰富的LB 培养基上生长最好,但铁载体含量最低,说明LB 适合菌株生长却不适合铁载体的产生;SM、MSA 和AM 培养基都适合Z158 的铁载体产生,综合OD600 和SU,我们选择SM 培养基作为菌株Z158 最适产铁载体的培养基。
铁载体在不同培养基中的产量不同,可能是培养基中Fe3+ 浓度的差异造成的。在SM 培养基中添加不同浓度的Fe3+,分析铁载体的产量。结果如图 3所示,随着培养基中Fe3+ 浓度的增加,菌株Z158 的铁载体产量下降,当Fe3+ 浓度达到5 μmol/L 时,SU降低至17.2% ;同时我们还观察到,菌株Z158 的铁载体在随着Fe3+ 浓度增加而减少时培养基的颜色也发生变化,随着Fe3+ 浓度的增加黄绿色变浅,当Fe3+ 浓度为5 μmol/L 以上时,培养基颜色为白色且不再发生变化。
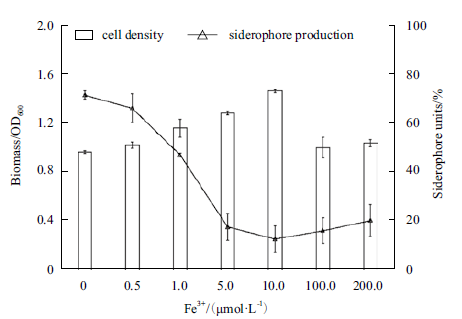
|
| 图 3 Fe3+ 浓度对铁载体产量的影响 |
铁载体的功能之一是螯合环境中的不溶性铁,为微生物和植物生长所利用。我们在实验室制备了未定型铁化合物PCIH,分析菌株Z158 的生长状况。结果如图 4 所示,菌株Z158 在含有0 μmol/L Fe3+、1 μmol/L Fe3+、1 μmol/L EDTA-Fe3+ 和PCIH 培养基中,培养12 h 时OD600 分别是0.28、0.56、0.53 和0.34 ;24 h 时OD600 分别为0.24、0.62、0.59 和0.36。结果显示,不溶性PCIH 能够明显促进菌株Z158 的生长,菌株Z158 合成分泌的铁载体能够通过溶解螯合作用,从不溶性铁化合物中获取铁元素。
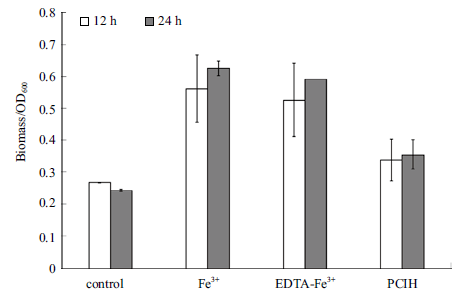
|
| 图 4 菌株Z158 在不同铁源下的生物量 |
制备无铁培养基时,残留的微量8- 羟基喹啉会影响CAS 反应的颜色,造成检测铁载体存在误差。研究显示,铜绿假单胞菌产生的铁载体在400 nm 左右具有特异吸收峰。我们对发酵液的上清进行全波长扫描发现,在402 nm 处也存在特异吸收峰。因此通过测定OD402 初步分析发酵液中铁载体的含量。结果如图 5 所示,在含有PCIH 培养基中,铁载体含量较高,仅次于含有1 μmol/L EDTA-Fe3+ 的培养基。

|
| 图 5 菌株Z158 在不同铁源下的铁载体产量 |
土壤中含有多种微生物能合成铁载体,本研究筛选到的172 株产铁载体菌株,其中PSSP 菌株有13 株,BSP 菌株有159 株。进一步用液体CAS 方法定量测定分离菌株的铁载体产量,发现PSSP 菌株的SU 值均在60% 以上。Pseudomonas.fluorescens sp-f 是目前发现的铁载体产量最大的假单胞菌株,SU 值高达90.0%[11],但菌株的SU 值和对致病菌的抑制效果不具有线性关系,也就是说即使SU 值很大,也有可能无抑菌作用[15]。例如,从稻田中筛选的能有效地抑制Sarocladium oryza 的生长,但SU 只有70%左右[16]。文献报道铁载体的抑菌机制主要是:(1)病原菌自己不产生铁载体或产生量小,不能与铁结合或结合能力很弱;(2)生防菌可以利用病原菌产生的铁载体,而病原菌不能利用生防菌产生的铁载体[17]。而且假单胞菌属分泌pyoverdine 铁载体,该铁载体不能被本属以外的其他菌株吸收利用,使得假单胞菌在生物防控方面具有很大的优势。本研究筛选到的13 株PSSP 菌株,只有P. aeruginosa Z158产生的铁载体对4 种常见致病菌都有抑制作用。
铁是微生物正常生长所需要的一种重要微量元素,当铁营养供给不足,微生物的生长也受到限制,因此可通过微生物的生长情况反映微生物对不同形式铁源的利用效果[2]。当铁以不溶性矿物质形式存在时,微生物产生的铁载体对不溶性铁矿物质中铁的溶解度和溶解速率极其重要[18]。交替单胞菌Alteromonas haloplanktis 产生的铁载体在pH 4.0、ICC=12.9 μmol/L 时,使针铁矿和PCIH 的溶解速率增大至9.5 nmol/h/m2 和3.4 nmol/h/m2[8];门多萨假单胞菌Pseudomonas mendocina 在无铁对照、天然含铁的高岭土和30 μmol/L EDTA-Fe3+ 中的OD600 逐渐增加,但每个细胞分泌的铁载体产量却逐渐降低[19]。本研究中,菌株Z158 在PCIH 为唯一铁源的培养条182 生物技术通报 Biotechnology Bulletin 2015,Vol.31,No.9件下,产生高于无铁对照的铁载体量促进PCIH 中的铁元素的溶解,使12 h 和24 h 下OD600 比无铁条件分别升高了26.6% 和46.1%,说明Z158 产生的铁载体能促进不溶性PCIH 中的铁溶解,进而为自身生长利用。
4 结论本研究筛选到的P. aeruginosa Z158 产生的铁载体可促进不溶性铁化合物的溶解,能够为自身和一些植物的生长提供铁营养,同时还能抑制致病菌的生长,菌株Z158 可作为潜在的生防菌株用于植物疾病防控和促进植物的生长。
| [1] | Hider RC, Kong X. Chemistry and biology of siderophores[J].Natural Product Reprots, 2010, 27(5): 637-657. |
| [2] | Heraman L, Maurice P, Sposito G. Iron acquisition from hydrousFe(III)-oxides by an aerobic Pseudomonas sp.[ J]. ChemicalGeology, 1996, 132 : 25-31. |
| [3] | Dehner CA, Awaya JD, Maurice PA, et al. Roles of siderophores,oxalate and ascorbate in mobilization of iron from hematite bythe aerobic bacterium Pseudomonas mendocina[J]. ApplyEnvironment Microbiology, 2010, 76(7): 2041-2048. |
| [4] | 朱亚玲, 毛得奖, 韩宁. 假单胞菌铁载体及色素研究[J]. 微生物学通报, 2013, 40(3): 500-516. |
| [5] | Rachid D, Ahmed B. Effect of iron and growth inhibitors onsiderophores production by Pseudomonas fluorescens[J]. AfricanJournal of Biotechnology, 2005, 4(7): 697-702. |
| [6] | Lin Y, Du DL, Si CC, et al. Potential biocontrol Bacillus sp. strainsisolated by an improved method from vinegar waste compostexhibit antibiosis against fungal pathogens and promote growth ofcucumbers[J]. Biological Control, 2014, 71 : 7-15. |
| [7] | Pérez MS, Cabirol N, George TR, et al. O-CAS, a fast and universalmethod for siderophore detection[J]. Journal of MicrobiologyMethods, 2007, 70(1): 127-131. |
| [8] | Takahiro Y, Kenichiro H, Hiroshi O. Dissolution of iron hydroxidesby marine bacterial siderophore[J]. Chemical Geology, 2002,184 : 1-9. |
| [9] | Lee J, Postmaster A, Soon HP, et al. Siderophore production byactinomycetes isolates from two soil sites in Western Australia[J].Biometals, 2012, 25(2): 285-296. |
| [10] | 谢志雄, 赵翔, 陈绍兴, 等. 适合高产铁载体细菌筛选、检测体系的改进与探析[J]. 微生物学通报, 2006, 33(6): 95-98. |
| [11] | 陈绍兴, 赵翔, 谢志雄等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f 的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691-695. |
| [12] | Wafaa MH, Mostafa AE. Production and optimization ofPseudomonas fluorescens biomass and metabolites for biocontrol ofstrawberry grey mould[J]. American Journal of Plant Sciences,2012, 3(7): 836-845. |
| [13] | Sambrook J, Russell DW. Molecular Cloning : A Laboratorymanual[M] 3rd ed. New York : Cold Spring Harbor Press, 2001. |
| [14] | Meyer JM, Abdallah MA. The Fluorescent Pigment of Pseudomonasfluorescens : biosynthesis, purification and physicochemicalproperties[J]. Journal of General Microbiology, 1978, 107 : 319-328. |
| [15] | Mattila T, Raaska L. Effects of iron level on the antagonistic actionof siderophores from non-pathogenic Staphylococcus spp.[J].Journal of Industrial Microbiology, 1995, 15 : 480-485. |
| [16] | Balabaskar P, Meera T. Isolation and characterization ofPseudomonas Fluorescens from Rice Fileds[J]. InternationalJournal of Food, 2012, 2(1): 113-120. |
| [17] | Beneduzi A, Ambrosini A, Passaglia LM. Plant growth-promotingrhizobacteria(PGPR): Their potential as antagonists andbiocontrol agents[J]. Genetics and Molecular Biology, 2012, 35(4): 1044-1051. |
| [18] | Stephan MK. Iron oxide dissolution and solubility in the presence ofsiderophores[J]. Aquatic Sciences-Research Across Boundaries,2004, 66(1): 3-18. |
| [19] | Patricia AM, David AA, Larry EH, et al. Siderophore production byan aerobic Pseudomonas mendocina bacterium in the presence ofkaolinite[J]. Chemical Geology, 2002, 188 : 161-170. |




